Sprawozdane Nr2
Ulman Łukasz
Herian Margareta
Sucha Pozostałość:
Jest to pozostałość po odparowaniu wody, wysuszona w temperaturze 378K (105°C) i przeliczona w mg na 1 dm3 wody. W skład suchej pozostałości wchodzą związki organiczne i nieorganiczne, zarówno rozpuszczone - tworzące roztwór właściwy, jak i zawieszone. Sucha pozostałość daje wskazówki o ogólnej zawartości substancji stałych w wodzie.
Wykonanie oznaczenia:
1. Zważyć parownicę (lub krystalizator), wcześniej wysuszoną do stałej masy w
temperaturze 105 °C.
Uwaga!
Masa parownicy wyrażona jest w gramach!. Masę parownicy
zapisujemy do 4 miejsca po przecinku!
2. Do parownicy odmierzyć pipetą 10 cm3 cieczy.
3. Parownicę postawić na rozgrzanej łaźni wodnej (ostrożnie!). Pozostawić tam do
odparowania cieczy.
4. Po odparowaniu wytrzeć spód parownicy i wstawić ją do suszarki (105 °C) na 1
godzinę.
5. Po wysuszeniu wystudzić do temperatury pokojowej w eksykatorze, a następnie
zważyć.
Obliczanie wyników:
X= (a-b) ×1000 [mg/ dm3] / V
gdzie:
a – masa pustej parownicy w miligramach (mg)
b - masa wysuszonej parownicy z osadem w miligramach (mg)
V- objętość badanej próbki pobranej do odparowania (cm3)
1 g = 1000 mg
Dane:
a - 63,4611g = 63461,1 mg
b - 63,3465= 63346,5 mg
V - 10 cm3
X = [( 63461,1- 63346,5) × 1000] / 10 = 114,6x100= 1146 [mg/ dm3]
Twardość wody:
Jest to właściwość polegająca na zużywaniu pewnych ilości mydła, bez wytworzenia piany podczas próby wody. Właściwość tę nadają naturalnej wodzie jony wapnia, magnezu, żelaza, manganu, glinu, cynku oraz innych ciężkich kationów, które tworzą z mydłem dodawanym do wody, nierozpuszczalne mydła wapniowe, magnezowe i inne, nietworzące piany podczas wstrząsania. Piana zaczyna się dopiero wytwarzać wówczas, gdy nastąpi ich całkowite strącenie.
◘ Ilość zużytego przez wodę mydła, do chwili pojawienia się piany charakteryzuje stopień twardości wody.
◘ Twardość wywołana przez wodorowęglany, węglany i wodorotlenki wapnia i magnezu nazywa się twardością węglanową - Tww
◘ Twardość wywołana przez inne związki wapnia i magnezu, nazywa się twardością niewęglanową - TwN
Twardość ogólna = Twardość węglanowa + twardość niewęglanowa - To = TCa + T Mg
◘ Twardość wody w Polsce podajemy w stopniach niemieckich.
1°n = 0,356 mval/dm3
1mval/dm3 - 2,8 °tw
1°n = 10mg/dm3 CaO lub 7,19mg MgO w 1 dm3 wody.
Wykonanie oznaczenia:
1. Do kolby stożkowej odmierzyć 100 cm3 klarownej cieczy.
2. Dodać taką objętość 0,1n KWASU SOLNEGO (HCl), jakiej użyto do oznaczenia
zasadowości)(patrz wcześniejsze instrukcje).
3. Następnie dodać 1 cm3 AMONOWEGO (zwanego również BUFOREM DO
TWARDOŚCI), oraz szczyptę (w praktyce jest niewielka ilość – odrobina na czubku
łyżeczki plastikowej) CZERNI ERIOCHROMOWEJ.
4. Po rozpuszczeniu wskaźnika (czerni eriochromowej), miareczkować
WERSENIANEM SODU do chwili zmiany zabarwienia roztworu z fioletowej na
niebieską. Stężenie wersenianu sodu jest takie, że: 1 cm3 = 0,1 °tw.
5. Odczytać objętość WERSENIANU zużytego do zmiareczkowania próbki.
Obliczanie wyników:
X= × ,1 × 1000/V [°tw]
gdzie:
a – ilość cm3 roztworu wersenianu sodu zużytego do zmiareczkowania próbki,
V- objętość badanej próbki, użytej do oznaczenia (cm3)
a -7,1
v - 100
X= (7,1× 0,1 ×1000 )/100 = 7,1 [°tw]
Twardość wapniowa:
Wykonanie oznaczenia:
1. Do kolby stożkowej odmierzyć 100 cm3 badanej klarownej cieczy.
2. Dodać taką objętość 0,1n KWASU SOLNEGO (HCl), jakiej użyto do oznaczenia
zasadowości
3. Następnie dodać 2 cm3 2n WODOROTLENKU POTASU (KOH), oraz szczyptę
MUREKSYDU (w praktyce jest niewielka ilość na czubku łyżeczki plastikowej,
trochę więcej niż czerni eriochromowej w oznaczeniu twardości ogólnej).
4. Po rozpuszczeniu wskaźnika (mureksydu), miareczkować WERSENIANEM SODU
do chwili zmiany zabarwienia roztworu z różowej na fioletową.
Stężenie wersernianu sodu jest takie ,że: 1 cm3 = 0,1 °tw.
5. Odczytać objętość WERSENIANU zużytego do zmiareczkowania próbki.
Obliczanie wyników
X' = a × 0,1 × 1000/ V × 2,8 [mval/dm3]
X" = a × 0,1 × 1000 × 20 / V × 2,8 [mgCa/dm3]
gdzie:
a – ilość cm3 roztworu wersenianu sodu zużytego do zmiareczkowania próbki,
V- objętość badanej próbki, użytej do oznaczenia (cm3)
Dane:
a - 5,8
V - 100
X' = a × 0,1 × 1000/ V × 2,8 = (5,8 × 0,1 × 1000) / (100 × 2,8) = 2,0714[mval/dm3] =5,7999[°tw]
X" = a × 0,1 × 1000 × 20 / V × 2,8 = (5,8 × 0,1 × 1000 × 20) / (100 × 2,8) = 41,4285 [mgCa/dm3]
Twardość Magnezowa :
Twardość ogólna = Twardość węglanowa + twardość niewęglanowa - To = TCa + T Mg
Dane
To=7,1 [°tw]
TCa =5,8[°tw]
To-TCa =T Mg
7,1 [°tw]-5,8[°tw]=1,3[°tw]
Twardosc Magnezowa wynosi 1,3[°tw]
Fosforany
Związki fosforu, podobnie jak związki azotu , występują w wodach naturalnych i mogą być pochodzenia nieorganicznego bądź organicznego. Związki organiczne zawierające fosfor mogą pochodzic z wydalin ludzkich , ze scieków gospodarczych niektórych ścieków przemysłowych
, jak np.. ścieki z fabryk nawozów sztucznych, zapałek.
W
wodach powierzchniowych czystych zawartość fosforu wynosi 0,01-0,1
mg/dm3 PO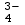 .
.
Dopuszczalne stężenie w wodzie pitnej od 2000r wynosi 5mg P2O5 a od 2010r jest nie normowane.
Wykonanie oznaczenia
Do kolby miarowej na 50 cm3 odmierzyć 50 cm3 badanej cieczy (lub inną objętość wg
zaleceń prowadzącego).
Do drugiej kolbki odmierzyć 50 cm3 wody destylowanej (ślepa próba).
Wystarczy przygotować 1 ślepą próbę dla całej grupy.
Dodać 1 cm3 roztworu KWASU ASKORBINOWEGO i 2 cm3 ODCZYNNIKA
MIESZANEGO.
Kolbki zatkać korkiem i zamieszać.
Odczekać 10 minut, a następnie odczytać absorbancję na spektrofotometrze.
Długość fali 880 nm, kuweta 1 cm.
Odczytaną wartość absorbancji podstawić do wzoru:
c= 0,07 × E×(1000/V) [mg P-PO4 / dm3]
Wyniki
E=0,232
C=0,164(mgP-PO4/dm3)
Chlorki
Sole kwasu solnego , zwane chlorkami, są łatwo rozpuszczalne w wodzie. Wyjątek stanowi tylko chlorek srebrowy(AgCl) , chlorek rtęciawy i miedziawy. Rozpuszczalność chlorku sodowego(NaCl) w wodzie w normalnych warunkach wynosi 360g/l, chlorku magnezowego 335mg/l a chlorku wapniowego 595mg/l
Pochodzenie chlorków to np.
-przenik do wód z pokładów soli
-ze ścieków komunalnych
-ścieki z wód kopalnianych
Dopuszczalne ST. w wodzie pitnej to 250mg/l
Wykonanie oznaczenia
Do kolby stożkowej odmierzyć 100 cm3 badanej klarownej cieczy.
Dodać 0,5 cm3 10% roztworu CHROMIANU POTASOWEGO (K2CrO4).
Miareczkować roztworem mianowanym (1cm3 – 1 mg Cl-) AZOTANU SREBRA
(AgNO3) do zmiany zabarwienia z żółtej na ceglastą (kolor wypalonej cegły).
Odczytać objętość AgNO3 (Uwaga! Inna skala na biuretach).
Obliczanie wyników
X= ((a - 0,3) ×1000)/100 [mgCl-/ dm3]
gdzie:
a – ilość cm3 roztworu AgNO3,
0,3 – poprawka na powstanie Ag2CrO4,
V- objętość badanej próbki, użytej do oznaczenia (cm3)
Wynik otrzymany w laboratorium to :
Agresywny DWUTLENEK WĘGLA:
Jest to część wolnego dwutlenku węgla, która jest niezbędna do zabezpieczenia rozpuszczonych w wodzie wodorowęglanów przed rozkładem. Jest bardzo aktywny i powoduję korozję metali. Ponadto powoduje on rozpuszczanie węglanu wapnia CaCO3 w zaprawach lub betonie i dlatego powinien być usunięty z wody przeznaczonej do celów budowlanych.
Przy ocenie agresywności wody, obok stężenia agresywnego dwutlenku węgla, należy uwzględniać również zawartość soli w wodzie. Woda o takiej samej zawartości agresywnego CO2 jest tym agresywniejsza, im większa jest w niej zawartość soli.
Rozpuszczony wodorowęglan wapniowy powoduje przyrost zasadowości wody.
Wykonanie oznaczenia
1. W badanej cieczy oznaczyć zasadowość M (wobec ORANŻU METYLOWEGO)
2. Do butelki ze szlifem z korkiem o pojemności 125 cm3 (zwanej „tlenówką”)
wsypujemy około 1 g („marmurku”)(w praktyce jest to około 1/3 objętości
łyżeczki plastikowej), a następnie wlewamy do pełna badaną ciecz tak, aby po
zamknięciu butelki korkiem szklanym, nie znajdował się w niej pęcherzyk
powietrza.
3. Podpisaną butelkę odstawiamy na 5 dni. W naszym przypadku na 7 dni.
4. Po 7 dniach zawartość butelki przesączamy przez twardy sączek.
5. Odmierzamy 100 cm3 przesączu do kolby stożkowej.
6. Dalej postępujemy tak jak podczas oznaczania zasadowości, a więc:
Dodajemy 3 krople ŻU METYLOWEGO i miareczkujemy 0,1n KWASEM
SOLNYM (HCl) do pierwszej zmiany zabarwienia z żółtej na łososiową.
Odczytać objętość HCl zużytego do zmiareczkowania próbki.
Obliczanie wyników
X= (b-a ) ×2,2×1000/V [mgCO2/ dm3]
gdzie:
X – stężenie agresywnego dwutlenku węgla,
a – objętość 0,1n HCl zużytego do oznaczenia zasadowości na początku oznaczenia
(pierwszego dnia),
b - objętość 0,1n HCl zużytego do oznaczenia zasadowości po 5 dniach,
V- objętość badanej próbki, użytej do miareczkowania (cm3)
Dane:
a - 1,9
b - 2,5
V - 100
X= ( 2,51,9) × ,2×/V = 13,2 [mgCO2/ dm3]
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE Z farmako, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
sprawko z ćwiczenia 11, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizy
Napiecie powierzchniowe, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fiz
moje sprawko
moje sprawko 4(1), Politechnika Poznańska ZiIP, III semestr, OCiS
moje sprawko 6 z metry
Ćwiczenie nr 12 moje sprawko, MIBM WIP PW, fizyka 2, FIZ 2, 12, sprawko nr 12
janka, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizycznej 1, Sprawozd
moje sprawko 4
moje sprawka wykres n7
CHEMIZM WOD MOJE sprawko
Moje sprawko
moje sprawko 5 z metry(2)
Wspolczynnik podzialu, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyc
moje sprawko 1 z metry(1)
moje sprawko$
Moje sprawko, transformator azowy
moje sprawka, wykresy n 911
szklocw2, Prywatne, Uczelnia, Budownictwo, II Semestr, Materiały Budowlane, MOJE SPRAwka