ZWIĄZKI BORU Z WODOREM - BUDOWA, SYNTEZA, WŁAŚCIWOŚCI, STRUKTURA B2H6, KLASYFIKACJA BORANÓW.
Bor tworzy z wodorem szereg związków o specyficznych właściwościach chemicznych i strukturalnych. Większość związków boru z wodorem da się wyrazić ogólną formułą BnHn+4 lub BnHn+6.
Borany (borowodory)
BnHn+4 |
BnHn+6 |
Inne |
B2H6 |
|
|
|
B4H10 |
|
B5H9 |
B5H11 |
|
B6H10 |
B6H12 |
|
B8H12 |
|
B8H16, B8H18 |
|
B9H15, i-B9H15 |
|
B10H14 |
B10H16 |
B10H18 |
B16H20 |
|
|
n-B18H22, i - B18H22 |
|
|
|
|
B20H16 |
|
|
(BH)∞ |
Monomeryczny BH3 znany jest w postaci kompleksów ze związkami nukleofilowymi (np. z pirydyną, C6H5N:BH3), a w stanie wolnym dimeryzuje ( łączenie się dwóch jednakowych cząstek). Dwa najprostsze stabilne borany są gazami (B2H6 i B4H10), cięższe cieczami np. (B5H9, B5H11, B6H10, B6H12), a B10H14 (dekaboran) jest ciałem stałym. Ponadto wykazują przykry zapach i działają toksycznie. Cechą charakterystyczną boranów jest również duża liczba reakcji, w których jedne borany zmieniają się w drugie. Pozwala to na zbudowanie całej chemii boranów, w oparciu o diboran jako produkt wyjściowy.
W atmosferze powietrza utleniają się, proces ten jednak zachodzi z różną szybkością, np. obydwa pentaborany (B5H9 i B5H11) zapalają się samorzutnie. To samo zjawisko obserwuje się również w przypadku niedostatecznie oczyszczonych preparatów diboranu. Inne borany zapalają się po słabym ogrzaniu. Reagują też z wodą i parą wodną, np.
B2H6 + 6H2O => 2H3BO3 + 6H2
Borany mogą również przyłączać jony wodorkowe, np. w reakcji z wodorkami litowców, tworząc trwałe jony hydroboranowe, takie jak BH4- lub B20H182-
2NaH + B2H6 => 2NaBH4
Zawarte w boranach atomy wodoru mogą również ulegać podstawieniu ( substytucji ) atomami halogenów, ligandami organicznymi, grupą cyjanową.
Budowa boranów jest skomplikowana. Najprostszemu spośród nich, czyli diboranowi przypisuje się strukturę, w której dwa atomy wodoru tworzą mostek pomiędzy oboma atomami boru:
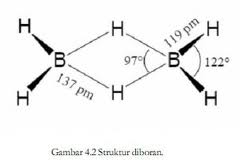
Zewnętrzne atomy wodoru oraz obydwa atomy boru leżą na wspólnej płaszczyźnie, po obu stronach której znajdują się atomy wodoru tworzące mostek.
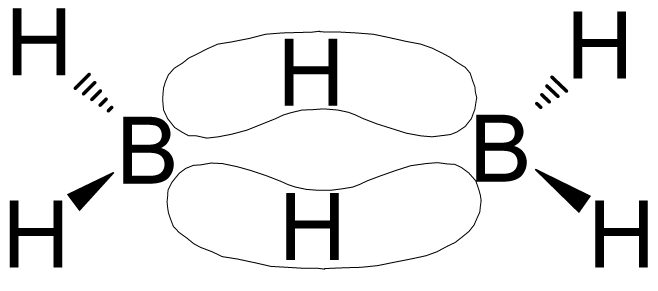
Długość wiązań między atomami boru a zewnętrznymi atomami wodoru wynosi 119 pm, co odpowiada długości przewidywanej dla pojedynczego wiązania kowalencyjnego. Na wytworzenie czterech takich wiązań zużywane jest 8 elektronów walencyjnych. Pozostałe 4 elektrony wytwarzają wiązanie między atomami boru a mostkowymi atomami wodoru. Odległość atomów boru od mostkowych atomów wodoru, wynosząca 137 pm, jest wyraźnie większa niż odległość odpowiadająca zwykłemu pojedynczemu wiązaniu. Natura tych wiązań między atomami boru i mostkowymi atomami wodoru była przedmiotem częstych dociekań. Nie mogą być to wiązania wodorowe, ponieważ różnica elektroujemności między borem i wodorem jest znikoma. Wyjaśnioną dopiero tą zagadkę dzięki teorii orbitali molekularnych. Zgodnie z nią przyjmuje się, że atomu boru ulegają hybrydyzacji sp3. Dwa spośród zhybrydyzowanych orbitali każdego z atomów boru zostają wykorzystane do utworzenia wiązań kowalencyjnych (wiązanie σ )ze skrajnymi atomami wodoru. Pozostałe dwa biorą udział w tworzeniu dwu zdelokalizowanych orbitali cząsteczkowych trójcentrowych rozciągających się wokół atomów boru oraz jednego atomu wodoru wchodzącego w
skład mostka. Tego rodzaju zdelokalizowany orbital powstaje na na skutek nakładania się zhybrydyzowanych orbitali sp3 atomów boru na orbital 1s atomu wodoru.
Cząsteczki boranów wyższych niż B2H6 mają szkielet zbudowany z atomów boru, który najczęściej można przedstawić jako fragment ( zdeformowany ) ikosaedru. W tych cząsteczkach pojawiają się oprócz wiązań trójcentrowe również wiązania dwucentrowych.
Poliborany ( wyższe borowodory ) otrzymuje się przez ogrzewanie B2H6 z wodorem w zakresie temp. 370 - 520 K ( 97 - 247 ºC ). Skład produktów zależy zarówno od temperatury, jak i ciśnienia. Ostatecznym produktem jest polimeryczny, brunatny, nielotny poliboran o składzie (BH)∞.
Mieszaninę różnych boranów, z głównym jednak udziałem B4H10, uzyskuje się działając kwasami na borek magnezu, Mg2B2. Produkty te są rozdzielane metodą próżniowej destylacji frakcjonowanej.
Diboran, jako istotny związek ( szereg zastosowań w syntezie chemicznej oraz stosowany jako paliwo rakietowe ) otrzymuje:
1) otrzymuje się ilościowo w eterze, w temp. pokojowej, w reakcji browodorku sodu z fluorkiem boru:
3NaBH4 + 4BF3 → 2B2H6 + 3NaBF4
2) na skalę przemysłową diboran otrzymuje się w wyniku wysokotemperaturowej redukcji fluorku boru wodorkiem sodu:
2BF3 + 6NaH → B2H6 + 6NaF
3) najdogodniejszą metodą syntezy jest reakcja chlorku boru z tetrahydrydoglinianem litu w roztworze eteru dietylowego:
4BCl3 + 3LiAlH4 → 2B2H6 + 3LiAlCl4
Wyszukiwarka
Podobne podstrony:
5.Związki węgla z fluorowcami1, charakterystyka poszczególnych grup układu okresowego
5.Związki węgla z fluorowcami2, charakterystyka poszczególnych grup układu okresowego
związki krzemu z fluorowcami, charakterystyka poszczególnych grup układu okresowego
Związki fluorowców z tlenem, charakterystyka poszczególnych grup układu okresowego
5. Azotek boru- struktura, charakterystyka poszczególnych grup układu okresowego
Związki nitrozylowe, charakterystyka poszczególnych grup układu okresowego
otrzymywanie tlenu i siarki, charakterystyka poszczególnych grup układu okresowego
11) Fosfan, charakterystyka poszczególnych grup układu okresowego
Boraks, charakterystyka poszczególnych grup układu okresowego
BORKI otrzymywanie i klasyfikacja wg Kiesslinga, charakterystyka poszczególnych grup układu okresowe
7. Tlenowe kwasy azotu (H2N2O2, charakterystyka poszczególnych grup układu okresowego
cyjanamid wapnia (azotniak), charakterystyka poszczególnych grup układu okresowego
3. Hydroborany, charakterystyka poszczególnych grup układu okresowego
Spinele, charakterystyka poszczególnych grup układu okresowego
Węgliki i węglany berylowców, charakterystyka poszczególnych grup układu okresowego
skalenie zeolity zw typu ultramaryny, charakterystyka poszczególnych grup układu okresowego
Aluminotermia i termity, charakterystyka poszczególnych grup układu okresowego
5. azydki, charakterystyka poszczególnych grup układu okresowego
10. Fosfor -odmiany alotropowe, charakterystyka poszczególnych grup układu okresowego
więcej podobnych podstron