Przemysław Woiński
166867
Ochrona Środowiska
BiNoŻ
Data: 7.12.2011r
Godziny zajęć: 12:15 - 16:15
Laboratoria Chemii Fizycznej
ĆWICZENIE NR 45
TEMAT: Wyznaczanie rozpuszczalności soli trudnorozpuszczalnej.
Celem ćwiczenie jest wyznaczenie rozpuszczalności soli trudnorozpuszczalnej, oraz wyliczenie iloczynu rozpuszczalności tej soli w wodzie.
Wstęp teoretyczny:
Elektrolitami nazywamy substancje, które stopione lub rozpuszczone ulegają dysocjacji. W roztworze elektrolitu pojawiają się wtedy swobodne jony, co umożliwia m.in. przepływ prądu elektrycznego.
Konduktometr jest urządzeniem służącym do pomiarów zanieczyszczenia, zasolenia; jest również wykorzystywany w miareczkowaniu konduktometrycznym.
Naczynko konduktometryczne zbudowane jest z dwóch platynowych elektrod , oraz (w przypadku naczynka zanurzeniowego) z dziurkowanej osłony szklanej. Stałą określającą naczynko jest
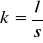
(gdzie: l - odległość między elektrodami; s - powierzchnia elektrody).Przewodnictwo elektrolitów jest przewodnictwem jonowym. Zależy od: temperatury, stężenia, rodzaju elektrolitu (mocny czy słaby), oraz od rodzaju rozpuszczalnika. Wyróżnia się dwa rodzaje przewodnictwa:
przewodnictwo właściwe κ - zdolność przewodzenia prądu przez bryłę o objętości jednostkowej; równe jest odwrotności rezystancji właściwej
przewodnictwo molowe (równoważnikowe) Λ - zdolność przewodzenia prądu przez bryłę zawierającą 1 mol elektrolitu
![]()
przewodnictwo molowe graniczne Λ0 - przewodnictwo molowe dla roztworu elektrolitu nieskończenie rozcieńczonego
dla soli trudnorozpuszczalnej
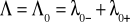
rozpuszczalność soli równa jej stężeniu wynosi
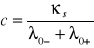
Obliczenia:
Badana ciecz |
Przewodnictwo Γ |
|
||||
|
1 |
2 |
3 |
Średnia |
Średnia [S] |
|
woda [μS] |
3.0 |
3.4 |
3.3 |
3.23 |
3.23E-06 |
0.163E-05 |
roztwór AgI [μS] |
4.3 |
4.5 |
4.4 |
4.4 |
4.40E-06 |
0.222E-05 |
roztwór wzorcowy KCl [mS] |
2.76 |
2.83 |
2.80 |
2.80 |
2.80E-03 |
0.1413 |
stała naczynka konduktometrycznego
![]()
= 50.46 m-1
przewodnictwo właściwe κ badanej soli
![]()
= 5.90E-06 [S/m]
z tablic fizykochemicznych* odczytuje wartości granicznego przewodnictwa molowego jonów
λ0- = 76.85E-04 [mol-1m2Ω-1]
λ0+ = 61.9E-04 [mol-1m2Ω-1]
obliczam rozpuszczalność AgI
![]()
= 4.26E-05 [mol/m3] = 4.26E-08 [mol/dm3]
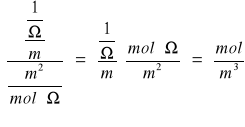
![]()
obliczam iloczyn rozpuszczalności AgI
I = c2 = 1.81E-15
4. Wnioski:
Rozpuszczalność AgI wyniosła 4.26E-08 mol/dm3 a iloczyn rozpuszczalności 1.81E-15. Jednak wyniki te odbiegają trochę od wartości literaturowych (odpowiednio 3.4E-07 mol/dm3 oraz 1.56E-13), co może być spowodowane tym, że badana sól jest trudnorozpuszcalna, a metoda doświadczenia daje lepsze wyniki dla soli łatwiej rozpuszczalnych.
* za „Obliczenia z chemii fizycznej” H. Sugier, M. Przybyt
Wyszukiwarka
Podobne podstrony:
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
15 wyznaczanie ciepła spalania, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chem
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
rad, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr15, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Do druku askorbinowy, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczn
Elektroda szklana, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna c
Podczas wymuszonego przep+éywu p+éynu, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wsz
27 poprawa 2, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, Chemia fizyczna
POLSKI, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spraw
spr26, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
lab50as, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spra
hk spr numer 23, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
więcej podobnych podstron