Laboratorium „Inżynieria bioreaktorów” dla kierunku „Biotechnologia”
Prowadzący: dr. hab. Jolanta Bryjak
Mgr inż. Marta Bochno
Reaktory przepływowe - kolumna ze złożem upakowanym
Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji D-glukozy do D-fruktozy
Cel ćwiczenia: zapoznanie się z procedurą postępowania przy wyznaczaniu stałych równania kinetycznego reakcji równowagowej; prowadzenie procesu w kolumnie ze złożem upakowanym z immobilizowaną izomerazą glukozową
Izomeryzacja glukoza↔fruktoza
Reakcja enzymatycznej izomeryzacji D-glukozy jest przykładem reakcji równowagowej, w której enzym wykazuje powinowactwo zarówno do substratu, jak i produktu reakcji. Reakcję izomeryzacji glukozy (G) i fruktozy (F) przedstawia schemat (1), który, przy założeniu, że szybkości przekształcania kompleksów aktywnych (GE ⇔ GF) są bardzo duże upraszcza się do schematu (2).
G + E ⇔ GE ⇔ GF ⇔ F + E (1)
G + E ⇔ GE ⇔ F + E (2)
W badaniach kinetycznych szybkość reakcji w obecności różnych początkowych stężeń substratu mierzona jest zazwyczaj w bardzo wczesnym stadium reakcji, zanim stężenie produktu wzrośnie do znaczącego poziomu (stopień przereagowania substratu < 3%). Przy spełnieniu tego warunku, można wyznaczyć parametry kinetyczne reakcji zarówno w kierunku G→F, jak i F→G, stosując odpowiednie równania Michaelisa-Menten:
![]()
G→F: ![]()
![]()
![]()
(3)
F→G: ![]()
![]()
(4)
gdzie: VmaxG, VmaxF - stałe szybkości reakcji dla glukozy lub fruktozy jako substratu;
KmG, KmF - stałe Michaelisa dla glukozy lub fruktozy jako substratu
Rozpatrując przebieg procesu izomeryzacji, należy wziąć pod uwagę fakt obecności substratu i produktu reakcji w mieszaninie reakcyjnej, co m. in. pozwala oszacować kierunek przebiegu reakcji. Kierunek reakcji zależy od relacji między stosunkiem CF / CG a stosunkiem równowagowym (Keq). Np., jeżeli Keq = 1, CF = 5 mM i CG = 1 mM, to reakcja będzie przebiegać w kierunku F→G i osiągnie stan równowagi termodynamicznej dla CF* = 3 mM i CG* = 3 mM (CF*,CG* - stężenie glukozy i fruktozy w stanie równowagi termodynamicznej). Natomiast szybkość reakcji (r) dla danych wartości CF i CG nie może być policzona jako różnica szybkości reakcji r = rG - rF z równań (1) i (2), gdyż równania te oparte są na założeniu, że, odpowiednio, CF lub CG są równe zero. W takim przypadku należy zastosować równanie uwzględniające wpływ obu reagentów, tzn. w miarę postępu reakcji obniżające się wysycenie enzymu substratem i wzrastający udział reakcji w kierunku przeciwnym. Jeżeli założymy, że część enzymu nie jest dostępna dla substratu, gdyż reaguje z produktem, to możemy to zjawisko przybliżyć modelem przewidzianym dla inhibicji kompetycyjnej. Wówczas:
G→F: 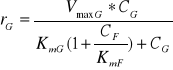
(5)
F→G: 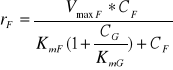
(6)
a szybkość reakcji np. w kierunku G→F: r = rG - rF (7)
Po przekształceniach algebraicznych równanie (7) przyjmuje postać:
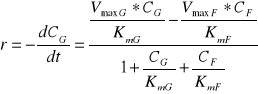
(8)
W równaniu (8) 4 stałe kinetyczne ze stałą równowagi Keq wiąże równanie Haldana:
Keq = CF* / CG* =![]()
(9)
Powyższe równanie ma bardzo duże znaczenie praktyczne. Między innymi służy do szybkiej weryfikacji poprawności wyznaczonych stałych z uproszczonych równań (3) i (4). Jeżeli dysponuje się doświadczalnie wyznaczoną wartością Keq, to można ją porównać z wartością obliczoną na podstawie równania Haldana. Różnica między wartością eksperymentalną i obliczoną ze stałych równań kinetycznych rzędu błędu analitycznego pozwala stwierdzić poprawność wyznaczonych wartości stałych.
MATERIAŁY I METODY
Materiały
immobilizowana izomeraza glukozowa (poprawnie: izomeraza ksylozowa) otrzymana nieodpłatnie z firmy Novozyme;
- objętość całkowita złoża - 20 cm3
- objętość wolna reaktora - 6.8 cm3
- temperatura procesu - 40° C
roztwory glukozy i fruktozy;
0.05 M bufor tris-HCl + 3 mmol Mg, pH 7.8 w 40 °C;
odczynniki do enzymatycznego oznaczania stężenia glukozy
Aparatura
spektrofotometr UV-VIS Shimadzu;
termostatowane reaktory kolumnowe
pompy tłokowe Prominent
Metody
Oznaczanie stężenia glukozy testem enzymatycznym.
Zasada metody. Glukoza pod wpływem oksydazy glukozowej utlenia się do kwasu glukonowego z wytworzeniem nadtlenku wodoru, który w obecności peroksydazy powoduje zmianę zabarwienia chromogenu.
Oznaczanie stężenia glukozy. Do suchych i czystych probówek wprowadzić po 1 cm3 roztworu roboczego. Przygotować również 2 probówki na standard glukozy i kontrolę. Z probówek zawierających odpowiednio rozcieńczone próbki badane oraz z próbki zawierającej standard pobrać po 10 μl roztworu i wprowadzić do roztworów roboczych. Każdorazowo kilkakrotnie przepłukać końcówkę roztworem roboczym. Całość wstawić na 5 min do łaźni wodnej o temperaturze 37 °C, a następnie zmierzyć absorbancję (500 nm) wobec próby kontrolnej.
Obliczanie stężenia glukozy. Wartość absorbancji dla standardu glukozy przyjąć jako 15 mmol/L. Z proporcji obliczyć stężenie w próbkach badanych, uwzględniając rozcieńczenie.
Rozcieńczenia. W przypadku fruktozy, jako substratu, pobranych próbek nie rozcieńczać. Stosując jako substrat glukozę, należy wykonać rozcieńczenia:
Stężenie glukozy [mM] |
Rozcieńczenie [-] |
Objętość roztworu badanego [μl] |
Objętość wody [ml] |
50 |
2x |
1000 |
1,0 |
100 |
3x |
1000 |
2,0 |
200 |
10x |
1000 |
9,0 |
400 |
20x |
500 |
9,5 |
600 |
20x |
500 |
9,5 |
800 |
40x |
250 |
9,75 |
1000 |
40x |
250 |
9,75 |
1250 |
50x |
200 |
9,8 |
1500 |
50x |
200 |
9,8 |
1750 |
100x |
100 |
9,9 |
Wyznaczanie wartości Keq reakcji izomeryzacji.
Do 5 cm3 0,05 M roztworu glukozy dodać 50 μl natywnej izomerazy glukozowej i umieścić w łaźni wodnej o temperaturze 40 °C celem osiągnięcia stanu równowagi termodynamicznej. Zadaniem każdej grupy jest pobranie próbki z wyjściowego roztworu substratu oraz z mieszaniny reakcyjnej, rozcieńczeniu próbek wodą destylowaną (podane w tabeli) oraz oznaczenie stężenie glukozy metodą enzymatyczną.
Pomiar zmiany stężeń reagentów w warunkach początkowej szybkości reakcji.
Przygotować po 500 cm3 dwóch roztworów glukozy lub fruktozy o podanych przez osobę prowadzącą stężeniach. Do termostatowanych (40°C) reaktorów kolumnowych ze złożem upakowanym dozować substrat z podanymi szybkościami przepływu (pompa „mała” - 60/120; 40/120; 20/120; 10/120 / pompa „duża” - 15/120; 7,5/120; 2,5/120; 0/120). Dla każdego przepływu zmierzyć strumień (zmierzyć czas napełnienia cylindra na 50 cm3), a następnie pobrać próbkę do analiz z wylotu z reaktora, zwracając uwagę na osiągnięcie stanu ustalonego. Należy również pobrać próbkę substratu na wejściu reaktora. Wszystkie próbki odpowiednio rozcieńczyć i oznaczyć stężenie glukozy testem enzymatycznym.
WYNIKI I ICH OMÓWIENIE
Na podstawie otrzymanych wyników obliczyć dla enzymu immobilizowanego:
VmaxG, VmaxF , KmG, KmF i przedstawić analizę otrzymanych wyników;
obliczyć stałą równowagi Keq z otrzymanych wartości stałych równania kinetycznego i porównać z wartością Keq, wyznaczoną eksperymentalnie.
Sprawozdanie winno zawierać: (1) wstęp (np. o enzymie, jego wykorzystaniu w przemyśle, ale przede wszystkim o reaktorze ze złożem upakowanym z immobilizowanym enzymem); (2) metodykę (należy pamiętać o formie bezosobowej np. dodano, zmierzono...); (3) przedstawienie wyników i ich dyskusję (podstawowe obliczenia powinny być zamieszczone w sprawozdaniu na wybranym przykładzie; jeżli pozostałe wyniki były liczone identycznie, resztę można przedstawić w tabelach/wykresach zbiorczych).
ZAGADNIENIA DO WEJŚCIÓWKI:
Równanie bilansowe dla reaktora przepływowego (wzór z oznaczeniami co jest co).
Szybkość reakcji w reaktorze przepływowym (wzór z oznaczeniami co jest co).
Definicja stanu ustalonego.
Czas przebywania (wzór z oznaczeniami co jest co)..
Uwaga! Enzymatyczna metoda oznaczania stężenia glukozy jest mikrometodą. Zlewki, cylindry, probówki, itd. należy przed myciem przepłukać wodą z kranu, następnie umyć wodą z dodatkiem niewielkiej ilości “Ludwika”, po czym płukać dużą ilością wody z kranu (15x) i 3x wodą destylowaną. I należy pamiętać, że wszystko ma też powierzchnię zewnętrzną. Ponieważ sprawozdanie opiera się na wynikach wszystkich grup ćwiczeniowych, nieuwaga 1 osoby może być przyczyną złych wyników grup następnych. Konsekwencje braku utrzymania odpowiedniej czystości szkła laboratoryjnego (co jest łatwe do sprawdzenia): kłopoty z wyznaczeniem stałych równania kinetycznego, brak zgodności ze stałą równowagi reakcji, problemy z oceną z ćwiczeń.
![]()
Wyszukiwarka
Podobne podstrony:
reaktor przepływowy - izomeryzacja G-F - instrukcja, Materiały Na Studia
Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji D – glukozy do D fruktozyx
Bryjak, inżynieria bioreaktorów L, reakcja izomeryzacji D glukozy do D fruktozy teoria
Izomeraza sprawko, [3] Izomeraza glukozowa
bioreaktory sprawko cegła, inżynieria bioreaktorów lab, [3] Izomeraza glukozowa, nie moje
Izomeraza glukozowa
Wyznaczanie stałych równania kinetycznego reakcji izomeryzacji D – glukozy do D fruktozy(1)
Geodezja wyklad 6 instrumenty geodezyjne (11 04 2011)(1)
instrukcja reaktor 1
instrukcje do cwiczen laboratoryjnych 2011, WSZOP INŻ BHP, V Semestr, TOKSYKOLOGIA
Reaktor przepływowy pracuj±cy izotermicznie (2), 1
Reaktor przepływowy pracuj±cy adiabatycznie (3), 1.3 PRZEP?YWOWY REAKTOR ZBIORNIKOWY PRACUJ?CY W WAR
pwsz kalisz PROJEKT zbiornikowego reaktora przepływowego = PROCESY jednostkowe, inżynieria ochrony ś
Instrukcja CEIDG 1 10 pazdziernika 2011
Bateria reaktorów przepływowych z idealnym mieszaniem (5), 1
Instrukcja SIL 14 07 2011
Instrukcja CEIDG 1 30 sierpnia 2011
Geodezja wykład 6 instrumenty geodezyjne (11 04 2011)
Instrukcja CEIDG 1 10 pazdziernika 2011
więcej podobnych podstron