WPŁYW STĘŻENIA NA STAN RÓWNOWAGI REAKCJI CHEMICZNEJ |
ĆW.17. |
Cel ćwiczenia
Równowaga chemiczna jest to taki stan reakcji odwracalnej: aA + bB cC + dD (w stałej temperaturze), w której reakcja prosta i odwrotna przebiegają z tą samą szybkością. Stężenia produktów i substratów nie zmieniają się, a stosunek stężeń produktów do substratów ma stałą wartość K (tzw. stała równowagi):
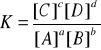
(prawo działania mas, Guldberg i Waage)
Równowaga chemiczna jest stanem dynamicznym. Ponieważ obecne w układzie substancje ciągle tworzą się i reagują z tą samą szybkością, stężenia substratów i produktów są stałe w stanie równowagi. Pojawia się jednak pytanie, jak taki układ zareaguje, jeśli zmieni się stężenie jednego z substratów. Szybkości reakcji prostej i odwrotnej zmienią się. Kiedy równowaga się znowu ustali, nowe stężenia będą różniły się od poprzednich. Ponieważ wartość stałej równowagi K musi pozostać niezmieniona, nowe wartości stężeń muszą być zgodne z prawem działania mas.
Celem ćwiczenia jest ustalenie czy zmiana stężenia substratów w reakcji będącej w równowadze wpływa na wydajność tworzenia się rodanku żelaza(III).

Odczynniki:
► 0,003 M chlorek żelaza(III), FeCl3
► 0,009 M rodanek potasu, KSCN
► nasycony roztwór chlorku żelaza(III), FeCl3
► nasycony roztwór rodanku potasu, KSCN
► krystaliczny chlorek potasu, KCl
Sprzęt laboratoryjny:
► 4 probówki
► 2 pipety miarowe o pojemności 5 cm3
Wykonanie ćwiczenia:
Wprowadź 2 cm3 0,003 M roztworu chlorku żelaza(III), FeCl3 i 2 cm3 0,009M roztworu rodanku potasu, KSCN do każdej z czterech probówek. Odczekaj kilka minut, aż w roztworach ustali się stan równowagi chemicznej.
Pierwszą probówkę pozostaw jako wzorcową.
Do drugiej probówki dodaj kilka kropli nasyconego roztworu chlorku żelaza(III).
Do trzeciej probówki dodaj kilka kropli nasyconego roztworu rodanku potasu.
Do czwartej probówki dodaj kilka kryształków krystalicznego chlorku potasu.
Następnie zaobserwuj różnice intensywności zabarwienia roztworów w probówkach 2, 3 i 4 w porównaniu z roztworem w probówce 1 (wzorcowej).
Dyskusja:
1. Napisz równanie reakcji zachodzącej pomiędzy chlorkiem żelaza(III) a rodankiem potasu.
2. Która substancja powoduje intensywne czerwone zabarwienie roztworów w probówkach?
3. Napisz wyrażenie na stałą równowagi tej reakcji.
4. Co zmieniło się po dodaniu substratu FeCl3 do układu będącego w równowadze? (odpowiedz biorąc pod uwagę intensywność czerwonej barwy roztworu).
5. Jakie zmiany zaszły po dodaniu substratu KSCN do reakcji będącej w równowadze?
6. Co dzieje się, jeśli produkt reakcji KCl jest dodawany do reakcji będącej w równowadze? (weź pod uwagę zmianę intensywności zabarwienia).
7. Jak zmienia się wydajność dowolnej reakcji chemicznej, jeśli do układu w stanie równowagi dodawane są substraty reakcji?
Wyszukiwarka
Podobne podstrony:
7 równowaga chemiczna sprawozdanie
Lista 4 Równowagi chemiczne
Równowaga chemiczna
Równowagi chemiczne
Wykład 2, Równowagi chemiczne, woda
Chemia IX Rownowagi Chemiczne id 112320
06 Równowaga Chemiczna
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
08 Równowagi chemiczneid 7495
8-STAN RÓWNOWAGI CHEMICZNEJ, STAN RÓWNOWAGI CHEMICZNEJ
Rownowaznik chemiczny, bio, Chemia, Biofizyka, Toksykologia, Wykład PWrocławska
Laboratorium 5 Kinetyka i równowaga chemiczna
7 równowaga chemiczna instrukcja
RÓWNOWAGA CHEMICZNA
Wyklad 10. Rownowaga chemiczna, chomikowe, WYKŁADY z Chemii
7.Prawo działania mas - równowaga chemiczna, Chemia ogólna ćwiczenia
Definicje równoważnik chemiczny, Materiały - Biotechnologia
więcej podobnych podstron