Artur Mazurek
Technologia chemiczna, rok II
A1P
W wyniku ogrzania gazu A jego entalpia wzrosła o 5,00 kJ/mol. Jaką temperaturę osiągnął gaz w tym procesie, jeżeli wiadomo, że proces prowadzono pod stałym ciśnieniem równym 1 bar, a początkowa temperatura gazu wynosiła 20°C ?
A: CH4 - metan
W warunkach izobarycznych proces wymiany ciepła charakteryzuje równanie:
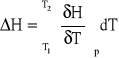
(1)
gdzie:
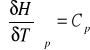
(2)
zatem
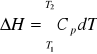
(3)
Na podstawie „Termodynamiki chemicznej stosowanej” J. Szarawary, strona 587, tabl. 18.7, WNT 1997 ciepło molowe dla metanu dane jest w postaci wielomianu:
Cp = 22,35 + 48,14⋅10-3T [J/(mol⋅K)]
ponadto wiemy, że:
ΔH = 5000 [J/mol]
T1 = 20°C = 293,15 K
Po podstawieniu Cp do równania (3), scałkowaniu i przekształceniu otrzymujemy:
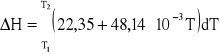
22,35⋅(T2 - 293,15) + 1/2⋅48,14⋅10-3⋅(T22 - 293,152) = 5000
22,35⋅ T2 - 6551,9025 + 24,07⋅10-3 T22 - 2068,5017 = 5000
24,07⋅10-3 T22 + 22,35⋅ T2 - 13620,404 = 0
Δ = b2 - 4⋅a⋅c = 1810,895
![]()
![]()
![]()
x1 = 419,71 K x2 = -1348,25 K
Ponieważ wartość x2 jest mniejsza od początkowej temperatury gazu (zgodnie z treścią zadania gaz ogrzano czyli zwiększył swoją temperaturę) zatem szukaną końcową temperaturą gazu jest wartość :
T2 = 419,71 K
Wyszukiwarka
Podobne podstrony:
Zadanie A1P, Studia, Politechnika
ZADANIE A7(9), Studia, Politechnika
ZADANIE A7(0), Studia, Politechnika
Zadanie IVa, Studia, Politechnika
ZADANIE A7, Studia, Politechnika
ZADANIE A7(11), Studia, Politechnika
Zadania z matematyki z 30, Politechnika Lubelska, Studia, Studia, Sprawozdania, studia, Matematyka,
49. Zadania WOT, STUDIA EDB, Obrona narodowa i terytorialna
Zadanie koncowe, Studia PŁ, Ochrona Środowiska, Biochemia, laborki, sprawka
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
więcej podobnych podstron