W臉GLOWODORY-to zwi膮zki w czasteczkach kt贸rych wystepuj膮 wy艂acznie atomy wegla i wodoru.
*alkany-tworzaszereg homologiczny o wzorze og贸lnym CnH2n+2 ( gdzie n oznacza liczbe atom贸w wegla w czasteczce) Wi膮zanie wegiel- wod贸r praktycznie nie jest spolaryzowane, zatem czasteczki alkan贸w s膮 na og贸艂 nie rozpuszczalne. Te mniepolarne czasteczki nie moga utworzyc zm czasteczkami wody wi膮za艅 wodorowych, co jest warunkiem rozpuszczalnosci w wodzie. Alkany jako substancje hydrofobowe s膮 praktycznie nie rozpuszczalne w wodzie a rozpuszczaj膮 sie w rozpuszczalnikach org czyli substancjach hydrofobowych. Charakterystyczn膮 cecha alkan贸w jest zdolno艣c do reakcji substytucji(podstawiania)
*alkeny- to weglowodory 艂ancuchowe w czasteczkach ktorych wystepuje jedno wiazanie podwojne miedzy atomami wegla. Tworza szereg homologiczny o wz CnH2n. Charakterystyczna cech膮 alen贸w jest zdolno艣膰 do reakcji addycji i reakcji polimeryzacji.
*alkiny- weglowodory 艂ancuchowe , w kt贸rych czasteczkach wystepuje jedno wiazanie potr贸jne miedzy atomami w臋gla. Tworz膮 szereg homologiczny o wzorze CnH2n-2. Wiazanie potr贸jne sk艂ada si臋 z jednego wi膮zania mocnego sigma i dw贸ch wi膮za艅 pi- poniewa偶 wiazania pi ulegaj膮 艂atwo rozerwaniu podczas reakcji chemicznej- fakt ten decyduje o duzej aktywnosci alkin贸w. Charakterystyczn膮 cech膮 alkin贸w jest zdolno艣膰 do rakcji addycji i polimeryzacji.
ALKADIENY- to zwi膮zki w cz膮steczkach, kt贸rych wystepuj膮 dwa wi膮zania podw贸jne. W zale偶no艣ci od wzajemnego u艂o偶enia wi膮za艅 podw贸jnych wzgledem siebie wyr贸znia sie alakieny posiadaj膮ce w cz膮stecze:
* wiazania w uk艂adzie skumulowanym C=C=C
* wiazania w uk艂adzie sprz臋偶onym C=C-C=C
* wiazania w uk艂adzie izolowanym C=C-C-C-C=C
Alinfatyczne alkadieny tworza szereg homologiczne o wzorze CnH2n-2
ALKANY OTRZYMYWANIE
*reakcja Wurtza
jodopropan + Na --> heksan + jodos贸d
2 C3H7I + 2 Na--> C6H14 + 2 NaI
* katalityczne uwodorowienie alken贸w lub alkin贸w:
prop-2-en + H2 --> propan
propyn + 2H2 --> propan
ALKANY ULEGAJA
* substytucja(podstawianie)(F, Cl, Br, I)-
- propan + Cl2 --> hv chloropropan + chlorowod贸r
- chloropropan + Cl2--> hv dichloropropan + chlorowod贸r
- dichloropropan + Cl2 -->hv trichloropropan + chlorowod贸r
- trichlorowod贸r + Cl2 --> hv tetrachloropropan + chlorowod贸r
* 1-chloroetan + NaOH--> etanol + chlorek sodu
Mechanizm tej reakcji mozna wyt艂umaczyc tworzeniem rodnik贸w. Wolne rodniki -to bardzo aktywne atomy lub gr atom贸w charakteryzujace sie obecno艣ci膮 niesparowanego elektronu.
Cl2--> hv 2Cl* CH4 + Cl* -->hv CH3 + HCl* CH3* +Cl2 --> hv CH3Cl Cl*
ALKINY ULEGAJ膭
*uwodorowienie cz臋sciwe
etyn + H2 --> eten
*uwodorowienie ca艂kowite
etyn + 2H2 --> etan
* addycja halogen贸w ( Br, Cl, J)
etyn + Br2 --> 1,2- dibromoetan
1,2-dibromoetan + Br2 --> 1,1,2,2, -tetrabromoetanALKENY OTRZYMYWANIE
* eliminacja wody z alkoholu
propanol --->Al2O3/ T propen + woda
* eliminacja halohenowodoru z monohalogenopochodnej w srodowisku alkoholowym (reakcja zgodnie z regu艂a Zajcewa)
2-chlorobutan + KOH-->alkohol buten + chlorekpotasu + woda
* eliminacja czasteczki halogenu z dihalogenopochodnej
1,2-dichloropropan + Zn--> propen + ZnCl2
* eliminacja atomu wodoru z weglowodor贸w
etan--> T eten + H2
* otrzymywanie etynu (acetylenu) w reakcji karbidu ( wegliku wapnia) z woda
CaC2 + 2 H2O--> C2H2 + Ca(OH)2
*etyn + H2 --> eten
ALENY ULEGAJA
*przy艂anczanie wodoru ( kat. Pt, Pd, Ni)
eten + H2 -->kat. etan
*addycja wody
eten + H2O -->H+ etanol( alkohol etylowy)
*addycja halogenowodor贸w ( HCl, HBr, HI)
eten + HCl --> chloroetan
* addycja halogenu ( w 艣rodowisku CCl4) Cl2, Br2 - potwierdza charakter nienasycony weglowodoru
propen + Br2--> 1,2-dibromopropan
* z KMnO4 - potwierdza charakter nienasycony weglowodoru, wytr膮ca sie osad
2 KMnO4 + 3 eten + 4 H2O --> 3 etan-1,2-diol + 2 MnO2 + 2KOH
* polimeryzacja
n CH2=CH2 -----> (-- CH2-- CH2 --)n
eten(etylen) monomer --> polietylen ( polimer)
ALKINY OTRZYMYWANIE
*odwodornienie alkan贸w i alken贸w w obecno艣ci katalizatora pod wp艂ywem temperatury
etan-->kat. etyn + 2H2
eten-->kat. etyn + H2
*otrzymywanie etynu z karbidu w reakcji z wod膮
CaC2 + 2H2O --> etyn + Ca(OH)2
otrzymywanie etynu z metanu podczas pirolizy
2 metan ---> etyn + 3H2
* addycja wody- zachodzi pod wp艂ywem H2SO4, HgSO4 w srod kwasowym . powstajacy w pierwszym etapie enol natychmiast ulega przygrupowaniu w zwiazek karbonylowy: aldehyd lub keton. Ten proces przygrupowania nosi nazw臋 tautomerii keto- enolowej
etyn + H2O --> etanal (aldehyd octowy)
* addycja halogenowodor贸w( HBr, HCl, HJ)
etyn + HCl--> chloroetan
ALKOHOLE- to zwi膮zki zawieraj膮ce grup臋 funkcyjn膮 -OH zwi膮zan膮 z tetraedrycznym atomem w臋gla. Grupa -OH nosi nazwe grupy hydroksylowej. R-OH to og贸lny wz贸r alinfatycznych alkoholi monohydroksylowych. W艂a艣ciwo艣ci fizyczne- alkohole s膮 zwi膮zkami polarnymi, poniewa偶 w cz膮steczce zwi膮zku wyst臋puje polarna grupa -OH. Atom wodoru obecny w hrupie hydroksylowej powoduje , 偶e pomiedzy czsteczkami tych substancji powstaje wi膮zanie wodorowe. Wi膮zanie wodorowe powoduje 偶e substancja w kt贸ej ono wyst臋puje maj膮 du偶膮 temperatur臋 wrzenia pomimo ma艂ej masy cz膮steczkowej. Alkohole kt贸re w cz膮steczce posiadaj膮 ma艂膮 ilo艣膰 atom贸w w臋gla rozpuszczaj膮 si臋 w wodzie bardzo dobrze- wraz ze wzrostem ilo艣ci w臋gli w zwi膮zku rozpuszczalno艣ci substancji w wodzie maleje- dobrze rozpuszczaj膮 sie tylko trzy pierwsze alkohole z szeregu homologicznym. Wodne roztwory alkoholi nie przewodza pradu elektrycznego. Alkohole maj膮 odczyn oboj臋tny. Pierwsze pi臋膰 alkoholi to ciecze pozosta艂e s膮 cia艂ami sta艂ymi. W艂膮艣ciwo艣ci chemiczne- wodne roztwory alkoholi maja odczyn obojetny , posiadaj膮 w艂a艣ciwo艣ci amfoteryczne.
ALKOHOLE NASYCONE-alkohol kt贸ry posiada w 艂a艅cuchu weglowym tylko wiazanie pojedyncze.
ALKOHOL NIENASYCONY - alkohol kt贸ry posiada w 艂a艅cuchu w臋glowym wi膮zania wielokrotne, szcze贸ln膮 grup臋 stanowia enole.
ENOLE-zwiazki zawieraj膮ce przy atomie wegla z podw贸jnym wi膮zaniem gryp臋 OH, sa nietrwa艂e szybko ulegaj膮 tautometrii do odpowiedniego aldehydu lub ketonu.
tautometria- zjawisko polegaj膮ce na wzajemnym przechodzeniu jednego izomeru strukturalnego w drugi az do osiagniecia rownowagi.
metanal- jest truj膮cy; wch艂anianie pary albo wypicie kilkunastu gram贸w mo偶e spowodowa膰 艣lepot臋 a nawet 艣mier膰, gdy偶 w organizmie utlenia sie do bardzo reaktywnego formaldehydu: metanol--> [O] CH2O . Metanol otrzymany by艂 dawniej w procesie suchej destylacji drewna, st膮d nazwa spirytus drzewny. Obecnie du偶e ilo艣ci metanolu powstaj膮 w reakcji katalicznego uwodorowienia tlenku w臋gla CO + 2H2--> CH3OH (ZnO + Cr2O3, T) Metanol wykorzystywany jest do produkcji formaldehydu i innych zwi膮zk贸w jako rozpuszczalnik i ciecze zapobiegaj膮ce zamarzaniu.
etanol-otrzymywany jest obecnie w wyniku fermentacji cukru: C6H12O6--> enzymC2H5OH 2CO2 lub te偶 na drodze syntetycznej z etylenu w reakcji addycji wody w 艣rodowisku kwa艣nym : etylen + H2O--> H+ etanol. Etanol wchodzi w sk艂ad fermentowanych napoj贸w ( piwo, wino, w贸dka) stosowany jest jako rozpuszczalnik, jako miejscowy p艂yn antyseptyczny, wykorzystywany do produkcji eteru i estr贸w etylowych; handlowy etanol zwany spirytusem jest roztworem zawieraj膮cym 95% alkoholu i 5% wody- wody nie mo偶na usun膮 w wyniku destylacji , dlatego te偶 aby uzyska膰 alkohol absolutny dodaje sie wapno palone kt贸re w reakcji z wod膮 daje wodorotlenek wapnia.
Alkohole dzielimy na
*ze wzgl臋du na ilo艣膰 grupy wodorotlenowej na - jednowodorotlenowe/monohydroksylowe(metanol) - wielowodorotlenowe/polihydroksylowe( glikol etylowy)
*ze wzgledu na budowe grupy weglowodorowej na -alinfatyczne(propanol) cykliczne
(cykloheksanol) -aromatyczne (fenylometanol)
*ze wzgledu na rz臋dowo艣膰 atom贸w w臋gla -10 (etanol) -20 (propan-2-ol)
-30 (2-metylopropan-2-ol)
Glikol etylowy-(etano-1,2-diol)- ciecz o s艂odkim smaku , bezbarwna, rozpuszczalna w wodzie, trujaca o wysokiej temperaturze wrzenia, stosowana do produkcji p艂ynu boryego.Otrzymywana * z oksiranu( tlenek etyleny) C2H4 + H2O --> etano-1,2-diol, * z etynu lub etenu w wyniku utleniania KMnO4 * w reakcji 1,2, - dichloroetanem z KOH * utlenia sie do kwasu szczawiowego ( glikol -->[O] kw. szczawiowy * raguje z metalami alkalicznymi tworz膮c alkogolany ( glikol + Na--> glikolan sodu + H2 *reaguj膮 z wodorotlenkami lub tlenkami metali cie偶kich ( CuO) daj膮c alkoholany (glikol + Cu(OH)2--> 2 H2O + glikolan miedzi)
Gliceryna(propano-1,2,3-triol)- syropowata ciecz o s艂odkim smaku, bezbarwna, rozpuszczalna w wodzie, jej koj膮ce w艂aciwo艣ci czyni膮 j膮 bardzo w kosmetykach stosowanych przy goleniu, w myd艂ach toaletowych, a takze w kroplach i syropach przeciwkaszlowych, ma w艂asciwo艣ci higroskopijne. Otrzymywanie: * w reakcji z 1,2,,3 - trichloropropanem w reakcji z KOH ( 1,2,3-trichloropropan +3KOH--> propano-1,2,3-triol + 3 KCl) * reaguje z kwasem azotowym tworz膮c trioazotan(V) glicerlu( nitrogliceryn臋) (gliceryna + 3HNO3--> trizaotan(V) glicerolu + wode) * raguje z metalami alkalicznymi tworz膮c alkogolany ( gliceryna + Na--> glicerynian sodu + H2 * reaguj膮 z wodorotlenkami lub tlenkami metali cie偶kich ( CuO) daj膮c alkoholany (gliceryna + Cu(OH)2--> 2 H2O + glicerynian miedzi)
OTRZYMYWANIE ALKOHOLI
*katalityczne uwodnienie alken贸w
eten + H2O -->H+ etanol
* katalityczne utlenienie alkan贸w
metan + O2 --> metanal
* reakcja halogenoalkan贸w z mocnym zasadami w 艣rod wodnym
bromoetan + KOH --> etanol + bromekpotasu
*w wyniku chlorowcopochodnej alkanu z wod膮
chlorometan + H2O--> metanol + HCl
*w wyniku redukcji zwiazk贸w karbonylowych
CH3CH=CH-CHO(aldehyd ketonowy) + H2--> Ni butanol
*redukcja aldehyd贸w do alkoholi 1O
etanal + H2--> kat. etanol
* redukcja keton贸w do alkoholi 2o
propanon + H2--> kat 2-propanol
ALKOHOLE ULEGAJ膭:
*z aktywnymi metalami ( Na, K, lub Mg i Ca na goronco)
propanol + Na--> propanolan sodu(C3H7ONa) + H2
... C3H7ONa + H2O --> propanol + NaOH
*reakcja estryfikacji ( z kwasami karbonylowymi)
2 etanol + HCOOH--> 2 CH3CH2OCOH(mr贸wczan etylu) + H2O
*z halogenowodorami (HI, HBr, HCl)
etanol + HCl --> chloroetan + woda
* odwadnianie alkoholi w wyniku eliminacji wody
etanol --> Al2O3, T etan + H2O
* utlenianie alkoholi 10 do aldehyd贸w
etanol + Cr2O72- --> etanal + Cr3+
pomara.barwa r-r zielona
propanol + CuO-->T propanal + miedz + woda
etanol + KMnO4--> CH3COOH + MnO2
purpurowa brunatny osad
*utlenianie alkoholi 20 do keton贸w
propan-2-ol + CuO -->T(K2Cr2O7 lub CrO3) propanon + H2O + Cu
alkohole 30 nie ulegaj膮 dzia艂aniu 艂agodnych utleniaczy nie utleniaj膮 sie!!!
Odr贸znienie alkoholu nasyconego od nienasyconego - nalezy przeprowadzi膰 reakcje z bromem w 艣rodowisku CCl4( nastepuje odbarwienie)
Odr贸偶nienie alkoholu polihydroksylowego od monohydroksylowego- mo偶na odr贸偶ni膰 za pomoc膮 Cu(OH)2- tworzy sie lazurowy r-r.Reakcja ta s艂u偶yn do wykrywania alkoholi posiadaj膮cych w cz膮steczce co najmniej dwie gr -OH po艂ozone przy s膮siednich at w臋gla :
propan-1,2,3-triol + Cu(OH)2....
FENOLE-wz Ar-OH zwane s膮 arenami zawieraj膮ce gr OH zwi膮zane bezposrednio z pier艣cieniem aromatycznym. Podobnie jak w enolach atom tlenu grupy hydroksylowej przy艂onczony jest w nich do atomu wegla o hybrydyzacji sp2 jednak w przeciwie艅stwie do enoli , kt贸re s膮 zwykle nietrwa艂e fenole w wiekszo艣ci s膮 trwa艂e i nale偶膮 do nielicznych przyk艂ad贸w trwa艂ych enoli. Do fenoli nie s膮 zaliczna areny zawieraj膮ce gr - OH zwi膮zan膮 z atomem w臋gla o hybrydyzacji sp3 - te zwi膮zki nosz膮 nazw臋 alkoholi aromatycznych np. alkohol benzylowy.
S膮 popularnymi zwi膮zkami naturalnymi, chocia偶 nie wystepuj膮 w du偶ym ste偶eniu, g艂贸wnie dlatego ze s膮 bardzo toksyczne. Poczatkowo fenole wydobywano ze smo艂y pogazowej, obecnie produkuje sie je syntetycznie na skale przemys艂owa.
OTRZYMYWANIE FENOLI
*poprzez stapianie sulfonian贸w z alkaliami
C6H5-SO3Na(sulfonian Na) + NaOH--> C6H5- ONa(fenolan Na) + NaHSO3
C6H5- ONa(fenolan Na) + HCl--> NaCl + fenol
* z aromatycznych halogenopochodnych poprzez stapianie z NaOH( 360OC, Pa 300)
C6H5- Cl + NaOH-->(H2O) HCl + C6H5- ONa(fenolan Na)
C6H5- ONa(fenolan Na) + HCl--> NaCl + fenol
ULEGAJ膭
* reaguj膮 z akt. metalami ( litowce)
C6H5-OH +Na-->C6H5-ONa + 1.2 H2
* z mocnymi zasadami
C6H5-OH +NaOH --> C6H5-ONa + H2O
* substytucja elektrofilowa - bromowanie
C6H5-OH + Br2 --> 2,4,6- tribromofenol + HBr
* substytucja elektrofilowa - nitrowanie
C6H5-OH + HNO3--> 1) o-nitrofenol + H2O
2)p-nitrofrnol + H2O
*substytucja - z chlotoformem daj膮c aldehyd salicylowy
C6H5-OH + CHCl3--> NaOH C6H5-OH CHO
Potwierdzenie obecno艣ci fenolu w uk艂 reaguj膮cym- reakcja z solami zelaza(III) w kt贸rej tworzy sie fioletowy lub granatowy r-r
ALDEHYDY-nazwy pochodne w臋glowodor贸w zawieraj膮ce w cz膮steczce gr aldehydow膮 -CHO. Og贸lny wz贸r aldehyd贸w zawieraj膮cych jedn膮 gr funkcyjn膮 R-CHO / R- to gr wodoru, gr alkilowa lub arylowa .Pdzia艂;* nasycone- 3-metylobutan-1-al * nienasycone- but-2en-1-al * aromatyczne - benzenokarboaldehyd(a.benzosowy) * cyklic
zne- cykloheksanokarboaldehyd.
Aldehydy posiadaj膮 w艂a艣ciwo艣ci redukcyjne co potwierdza pozytywny wynik w probie Tollensa i Tromera.
OTRZYMYWANIE
*utlenianie aloholi 10
metanol + CuO--> metanal + Cu + H2O
* reakcja Kaczerowa- jest przyk艂adem reakcji otrzymywania konkretnego aldehydu- etanalu
etyn + H2O--> Hg2+, H+ etanal
ULEGAJA
*pr贸ba Trommera
etanal + 2CuO---> T CH3COOH(kw.octowy) + Cu2O osad
etanal + 2 Cu(OH)2-->T CH3COOH + Cu2O osad + H2O
* pr贸ba Tollensa
metanal + Ag2O --> T HCOOH(kw.mr贸wkowy) + 2 Ag
* redukcja do alkoholi 1o kat Ni, Pt
propanal + H2--> propanol
* polimeryzacja- ulegaj膮 jej tylko aldehydy g艂 metanal
nH-COH(metanal,formaldehyd )+ H2O --> H- [-O-CH2-]n-OH (poliformaldehyd)
* kondensacja adolowa
metanal + metanal --> 3-hydroksybutan-1-al
* reakcja Cannizzzaro
2 metanal + NaOH --> metanol + metanian sodu( HCOONa)
2 aldehyd benzoesowy + NaOH --> alkohol benzylowy + benzoesan sodu
Odr贸偶nienie aldehydu nasyconego od nienasyconego - nale偶y przeprowadzi膰 reakcj臋 z btomem w 艣rodowisku CCl4. Aldehyd nienasycony spowoduje odbarwienie zawarto艣ci pr贸bki.
KETONY-to zwiazki zawierajace grup臋 funkcyjn膮 (zwan膮 karbonylow膮) C=O zwi膮zan膮 z dwiema dowolnymi resztami w臋glowymi R1R2>C=O alkil i / lub aryl
OTRZYMYWANIE
* utlenianie akloholi 20
propan-2-ol + CuO--> butanon + H2O + Cu
* hydradacja alkin贸w (produkt przej艣ciowy; nietrwa艂y enol)
propy+ H2O--> (Hg2+, H+) CH3COCH3 - propanon
ULEGAJ膭
* katalityczne uwodornienie (kat. Ni, Pt)- redukcja do drugorz臋dowych akoholi
propanon + H2-->(kat) propan-2-ol
* reakcja jodoformowa- pozwala na wykrycie ugrupowania CH3-CO- w czasteczkach ketonu; czyli jest charakterystyczna dla metyloketon贸w. Keton ogrzewany z zasadowym roztworem jodu tworzy s贸l odpowiedniego kwasu i m.in. jodoform zgodnie z r贸wnaniem
propanon + I2 + NaOH--> CHI3(z贸艂ty) + CH3COONa(octan sodu) + NaI + H2O
Odr贸偶nienie aldehydu od ketonu- aldehydy posiadaj膮 w艂a艣ciwo艣ci redukcyjne co potwierdza pozytywny wynik mw pr贸bie Tollensa i Tromera- w tych warunkach ketony nie utleniaj膮 sie
KWASY KARBOKSYLOWE- to zwi膮zki w cz膮steczkach kt贸rych wystepuje jako gr funkcyjna gr karboksylowa - COOH . Grupa ta sk艂ada sie z grupy karbonylowej orza hydroksylowej. Og贸lny wz贸r R-COOH gdzie R to atom wodoru lub dowolna grupa alkilowa lub arylowa. Mo偶emy podzielic na * kw. alinfatyczne(nasycone i nienasycone) - owy * kw zawieraj膮ce pier艣cieniowe reszty w臋glowodorowe np. kw cykloheksanokarboksylowy * monokarboksylowe- zawierajace w cz膮steczce jedn膮 gr karboksylow膮 * pilikarboksylowe- zawieraj膮ce w cz膮steczce dwie lub wiecej gr karboksylowych.
Kwasy karboksylowe maj膮 zastosowanie w przemysle spo偶ywczym, farmace艂tycznym w produkcji tworzyw sztucznych, 艣rodk贸w ochrony ro艣lin, barwnik贸w oraz myde艂 i 艣rodk贸w powierzchniowo czynnych.
kwas octowy-jego wodny roztw贸r znany jako ocet stosowany jest w gospodarstwie domowym orza przemysle spo偶ywczym i farmace艂tycznym. Wykorzystywany jest r贸wnie偶 do produkcji tworzyw sztucznych- octanu celuozy
kwas t艂uszczowy ( mas艂owy, i wy偶sze kw.karboksylowe zawieraj膮ce parzyst膮 liczb臋 atom贸w w臋gla w czasteczce) s膮 sk艂adnikami naturalnych t艂uszcz贸w ro艣linnych i zwierzecych, u偶ywane s膮 do produkcji myde艂 i innych 艣rodkow powierzchniowo czynnych.
Rozpuszczalne w wodzie kwasy ulegaj膮 dysocjacji jonowej z odszczepieniem kation贸w H+
R-COOH <=> R-COO- H+ lub R-COOH + H2O <=> R-COO- + H3O + Kw. octowy CH3-COOH<=>CH3-COO- + H+ (anion octanowy)
OTRZYMYWANIE KW KARBOKSYLOWYCH
* utlenianie odpowiedniego w臋glowodoru w obecno艣ci kat.
2 metan+ 3 O2--->kat. 2 HCOOH(kw.metanowy) + 2H2O
*utlenianie aldehyd贸w
-pr贸ba Tollensa propanal + Ag2O--> C2H5COOH + 2Ag(osad)
-pr贸ba Tromera propanal + 2Cu(OH)2--> C2H5COOH + Cu2O (osad) + 2H2O
*kw. octowy otrzymuje sie r贸wnie偶艣 w reakcji
-katalitycznego utlenienia aldehydu octowego
CH3COH +O2--> kat. 2 CH3COOH
-fermentacja octowa
etanol + O2-->bakterie CH3COOH + H2O
ULEGAJ膭
*reakcja z metalami-potwierdzaj膮 charakter kw
2 CH3COOH + Mg --> (CH3COO)2Mg + H2 (octan magnezu)
*z tlenkami metali potwierdzaj膮 charakter kw
2 HCOOH + CuO--> (HCOO)2Cu + H2O (mr贸wczan miedzi)
*z wodorotlenkami metali(NaOH, KOH) potwierdzaj膮 charakter kw
C2H5COOH + NaOH-->C2H5COONa + H2O( propanian sodu)
*addycja wodoru do kwasu oleinowego
C17H33COOH(kw.oktadek-9enowy/oleinowy) + H2--> kat.nasycony kw.stearynowy
*kw.oleinowy- nazwa pochodzi od alkenu o 18 at w臋gla w kt贸rym za dziewi膮tym atomem wegla posiada wi膮zanie podw贸jne
C17H33COOH(kw.oleinowy-ciek艂y) + H2--> kat. C17H35COOH (kw.stearynowy-sta艂y)
*addycja bromu do kwasu oleinowego (potwierdza charakter nienasycony kw.-odbarwienie wody bromowej)
C17H33COOH + Br2-->kw. 9,10-dibromodekanowy
CH3COOH +Cl2-->kat. kw.chloroetanowy + HCl
POCHODNE KWAS脫W KARBOKSYLOWYCH-
estry-to pochdne kwas贸w karboksylowych w kt贸rych gr -OH zastapiono gr -OR1. S膮 trudno rozpuszcxzalne w wodzie, natomiast niekt贸re z nich s膮 bardzo dobrymi rozpuszczalnikami innych zwi膮zk贸w organicznych np. octan etylu stosowany jako zmywacz do paznokci. Maja przyjemne zapachy na ma艣lan etylu- ananasowy, octan fenylu- ja艣minowy
OTRZYMYWANIE ESTRY
*w reakcji estryfikacji
CH3COOH + CH3OH -->(H2SO4) octan etylu
*reakcja chlork贸w kwas贸w karboksylowych z alkoholami
*reakcja transestryfikacjI
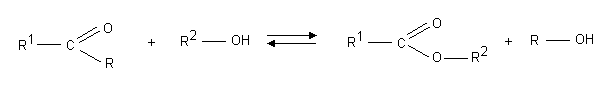
*reakcja bezwodnik贸w kwasowych i alkoholi lub fenoli:
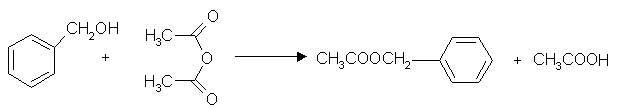
ULEGAJA
*hydroliza
mr贸wczan propylu + H2O<=>kw.mr贸wkowy + propanol
-hydroliza w 艣rodowisku kwasowym jest odwracalna
octan metylu(CH3COOCH3) + NaOH--> CH3COONa + CH3OH
SOLE KWAS脫W KARBOKSYLOWYCH-podobnie jak sole kwas贸w nieorganicznych s膮 w wodzie rozpuszczle lub nierozpuszczalne.
*sole rozpuszczalne ulegaj膮 w wodzie dysocjacji
octan potasu CH3COOK --> H2O CH3COO- + K+ anion potasowy
mr贸wczan Mg: (HCOO)2Mg -->H2O 2HCOO- + Mg2+ anion Mg
*hydroliza soli kwas贸w karboksylowych
(HCOO)2Mg + 2H2O--> 2CH3COOH + Mg(OH)2
2CH3COO- + Mg2+ + 2H2O-->2CH3COOH + Mg2+ + 2OH-
2CH3COO- + 2H2O--> 2CH3COOH + 2OH-
*reakcja dekarboksylacji
CH3COONa + NaOH--> CH4 + Na2CO3
MYD艁A-sole sodowe lub potasowe wy偶szych kwas贸w t艂uszczowych(g艂 palmitynowego i stearynowego). Myd艂a sodowe s膮 bioa艂e i twarde a myd艂a potasowe szare i maziste. U偶ywane do codziennej piel臋gnacji to myd艂a sodowe z dodatkiem substancji nat艂uszczajacych i nawil偶aj膮cych, olejk贸w zapachowych i barwnik贸w.
micele- myde艂 maj膮 zdolno艣ci emulgowania t艂uszcz贸w (np.brud wnika do wew miceli)
Myd艂o sie pieni tylko w wodzie miekkiej a w twardej wodzie tworzy sie nierozpuszcxzalny osad myde艂 wapiennych i magnezowych:
- 2C17H35COONa + CaCl2--> (C17H35COO)2 Ca(osad) + 2NaCl (stearynian wapnia)
-2C15H31COONa + MgSO4--> ((C17H35COO)2Mg + Na2SO4
* myd艂a jako sole mocnych zasda i s艂abych kw hydrolizuj膮 z odczynem zasadowym
C17H35COONa(steraynian Na) + H2O--> C17H35COOH + NaOH
C17H35COO- + Na+ + H2O--> C17H35COOH + Na+ + OH-
C17H35COO- + H2O--> C17H35COOH + OH-
Dzia艂anie myde艂- polega na obni偶eni napiecia powierzchniowego wody, dzieki czemu woda z myd艂em 艂atwo wnika w g艂膮b sk贸ry lub tkaniny i wymywa z nich cz膮steczki brudu. Substancje obnizaj膮ce napiecie powierzchniowe wody nazywane s膮 zwi膮zkami powierzchniowo czynnymi. Ich cz膮steczki sk艂adaj膮 sie z cz臋艣ci hydrofobowej(nie lubi膮cej wody) i hydrofilowej ( lubi膮c膮 wod臋). Cz臋艣ci膮 hydrofobow膮 przylegaj膮 do cz臋sci hydrofobowych cz膮steczek brudu, za艣 cz臋sci膮 hydrofilow膮 do polarnych czasteczek wody, u艂atwiaj膮c przechodzenie brudu wraz z piana na powierzchnie wody.
T艁USZCZE PROSTE- nale偶膮 do gr zwi膮zk贸w org zawanych lipidami:
*PROSTE(estry lub zw zawierajace wi膮zanie estrowe i ulegaj膮 hydrolizie)
*WOSKI
*Z艁O呕ONE ( fosfolipidy, glikolipidy, lipidy)
AMINY-pochodne w臋glowodor贸w, zawieraj膮ce grup臋 aminow膮 -NH2 ; wz og贸lny R-NH2 gdzie R- gr weglowodorowa , NH2- gr aminowa
OTRZYMYWANIE
*w reakcji amoniaku z halogenoweglowodorami
chlorometan+ NH3-->metyloamina-CH3NH2 + HCl
-metyloamina nie tylko rozpuszcza sie w wodzie ale tez z ni膮 reaguje
-CH3NH2 + H2O-->[CH3-NH3]+ + OH- (zasada metyloaminowa)
ULEGAJ膭
*etyloamina+ HCl--> [CH3-CH2-NH3]Cl Cl etyloamoniowy
WIELOFUNKCYJNE POCHODNE W臉GLOWODOR脫W- to zwiazki organiczne , w kt贸rych cz膮steczkach znajduj膮 sie co najmniej dwie gr funkcyjne po艂aczone z gr weglowodorowa. Na w艂a艣ciwo艣ci tych zwi膮zk贸w maj膮 wp艂yw wszystkie gr funkcyjne wystepujace w czasteczce
AMINOKWASY-zwi膮zki ograniczne, kt贸rych cz膮steczki zwieraj膮 gr aminowa- NH2 oraz karboksylow膮- COOH
*gliceryna-jest najprostszym aminokwasem, kt贸rego nazwa pochodzi od kwasu zawieraj膮cego dwa atomy wegla tj. kw etanowego , w kt贸rym jeden atom wodoru podstawiony zosta艂 gr aminow膮
*alanina- nazwa pochodzi od kwasu propanowego w kt贸rym gr aminowa zosta艂a podstawiona za atom wodoru przy drugim atomie w臋gla, dlatego musimy okre艣li膰 jego po艂ozenie (2-amino). Jest to r贸wnie偶 aminokwas zawieraj膮cy 3 atomy wegla(stad kwas aminopropanowy) w kt贸rym gr amonowa zosta艂a podstawiona za atom wodoru przy trzecim atomie wegla(3-amino)
Podzia艂 aminokwas贸w ze wzgl臋du na ilo艣膰 grup karboksylowych i aminowych:
*oboj臋tne (1 grupa -NH2 1 grupa -COOH)
*kwa艣ne (1 grupa -NH2 2 grupy -COOH)
*zasadowe (2 grupy -NH2 1 grupa -COOH)
*oboj臋tne z uk艂adem cyklicznym
OTRZYMYWANIE
*w reakcjach chlorowcokwas贸w z amoniakiem
kw 2-chloropropanowy + 2NH3-->kw 2-aminopropanowy(alanina) + NH4Cl
BIA艁KA-naturalne zwiazki wieloczasteczkowe . S膮 najbardziej z艂ozonymi zwiazkami w przyrodzie , w ich sk艂ad wchodzi przesz艂o 20 r贸偶nych aminokwas贸w, kt贸rych r贸偶na sekwencja w 艂a艅cuchu peptydowym powoduje ogromn膮 r贸偶norodno艣膰 bia艂ek. 艁a艅cuchy npowstaj膮 w wyniku kondensacji aminokwas贸w. Bia艂ka charakteryzuje sie poprzez podanie ich struktur
* struktura 10- podaje kolejno艣膰 wystepowania reszt aminokwasowych w 艂a艅cuchu peptydowym
*struktura 20- wskazuje jaki uk艂ad przestrzenny stabilizowany przez wi膮zanie wodorowe tworz膮 艂ancuchy polipeptydowe
*struktura 30- charakteryzuje kszta艂t przestrzenny cz膮steczki bia艂ka. Kazde bia艂ko posiada charakterystyczna strukture 30 kt贸rej zerwanie powoduje utrate w艂a艣ciwo艣ci bia艂ka
*struktura 40- dotyczy ma艂ej liczby bia艂ek kt贸re zbudowane sa conajmniej z dwoch 艂ancuch贸w peptydowych.
ULEGAJ膭
*hydrolizie
H2N-Ala-Cys-Gly-COOH + 2H2O--> Ala+Cys+Gly
*reakcja biuretowa
REAKCJA WURTZA- czyli dzia艂anie metalicznym sodem(Li, Zn, Mg) na halogenki alkilowe. Dzieki tej reakcji mo偶na otrzyma膰 alkany o dluzszych 艂ancuchach (nast臋puje podwojenie ilo艣ci at wegla ) oraz 艂ancuchach rozga艂ezionych
jodopropan + Na --> heksan + jodos贸d
2 C3H7I + 2 Na--> C6H14 + 2 NaI
SUBSTYTUCJA(podstawianie)(F, Cl, Br, I)- reakcja w kt贸rej atomy w cz膮stecze zwi膮zku organicznego zastepowane s膮 (podstawiane) atomami innych pierwiastk贸w. Jest reakcj膮 charakterystyczna dla w臋glowodor贸w nasyconych.
- propan + Cl2 --> hv chloropropan + chlorowod贸r
- chloropropan + Cl2--> hv dichloropropan + chlorowod贸r
- dichloropropan + Cl2 -->hv trichloropropan + chlorowod贸r
- trichlorowod贸r + Cl2 --> hv tetrachloropropan + chlorowod贸r
ELIMINACJA- nazywamy proces polegajacy na oderwaniu od s膮siaduj膮cych atom贸w wegla dw贸ch atom贸w lub grup atomow bez zastapienia ich innymi podstawinikami , w wyniku czego ro艣nie krotno艣膰 wiazania - lub gdy odrywamy od atom贸w , kt贸re nie sasiaduja ze soba powstaje zwiazek cykliczny. reakcja eliminacji przebiega zgodnie z regu艂膮 Zajcewa.
Regu艂a Zajcewa- atom wodoru odrywa sie od atomu wegla zwiazanego z mniejsza liczba atom贸w wodoru.
* eliminacja wody z alkoholu
propanol --->Al2O3/ T propen + woda
ADDYCJA- nazywa sie proces przy艂anczania do atom贸w wegla po艂onczonych wiazaniem podw贸jnym lub potr贸jnym cz膮steczek homo- lub hetero atomowych w wyniku czego zmniejsza sie ktotno艣膰 wiazania . Reakcja addycji zachodzi wtedy gdy dwa substraty 艂acza sie ze sob膮 tworz膮c jeden produkt.
POLIMERYZACJA- to reakcja w ktorej zwi膮zek wieloczasteczkowy ( polimer) tworzy sie z pojedynczych czasteczek zwiazku o ma艂ej masie czasteczkowej ( monomer) bez wydzielania produkt贸w ubocznych . Procesem odwrotnym to depolimeryzacja.
REAKCJE HETEROLITYCZNE-to reakcje w kt贸rych rozerwanie wi膮zania jest niesymetryczne; pow karbokation i karboanion
KARBOKATION-powstaje na drodze reakcji heterolitycznej , w kt贸rej rozerwanie wi膮zania nastepuje na drodze jonowej i jest niesymetryczne; pow dwa jony karbokation i karboanion.
KARBOANION- to jon, a dok艂adnie anion, w kt贸rym 艂adunek ujemny znajduje si臋 na jednym lub wi臋cej atomach w臋gla. Karboanion posiada nadmiarow膮 woln膮 par臋 elektronow膮 i z tego powodu posiada silne w艂asno艣ci nukleofilowe i zasadowe.
RODNIK- atom lub grupa atom贸w posiadaj膮ca niesparowany elektron . Najcz臋艣ciej powstaj膮 w wyniku reakcji oderwania atomu wodoru od cz膮steczki zwi膮zku organicznego.
Na czasteczki o wzorze og贸lnym A:B gdzie (:) przedstawia pare elektronow膮 wi膮偶膮c膮 sk艂adniki A i B to para moze ulec:
* rozerwaniu w贸wczas ka偶dy sk艂adnik zatrzyma jeden niesparowany elektron czyli utworzy wolny rodnik A : B --> A* + *B
* przesuniecie do jednego ze sk艂adnik贸w do sk艂adnika elektroujemnego , a tym samym posiadaj膮cego wieksze powinowactwo do elektron贸w
- gdy A jest bardziej elektroujemne to A staje si臋 jonem ujemnym A : B --> A:- + B+
- a gdy B jest bardziej elektroujemne to A staje sie jonem dodatnim A : B --> A+ + :B-
tu rysunki
REAKCJIE HOMOLITYCZNA- rozerwanie wi膮zania jest symetryczne i przy ka偶dym atomie w臋gla pozostaje jeden elektron. Produktem posrednim tej reakcji sa wolne rodniki st膮d nazwa reakcji wolnorodnikowa
ODCZYNNIKI
*nukleofilowe - daj膮 swoj膮 par臋 elektronow膮 na utworzenia wi膮zania z atomem w臋gla ( Cl-, OH- , CN-, karbotationy)
*elektrofilowe - niedob贸r elektron贸w ( H3O+, H+, NH4+, NO2+, SO3H+)
*wolnorodnikowe- posiadaj膮 niesparowane elektrony (Cl*)
KONDENSACJA ALDOLOWA- aldehydy posiadaj膮ce w cz膮steczkach co najmniej jeden atom wodoru ( przy atomie wegla s膮siaduj膮cym z gr funkcyjn膮) w 艣rodowisku zasadowym mog膮 艂aczy膰 sie ze sob膮 tworz膮c twz. aldol (np. metanal + metanal --> 3-hydroksybutan-1-al.)
REAKCJA CANNIZZARO- aldehydy nie posiadaj膮ce w czateczkach wodoru ( gr aldehydowa zwi膮zana z 30 atomem wegla lub bezposrednio z pierscieniem aromatycznym) ulegaj膮 w 艣rodowisku silnie zasadowym dysproporcjowaniu. Np(1) 2 metanal + NaOH --> metanol + metanian sodu( HCOONa)
2)2 aldehyd benzoesowy + NaOH --> alkohol benzylowy + benzoesan sodu)
PR脫BA TOLENSA-to pr贸ba z Ag2O - pr贸ba lustra srebnego . Reakcja mtan jest reakcj膮 utleniania- redukcji, w czsie kt贸rej aldehyd utlenia sie do kwasu karboksylowego. W wyniku tej reakcji wytraca sie metaliczne srebro , co wykorzystuje sie do produkcji ozd贸b choinkowych i luster.(metanal + Ag2O --> T HCOOH(kw.mr贸wkowy) + 2 Ag)
PR脫BA TROMERA-reakcja aldehydu z wodorotlenkiem miedzi (II) , w wyniku tej reakcji powstaje ceglasto-czerwony osad tlenku miedzi, aldehyd zredukowal sie do kwasu karboksylowego.(etanal + 2CuO---> T CH3COOH(kw.octowy) + Cu2O osad
etanal + 2 Cu(OH)2-->T CH3COOH + Cu2O osad + H2O)
WYSALANIE BIA艁KA- proces wytracenia sie osadu (zawiesina bia艂kowa) pod wp艂ywem r-r niekt贸rych soli np. NaCl/Na2SO4/(NH4)2SO4. Poniewa偶 nie ulega zniszczeniu struktura przestrzenna bia艂ka, jest to proces odwracalny po dodaniu wody osad sie rozpuszcza
koloidalny r-r bia艂ka(zol) <=>(NaCl/H2O) zawiesina bia艂kowa(偶el)
KOAGULACJA-wytr膮cenie sie osadu w r-r koloidalnym , procesem odwrotnym jest peptyzacja
zol <=>偶el
REAKCJA BIURETOWA- reakcja z wodorotlenkiem miedzi (II), w wyniku kt贸rej powstaje r贸偶owofioletowe zwi膮zek kompleksowy. Reakcja potwierdza obecno艣膰 wi膮zania peptydowego
REAKCJA KSANTOPROTEINOWA- reakcja ze st臋偶onym kwasem azotowym (V) pod wp艂ywem kt贸rego nast臋puje nitrowanie pier艣cieni aromatycznych w cz膮steczkach niekt贸rych aminokwas贸w bia艂kowych. Powstaj膮ce aromatyczne pochodne maj膮 偶贸艂t膮 barwe, powoduj膮c 偶贸艂te zabarwienie bia艂ka w tej reakcji . Reakcja ta s艂u偶y do wykrywania bia艂ek zawieraj膮cych pier艣cienie aromatyczne w 艂a艅cuchach bocznych
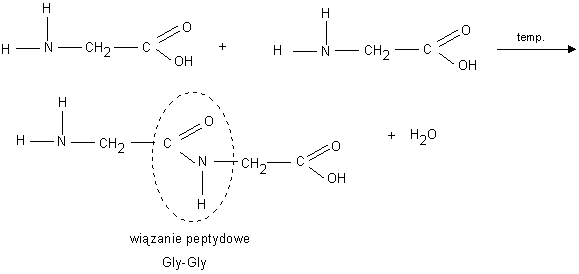
REAKCJA KONDENSACJI-- zachodzi pomi臋dzy grup膮 aminow膮 i karboksylow膮 dw贸ch aminokwas贸w: H2N-CH2-COOH +H2N-CH2-COOH-->
REAKCJA DEKARBOKSYLACJI-w wyniku stapiania soli kwas贸w karboksylowych ze sta艂ym wodorotlenkiem sodu w temp 300oC powstaje odpowiedni alkan i w臋glan sodu. Szczeg贸lnie 艂atwo tej reakcji ulegaj膮 octany:
REAKCJA TRANSESTRYFIKACJI-reakcja ta polega na wymianie jednego estru z drugim; og贸lny mechanizm tej reakcji przedstawia si臋 nast臋puj膮co:
CH3COONa + NaOH--> CH4 + Na2CO3
Wyszukiwarka
Podobne podstrony:
chemia organiczna 艣ci膮ga, Chemia organiczna
sciaga chemia organiczna 1 semestr
CHEMIA sciaga chemia organiczna 1 semestr
Chemia 2 Organiczna 艣ci膮ga
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wyk艂ady
sciaga bialaka, Szko艂a Rolnictwo studia, Szko艂a, Materia艂y studia, materialy - biotechnologia, Chemi
艣ci膮ga chem, chemia, chemia organiczna
Chemia organiczna czesc I poprawiona
chemia organiczna wyk艂ad 6
Wyk艂ad 9 CHEMIA ORGANICZNA
Chemia Organiczna 4
Chemia organiczna IV
sciagaCHEMIA2, Chemia, sciaga chemia