1. Substancje A i B tworzą roztwory doskonałe. W 30oC prężności par nasyconych tych związków wynoszą odpowiednio 293.1 kPa i 50 kPa. Roztwór o składzie molowym xA = 0.46 i temperaturze 30oC zamknięto w cylindrze z ruchomym tłokiem obciążonym ciśnieniem p. Obliczyć, jaki będzie stosunek liczby moli fazy ciekłej do gazowej, gdy ciśnienie będzie wynosiło 0.9 ciśnienia, w którym układ ten zaczyna wrzeć. (wynik podaj z dokładnością do 0.01)
Odpowiedź: 5
p wrzenia=xA*pA0 + (1-xA)*pB0
p=0,9 * p wrzenia
p=xA'*pA0+(1-xA')*pB0 => xA' = p-pB0/pA0-pB0
y=(xA'*pA0)/p
n cieczy/n pary = (y-xA)/(xA-xA')
2. Molowa pojemność cieplna pary wodnej pod stałym ciśnieniem określa równanie: Cp=28.83+13,74*10do-3T -1.435*10do-6T2 J/molK. Ile ciepła wydzieli się podczas ochładzania 155g pary wodnej od temp 390°C do100°C pod ciśnieniem 1 atm. M h2o to 18g/mol. Podać wynik w kJ
Odpowiedź: -89.56
Cp=28,83+13.74*10^-3T-1.435*10^-6T^2
n=m/M=155/18=8,61
T1=390°C=663 K
T2=100°C=373
deltaH= n* całka od T1 do T2 z (28,83+13.74*10^-3T-1.435*10^-6T^2)
deltaH=8,61 [28,83*(373-663)+13.74*10^-3*(373^2-663^2)/2-1.435*10^-6*(373^3-663^3)/3]
3. Reakcja 2A+B=3C+D przebiega w fazie gazowej. Gdy zmieszano 1 mol A, 2 mole B i 1 mol D, po ustaleniu się równowagi w temp. 301 k i pod ciśnieniem 2 atm, mieszanina zawierała 0.9 mola C. Oblicz ułamek molowy B w stanie równowagi.
Odpowiedź: 0.4
Wzór:
2A + B = 3C + D
n pocz 1 2 (-) 1
n reaguje -2x -x 3x x
n rowno. 1-2x 2-x 3x 1-x
ul molowe (1-2x)/(4+x) (2-x)/(4+x) 3x/(4+x) (1-x)/(4+x)
n całkowite=(1-2x)+(2-x)+3x+(1-x)= 4+x
podają nam liczność C= 3x=0.9
x=0.3
Xb=(2-x)/(4+x) Przeważnie wchodzi wynik 0.4 :P
4. Opierając się na danych z poniższej tabeli, obliczyć wartość lnKp reakcji 2A(g) + B(g) = 2C(g) w temperaturze 374 K, zakładając niezależność i od temperatury.
Odpowiedź: 6.1
...........So..........delta [H]tw
A(g)... 188 ......... 62.08
B(g) ...205.6........ 0
C(g)... 240.5........33.85
Wzór:
delta S=2C-2*A-B
delta H=2*C-2*A
A= -deltaH + TdeltaS
A=RTlnKp
lnKp=A/(R*T)
Tylko trzeba uważać na jednostki, bo przeważnie S podawane jest w [J/molK] a deltaH w [kJ/mol]!!
5. Związek A ulega rozkładowi termicznemu na B i C w reakcji równoległej o schemacie podanym poniżej. Obie reakcje składowe są nieodwracalnymi reakcjami pierwszego rzędu o stałych szybkości k1 = 0.057 s-1 i k2 = 0.027 s-1. Jakie będzie stężenie B po 12 s jeśli stężenie początkowe A wynosiło 2 mol•dm-3? Wynik podaj w mol•dm-3.
Odpowiedź: 1.8
Schemat reakcji: 2A => 3B oraz 2A => C ![]()
6. W reakcji równoległej A rozpada się na 3B (stała szybkości k1 = 0.0383 s-1) i 4C (stała szybkości k2 = 0.046 s-1) w reakcjach pierwszego rzędu. W reaktorze umieszczono czysty substrat A. Po 1462 sekundach stężenie produktu B było równe 0.82 mol•dm-3. Oblicz stężenie produktu C po tym samym czasie. Wynik podaj w mol•dm-3
Odpowiedź:1.3
A=>3B oraz A=>4C
W równaniach 1) dzielimy przez 3; 2) mnożymy przez 4
![]()
=>
1) ![]()
2) ![]()
7. W r-cji 1-szego rzedu Th-->Pa+beta, okres połowicznego rozpadu izotopu Th wynosi 578,4h. Ile było atomów Th na początku jeśli po 100h powstało 202 atomów Pa?
Odpowiedź: 1788.6
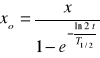
8. Synteza jodowodoru w fazie gazowej: H2 + I2 => 2HI jest reakcją rzędu drugiego (pierwszego rzędu w stosunku do każdego z substratów). Ile razy zmieni się szybkość reakcji (v) w stosunku do jej szybkości początkowej (v0) po przereagowaniu połowy jodu, jeżeli wyjściowa mieszanina zawierała jod oraz wodór w proporcji 1:1.5206? Wynik podać z dokładnością do czterech cyfr dziesiętnych.
Odpowiedź: 0.3
![]()
9. Substancja A reaguje dając w dwóch reakcjach równoległych drugiego rzędu o stałych szybkości k1 i k2 dwa produkty B i C. W mieszaninie produktów produkt C stanowi 63.4 %. Obliczyć stosunek stałych szybkości (k1/k2)
Odpowiedź: 0.6
![]()
10. Uwzględniając współczynniki aktywności oblicz wartość pH 0.1 molarnego wodnego roztworu amoniaku w temperaturze 298 K wiedząc, że pKb amoniaku wynosi 4,749 a iloczyn jonowy wody w tej temperaturze wynosi 1,008·10-14
Odpowiedź: 12
I ![]()
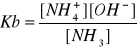
=> 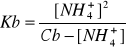
1) pKb=4.749 =>Kb=1.78E-5; Cb=0.1
![]()
+ Kb![]()
- KbCb=0
=> liczymy równanie i wybieramy x (zwykle +![]()
)
2) ![]()
= ![]()
=> pH=-log
II 1)pKw = -logKw
2) pH = pKw - 1/2pKb + 1/2logc
11. W wyniku przebiegu, w stałej temperaturze, reakcji A => ..., stężenie substratu, równe w stanie początkowym 0,1 [mol*dm^-3], zmniejszyło się do połowy po upływie czasu równego 270.87 [s]. Po jakim czasie przereaguje 83% początkowej ilości A, jeżeli reakcja jest rzędu pierwszego? Odpowiedź podać w [s] z dokładnością do dwóch cyfr dziesiętnych.
Odpowiedź: 692.5
![]()
12. Czas połówkowy pewnej reakcji opisanej równaniem 2A => B przy stężeniu początkowym substratu A równym 0,02 wynosi 0.6302 s. Wyznaczyć stałą szybkości reakcji przyjmując, że reakcja jest rzędu drugiego. Stałą
szybkości podać w [1/(M*s)] z dokładnością do czterech cyfr dziesiętnych
![]()
13. Pewna reakcja przebiega w roztworze jako przeciwbieżna reakcja pierwszego rzędu. Stała szybkości tworzenia produktów k1= 0.000131 s-1. Jeżeli przed rozpoczęciem reakcji znajdował się jedynie substrat A, równowaga ustaliła się na poziomie 81.1 % jego początkowej ilości. Po jakim czasie licząc od momentu rozpoczęcia reakcji powstało 12.2 % B?
Wynik podać w sekundach.
Odpowiedź: 1496
k2/k1 = x/a - x czyli
k2/0.000131=0.189/0.811 z tego liczysz k2
t= -ln/k1 + k2 ( 1 - x(k1 + k2)/k1a)
czyli -ln/k1 + k2 (1 - 0.122 ( k1+k2)/k1)
14. Reakcja 2HI => H2 + I2 jest przeciwbieżną reakcją drugiego rzędu. Dla reakcje tej znaleziono następujące wartości stałej szybkości reakcji rozpadu HI w dwóch temperaturach:
T1=587 K, k1,1=3E-06 mol-1•dm3•s-1, T2=619 K, k1,2=6E-05 mol-1•dm3•s-1.
Obliczyć doświadczalną energię aktywacji. Wynik podać w J/mol.
1) ![]()
![]()
2) 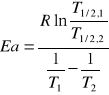
15. Dla reakcji przeciwbieżnej danej równaniem A=2B stałe szybkości tworzenia i rozpadu B wynoszą odpowiednio: k1=0.001 s-1 i k2=0.03 dm3•mol-1•s-1. Obliczyć stężenie równowagowe B jeżeli stężenie wyjściowe A wynosiło 0.96 mol•dm-3. Wynik podaj w mol•dm-3. Odpowiedź podać z dokładnością do trzech cyfr dziesiętnych.
Odpowiedź: 0.085
dcA/dt = k1cA - k2(cB^2)
dx/dt = k1(a-x) - k2(2x)^2
k1(a-x) =k2(2x)^2
4x^2k2 + k1x - k1a=0 => +![]()
25
Zaprojektuj ogniwo bez przenoszenia, w którym będzie przebiegała reakcja
2AgCl = 2Ag + Cl2
Oblicz standardowe SEM tego ogniwa w 298K wiedząc, że standardowe powinowactwo tworzenia AgCl wynosi 108,7 kJ•mol-1.
Odpowiedź: -1.264![]()
2
Wyszukiwarka
Podobne podstrony:
04Grupyid 5398 ppt
akomodacja syntaktyczna id 5398 Nieznany (2)
5398
5398
5398
5398
5398
więcej podobnych podstron