II. ROZTWORY i STĘŻENIA
Roztwór a mieszanina. Rozpuszczalnik, substancja rozpuszczona, masa i gęstość roztworu
Zmieszanie dwóch lub więcej składników daje mieszaninę. Wyróżniamy mieszaniny homo- i heterogeniczne.
Przykłady mieszanin heterogenicznych - skały, mleko. Tutaj składniki można zidentyfikować gołym okiem lub za pomocą mikroskopu.
Przykłady mieszanin homogenicznych - syrop (mieszanina cukru i wody), sól kamienna rozpuszczona w wodzie. Tutaj w żaden sposób nie można odróżnić składników mieszaniny. Mieszaniny homogeniczne noszą nazwę roztworów.
Składnik roztworu występujący w większej ilości (b. często woda) to rozpuszczalnik. Pozostałe składniki roztworu to substancje rozpuszczone. Najczęściej mamy dom czynienia z roztworami wodnymi.
Masa i objętość i gęstość roztworu
m - masa roztworu w kg (g, Mg)
V - objętość roztworu w dm3 (cm3, m3)
d - gęstość roztworu w g/cm3 (kg/dm3, Mg/m3)
Do obliczeń i przeliczeń stężeń potrzebne są następujące definicje:
a) gęstość roztworu: 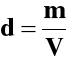
Jednostki: 1g/cm3 ≡ 1mg/dm3
b) liczność i-tego składnika roztworu w molach: 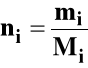
mi = masa i-tego składnika (g)
Mi = masa molowa i-tego składnika (g/mol)
Uwaga
Indeks i oznacza i-ty składnik roztworu
Wielkość bez indeksu odnosi się do całego roztworu
3. Jednostki stężeń
3.1. Ułamek wagowy (masowy). Procent wagowy (wagowy)
Ułamkiem wagowym (masowym) (wi) i-tego składnika nazywamy stosunek masy (mi) tego składnika do masy całego roztworu (m) :
pi(wag) = wi ⋅ 100%
Procent wagowy (masowy) jest równy liczbie gramów danego składnika
w 100g roztworu
UWAGA : wagowy = masowy
3.2. Stężenie molowe
Stężenie molowe (ci) i-tego składnika w danym roztworze jest to
stosunek liczności (ni) tego składnika do objętości (V) całego roztworu:
1M ≡ 1kmol/m3 ≡ 1mol/dm3 ≡ 1 mmol/cm3 ≡ roztwór 1-molowy ≡ roztwór w którym stężenie danej substancji wynosi 1 mol/dm3
3.3. Ułamek molowy. Procent molowy
Ułamek molowy (xi) jest to stosunek liczności (ni) danego składnika do sumy liczności wszystkich składników roztworu :
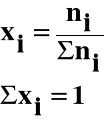
procent molowy : pi(mol) = xi ⋅ 100%
3.4. Procent objętościowy (dla gazów)
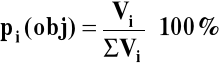
dla gazów idealnych: V = ΣVi
pi(obj) = pi(mol)
3.5. pJ (pH)
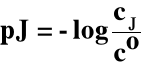
cJ → stężenie molowe jonu J
co → stężenie standardowe = 1 mol/dm3
Dla jonów H+ i OH- :
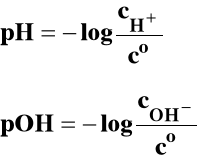
3.6. ppm* i ppb**
ppm i ppb odnoszą się tak do masy jak i objętości. W przypadku masy:
1 ppm = 1 część na milion czyli 1 mg substancji w 1 kg roztworu (mieszaniny)
1 ppb = 1 część na miliard czyli 1 μg substancji w 1 kg roztworu (mieszaniny)
1 ppm = 1000 ppb
*ppm ≡ parts per million
**ppb ≡ parts per billion
billion w j. ang. oznacza w j. pol. miliard |
Zadania ze stężeń
Zadanie 1 - Stężenie molowe
1,50 g stopu zawierającego 60,0 % aluminium roztworzono w nadmiarze wodorotlenku sodu otrzymując 250 cm3 roztworu. Oblicz stężenie molowe glinianu sodu w tym roztworze.
Rozwiązanie:
Aluminium jako metal amfoteryczny roztwarza się w roztworach wodnych mocnych wodorotlenków:
Al + OH- + 3H2O = Al(OH)4- + 3/2 H2
Z tej reakcji wynika, że:
1 Al → 1 Al (OH)4-
1 mol Al → 1 mol glinianu
nAl = nAl(OH)4
Masa aluminium w stopie:
mAl = 1,50 g · 60,0 g / 100 % = 0,9000 g
Liczność aluminium:
nAl = 0,9000 g / 26,98 g/mol = 0,03336 mola
Jest to także liczność glinianu!
Stężenie molowe glinianu:
c = 0,03336 mol / 0,250 dm3 = 0,1334 mol/dm3 =
= 0,133 M
Zadanie 2 - rozcieńczanie roztworu stężonego
Do 200 cm3 22,4% -go roztworu HNO3 o gęstości
1,135 g/cm3 dodano 1,00 dm3 wody, otrzymując roztwór
o gęstości 1,025 g/cm3. Jakie jest pH?
Rozwiązanie
1) Obliczamy liczność początkową HNO3 :
A
2) Obliczamy objętość końcową roztworu :
B
3) Obliczamy stężenie końcowe HNO3 :
C
4) Obliczamy pH :
pH = -log[H+] = -log 0,6740 ⋅ 0,1713 = 0,171
Zadanie 3 - mieszanie roztworów
Zmieszano 100 cm3 2,00M roztworu H2SO4 o gęstości 1,18 g/cm3 z 200 cm3 kwasu siarkowego o xH2SO4 = 0,025 i gęstości 1,12 g/cm3.
Oblicz stężenie molowe jonów wodorowych w roztworze po zmieszaniu
(d = 1,15 g/cm3).
Rozwiązanie
1) Obliczamy liczność H2SO4 w pierwszym roztworze :
n = c ⋅ V = 0,100 ⋅ 2,00 = 0,200 mola
2) Obliczamy masę drugiego roztworu :
m = 200 ⋅ 1,129 = 225,8 g
3) Obliczamy masę H2SO4 w drugim roztworze:
D
0,01020x = 2,549⋅10-4x + 0,3133 - 1,387⋅10-3x
0,01133x = 0,3133
x = 27,65 g
4) Obliczamy liczność H2SO4 w drugim roztworze:
E
5) Liczność sumaryczna H2SO4:
n = 0,2000 + 0,2819 = 0,4819mola
6) Obliczamy objętość roztworu końcowego:
F
7) Stężenie końcowe H2SO4:
G
8) Stężenie końcowe H+:
Zakładamy, że kwas siarkowy ulega całkowitej dysocjacji dwustopniowej:
c = 2 × 1,620 ⋅ 3,240 = 3,24 mol/dm3
Koniec rozdz. II-go
Władysław Walkowiak - Chemia Ogólna WPC 1002w
9
.
Roztwory i stężenia
Wyszukiwarka
Podobne podstrony:
WYKŁAD 3. Reakcje chemiczne, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
eksperymenty, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
Nazewnictwo jonów, Inżynieria środowiska, inż, Semestr I, Chemia ogólna
instrukcja - ROZTWORY BUFOROWE, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chem.fiz.stała dysocjacji, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
Program L1chog30d, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
stała dyso sprawko, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
Podział kationów Lipiec Szmal, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
Kationy 4 i 5 tabelki, Inżynieria środowiska, inż, Semestr II, Chemia ogólna
instrukcja - TYPY REAKCJI CHEMICZNYCH, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
hydroliza - teoria, Inżynieria środowiska, inż, Semestr II, Chemia ogólna
Wzór sprawozdania chemfiz lab, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratoriu
chem.fiz.współ.podziału Nernsta, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laborator
Kientyka sprawko, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna
więcej podobnych podstron