Paweł Jagiełło
wydział chemiczny
kierunek chemia
semestr IV
Laboratorium z chemii fizycznej
Ćwiczenie Nr 29
Temat:
„Badanie kinetyki przegrupowania wewnątrzcząsteczkowego metodą fotolizy błyskowej”
Data wykonania ćwiczenia:
|
Ocena: |
Podpis: |
Data oddania sprawozdania:
|
Ocena: |
Podpis: |
I. Wstęp :
Fotoliza błyskowa jest jedną z metod, które pozwalają badać kinetykę
i mechanizm szybkich reakcji chemicznych. Metoda ta polega na dostarczeniu do układu reakcyjnego energii promienistej w postaci krótkotrwałego błysku światła widzialnego lub ultrafioletowego. Impuls świetlny trwa w zależności od konstrukcji lampy i energii emitowanej, od 10-9s do 10-2s. W rezultacie pochłonięcia przez badany układ pewnej liczby kwantów światła zachodzić
w nim mogą różnorodne procesy fizyczne i chemiczne, takie jak: wzbudzenie, jonizacja, dysocjacja cząsteczek, przegrupowanie wewnątrzcząsteczkowe itp.
W ćwiczeniu wykorzystano własności roztworu 1,3,3-trzymetyloindolino-6-nitrobenzospiranu (TMINBS). Związek ten występuje w roztworze w postaci bezbarwnej, trwałej formy A (tzw. leukoformy), która pod wpływem światła przechodzi w niebieską formę B.
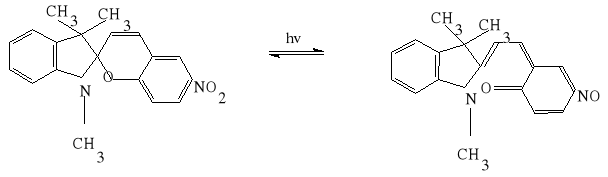
Odmiana A - trwała Odmiana B - nietrwała
leukoforma (bezbarwna) forma niebieska
Forma B jest nietrwała i ulega przemianie w odmianę A, przy czym proces ten jest I rzędu:
niebieska bezbarwna
Ponieważ jednocześnie zachodzi zmiana barwy, postęp reakcji można śledzić mierzą absorbancję roztworu. Zgodnie ze wzorem Lamberta - Beera:
![]()
A - absorbancja molowa
l - grubość warstwy absorbującej kuwety
c - stężenie substancji barwnej
Stałą szybkości reakcji nazywamy współczynnik proporcjonalności k w jej równaniu kinetycznym. W klasycznej kinetyce przyjmuje się, że stała k jest niezależna od stężenia reagentów i czasu reakcji, natomiast zmienia się z temperaturą i zależy od rodzaju i stężenia katalizatorów. Stała szybkości wyraża liczbowo szybkość reakcji, gdy stężenie każdego z substratów wynosi 1 mol/dm3. Wymiar stałej zależy od postaci równania kinetycznego i wyraża się ogólnym wzorem:
II. Obliczenia
• Szacuję wartość stałej szybkości reakcji I rzędu
k=ln2/t(1/2)= ln2/t'(1/2)= ln2/t''(1/2)
• Przybliżone wartości k wynoszą ( rozbieżności będą wynikać z niedokładności pomiaru)
k(1/2)=ln2/13s=0,0533 s-1
k(1/2')=ln2/18s=0,0385 s-1
k(1/2'')=ln2/23s=0,0301 s-1
Co daje średnią k=0,0406 s-1
• Dokładniejszy wynik daje sporządzenie wykresu ln S od czasu i obliczenie współczynnika kierunkowego ( b) krzywej.
![]()
równanie kinetyczne :
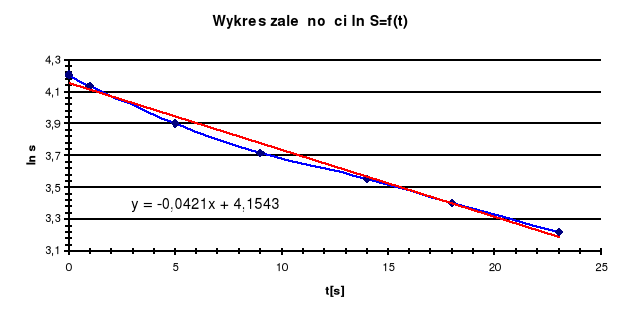
Odczytany z wykresu współczynnik kierunkowy ma wartość -0,0421 mol. Oznacza to, że wartość stałej szybkości reakcji wynosi 0,0421s-1.
III. Wnioski
Rozbieżność wartości kolejnych czasów połowicznych świadczy o niedokładności wykonanego pomiaru . Wszelkie błędy jakie zostały popełnione zostały zapewne spowodowane docieraniem do detektora światła zewnętrznego (o różnym chwilowym natężeniu) i światłem rozproszonym przez aparaturę.
W obliczeniach i przy sporządzaniu wykresu pominęłam końcową fazę doświadczenia ze względu na malejącą różnicę wychyleń pisaka (absorbancji) od czasu.
![]()
Wyszukiwarka
Podobne podstrony:
sprawko 29 nata, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
sprawozdanie 44, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
cwiczenie 26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
Sprawozdanie i konspekt 59 Dominika, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
natalia sprawko 44, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
cwiczenie 44 (1), Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
sprawko 26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
cw26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Ćwiczenie 10 - katalityczny rozpad wody utlenionej, Biotechnologia PWR, Semestr 3, Chemia fizyczna -
Ćwiczenie 2 - liczby przenoszenia i ruchliwosc jonow, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Ćwiczenie 6 - diagram fazowy, Biotechnologia PWR, Semestr 3, Chemia fizyczna - Laboratorium, Chemia
szybkosc rozpadu jonuw jakis tam ^^, Biotechnologia PWR, Semestr 3, Chemia fizyczna - Laboratorium,
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
spr57, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
więcej podobnych podstron