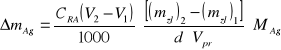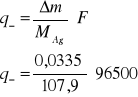Wykonanie ćwiczenia:
1. Oczyszczam elektrodę kulometru miedziowego i ją ważę.
2. Napełniam aparat Hittorfa roztworem AgNO3.
3.Włączam prostownik i przez 2 godziny przepuszczam prąd o natężeniu
ok. 3,8 mA.
4. W tym czasie miareczkuje próbkę roztworu AgNO3 rodankiem amonu.
5. Po zakończeniu elektrolizy zlewam roztwór z przestrzeni katodowej do suchej i zważonej zlewki i ponownie ją ważę.
6. Z roztworu katodowego pobieram próbkę i miareczkuje rodankiem amonu.
7. Osuszam elektrodę z kulometru miedziowego i ważę ją.
OPRACOWANIE WYNIKÓW |
||
Dane |
Obliczenia |
Wyniki |
Całkowity ładunek, który przepłynął podczas elektrolizy |
||
MCu = 63,5g (mCu 1) = 42,8432 g (mCu 2) = 42,9332 g F = 96500C |
|
|
Ubytek masy srebra w przestrzeni przykatodowej |
||
V1= 8 cm3
|
|
|
Ładunek przeniesiony przez aniony |
||
MAg = 107,9g
|
|
|
Liczby przenoszenia obu jonów |
||
|
t+= 1 - t- = 1 - 0,1095 = 0,8905 |
t+= 0,8905
|
Porównanie liczb przenoszenia z granicznymi liczbami (obu jonów) |
||
|
Q =q-+ q+ → Q - q-=q+ q+ = 273,5433 C - 29,9606
q- < q+
|
q+ = 243,5827 C
t+= 0,8905
|
Wnioski:
Mierzone przewodnictwo roztworu AgNO3 wzrasta po dodaniu 8-9 cm3 rodanku amonu. Należy uwzględnić że na wzrost ma też wpływ zabrudzenie przyrządów i ich częste wykorzystywanie, co prowadzi do tego, że wzrost przewodnictwa roztworu nie jest gwałtowny.
Przy sumowaniu wyniku reakcji uwzględnia się wszystkie produkty elektrolizy powstające na danej elektrodzie. Tylko w nielicznych przypadkach stwierdza się powstanie wyłącznie jednego produktu, np.: w procesie elektrolizy roztworu AgNO3 pomiędzy elektrodami srebrowymi. W tym ćwiczeniu zostały jednak użyte elektrody miedziowe, czyli jest to przypadek kiedy na elektrodzie powstaje dwa lub więcej produktów.
Wyszukiwarka
Podobne podstrony:
sprawozdanie 44, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
cwiczenie 44 (1), Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
sprawko 26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
sprawko 29 nata, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
cwiczenie 26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
Sprawozdanie i konspekt 59 Dominika, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
29, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
cw26, Politechnika Łódzka Biotechnologia, Chemia fizyczna LABORKI
Sprawko 31, studia, bio, 2rok, chemia fizyczna, laborki, 3-
Popr sprawko41CF, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz
sprawko 29a, studia, bio, 2rok, chemia fizyczna, laborki, 2-
sprawko 7-lipazy, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, BIOTECHNOLOGIA
sprawko- biosynteza proteinaz bakteryjnych w fermentatorach, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, BIO
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
Moje 50 , Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
monia 11, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II spr
KOND41vmac, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II s
więcej podobnych podstron