Rozwiązania zadań - temat 13
ROZTWORY BUFOROWE
2*/162
Vr = 2,00 dm3 0,15 M CH3COOH + 0,15 mol Ca(CH3COO)2. Objętość roztworu nie ulega zmianie.
pcH = ?
Oznaczenia: HA - kwas octowy (kwas, indeks k), CaA2 octan wapnia (sól, indeks s)
ck = 0,15 mol/dm3
cs = ns/Vr = 0,15/2,00 = 0,0750 mol/dm3 (trzy cyfry znaczące)
Roztwór buforowy
HA ↔ H+ + A-
CaA2 → Ca2+ + 2A-
I = 1A, pKa = 4,55, Ka = 2,82·10-5
![]()
Bilans stężeń w stanie równowagi:
[H+] = [A-]k
[A-] = 2cs + [H+]
[HA] = ck - [H+]
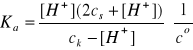
Założenia:
2cs >> [H+]
ck >> [H+]
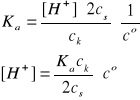
[H+] = 2,82·10-5(0,15/2·0,0750) = 2,82·10-5 mol/dm3
Założenia są spełnione, pcH = 4,55
5*/162
NH4OH↔NH4+ + OH-
NH4Cl→NH4+ + Cl-
I = 1A, pKb = 4,33, Kb = 4,68·10-5
cos = cob = 0,10 mol/dm3, pcOH = 5,00, [OH-] = 1,00∙10-5
Po zmieszaniu wyjściowych roztworów:NH4OH (zasada, indeks - b) o objętości Vb i NH4Cl (sól, indeks - s) o objętości Vs, stężenia obydwu składników roztworu buforowego w wyniku wzajemnego rozcieńczenia będą odpowiednio mniejsze. Zakładając addytywność objętości otrzymujemy
cb = Vbcob/(Vb + Vs)
cs = Vs cos/(Vb + Vs)
[NH4+] = cs + [OH-]
[NH4OH] = cb - [OH-]
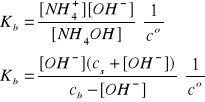
Zakładając, że cs i cb >> [OH-] mamy:
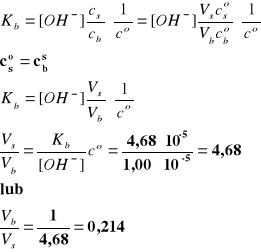
Po zmieszaniu obydwu wyjściowych roztworów w podanym stosunku objętościowym uzyskujemy stężenia cb = 0,0176 mol/dm3 i cs = 0,0824 mol/dm3, które zgodnie
z założeniami są znacznie większe (ponad trzy rzędy) od zadanego stężenia jonów [OH-].
13*/163
R1: ![]()
Vk = 2,0 dm3 HCOOH, p[%]k = 1,00%, d = 1,22 g/cm3, Mk = 46,03 g/mol
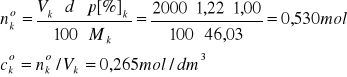
R2: Vs = 8,0 dm3 NaHCOO, cos = 0,15 mol/dm3
Po zmieszaniu otrzymujemy roztwór buforowy. Zakładając addytywność objętości
i uwzględniając wzajemne rozcieńczenie mamy:
Vr = Vk + Vs = 2,0 + 8,0 = 10,0 dm3
ck = Vkcok/Vr = 2,0∙0,265/10,0 = 0,0530 mol/dm3
cs = Vscos/Vr = 8,0∙0,15/10,0 = 0,120 mol/dm3
Oznaczając kwas mrówkowy jako HA i mrówczan sodu jako NaA mamy:
HA↔H+ + A-
NaA ↔Na+ + A-
I = 3A, pKa = 3,90, Ka = 1,26∙10-4
![]()
Bilans stężeń w stanie równowagi:
[H+] = [A-]k
[A-] = cs + [H+]
[HA] = ck - [H+]
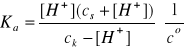
Założenia:
cs >> [H+]; ck >> [H+]
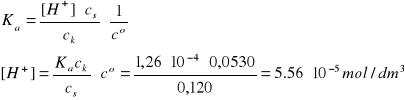
Założenia są spełnione, pcH = 4,25
20/163
V1 = 100 cm3, coHCl = 0,0700 mol/dm3 + V2 = 400 cm3, coNH4OH = 0,0350 mol/dm3
Po zmieszaniu zachodzi reakcja zobojętniania NH4OH kwasem solnym:
NH4OH + HCl = NH4Cl + H2O (1)
noNH4OH = V2coNH4OH = 0,400∙0,0350 = 0,0140 mol
noHCl = V1coHCl = 0,100∙0,0700 = 0,00700 mol
Ponieważ noNH4OH > noHCl, to kwas solny przereaguje całkowicie, a w roztworze pozostanie nadmiar (nNH4OH) nie przereagowanego NH4OH. Zatem:
n*HCl = noHCl,
a ze stechiometrii reakcji (1) mamy:
n*NH4OH = n*HCl = noHCl = 0,00700 mol
nNH4OH = noNH4OH - noHCl = 0,0140 - 0,00700 = 0,00700 mol
nNH4Cl = noHCl = 0,00700 mol
Uzyskany roztwór jest roztworem buforowym o objętości V3. Zakładając addytywność objętości mamy
V3 = V1 + V2 = 0,100 + 0,400 = 0,500 dm3,
i obliczamy stężenia NH4OH (zasada, indeks b) i NH4Cl (sól, indeks s):
cb = nb/V3 oraz cs = ns/V3
Ponieważ nb = ns, to
cb = cs = 0,00700/0,500 = 0,0140 mol/dm3.
NH4OH↔NH4+ + OH- (2)
NH4Cl→ NH4+ + Cl- (3)
I = 1A, pKb = 4,33, Kb = 4,68·10-5, pKw = 13,80
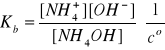
Po uwzględnieniu bilansu stężeń:
[NH4+] = cs + [OH-]
[NH4OH] = cb - [OH-]
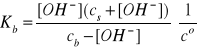
Zakładając, że cs i cb >> [OH-] mamy:
![]()
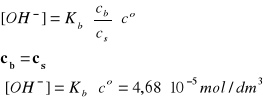
Założenia są spełnione, zatem pcOH = 4,33.
pcH = pKw - pcOH = 13,80 - 4,33 = 9,47
HYDROLIZA SOLI POCHODZ|ĄCYCH OD SŁABYCH ELEKTROLITÓW
1*/176
CH3COONa (sól, indeks s), cs = 1,0 mol/m3 = 1,0·10-3 kmol/m3 = 1,0·10-3 mol/dm3
CH3COONa→Na+ + CH3COO-
CH3COO- + H2O↔CH3COOH + OH-
Stopień hydrolizy β = ?
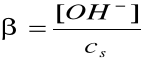
I = 1A, pKa = 4,55, pKw = 13,80
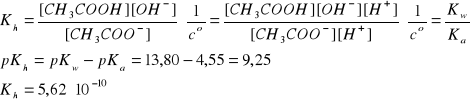
Bilans stężeń w stanie równowagi:
[CH3COOH] = [OH-]
[CH3COO-] = cs - [OH-]
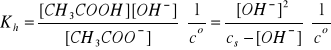
Założenie: cs >> [OH-]

![]()
Założenie jest spełnione, zatem
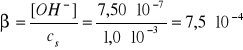
(dwie cyfry znaczące)
2/176
(NH4)2SO4 (sól, indeks s), cs = 0,0050 mol/dm3, pcH = ?
(NH4)2SO4→2NH4+ + SO42-
NH4+ + H2O↔NH4OH + H+
I = 1A, pKb =4,33, pKw = 13,80
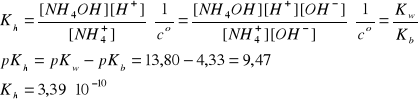
Bilans stężeń w stanie równowagi:
[NH4OH] = [H+]
[NH4+] =2cs - [H+]
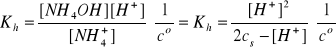
Założenie: 2![]()
cs >>[H+]
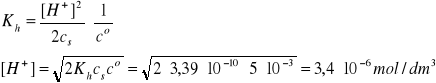
Założenie jest spełnione, zatem pcH = 5,47.
UWAGA:
Stopień hydrolizy (β) soli typu NH4Cl definiujemy jako:
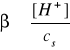
,
natomiast stopień hydrolizy dla takiej soli, jak (NH4)2SO4 zdefiniowany jest wzorem
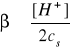
!!!.
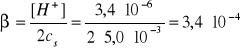
(Treść zadania nie wymagała tego obliczenia)
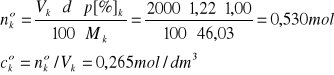
Wyszukiwarka
Podobne podstrony:
temat 14
temat 14, chemia wody-w-
14. powrt do ziemi obiecanej karta pracy, Klasa I Gimnazjum, Temat 14
temat 14, Ekonomia
temat 14, ZiIP, inne kierunki, politechnika, sem III, ang
Harmonogram zadań praktyka 14 dzienne
Rozwiązanie zadania z fizyki 5 14 Mroszczyk Salach dla szkół ponadgimnazjalnych cz2 ZamKor 2007
Rozwiązanie zadania z fizyki 1 14 Bogdan Mendel Janusz Mendel Fizyka i Astronomia I Liceum Nowa Era
Rozwiązanie zadania z fizyki 6 14 Bogdan Mendel Janusz Mendel Fizyka i Astronomia I Liceum Nowa Era
Rozwiązanie zadania z fizyki 4 14 Mroszczyk Salach dla szkół ponadgimnazjalnych cz1 ZamKor 2008
Rozwiązanie zadania z fizyki 2 14 Mroszczyk Salach dla szkół ponadgimnazjalnych cz2 ZamKor 2007
Rozwiązanie zadania z fizyki 7 14 Bogdan Mendel Janusz Mendel Fizyka i Astronomia I Liceum Nowa Era
Rozwiązanie zadania z fizyki 2 14 Mroszczyk Salach dla szkół ponadgimnazjalnych cz1 ZamKor 2008
TEMAT 14
Rozwiązanie zadania z fizyki 3 14 Mroszczyk Salach dla szkół ponadgimnazjalnych cz2 ZamKor 2007
Rozwiązanie zadania z fizyki 1 14 Mroszczyk Salach dla szkół ponadgimnazjalnych cz1 ZamKor 2008
Numeryczne rozwiązanie RRZ 20113 14
Deutsch, Coleman rozwiązywanie konfliktów rozdz 5, 14
więcej podobnych podstron