Wyznaczanie stężeń w substancji w roztworach metodą kolorymetryczną. Pomiar widma absorpcji barwników w roztworach za pomocą spektrofotometru.
Oddziaływanie fal elektromotorycznych na materię obserwuje się zazwyczaj jako zjawiska załamania, odbicia, pochłaniania i rozproszenia.
Weźmy pod uwagę przedział fal elektromagnetycznych zwanych falami świetlnymi. Światło ulega na ogół osłabieniu podczas przejścia przez substancję. Jeżeli strumień świetlny o natężeniu I0 pada na substancje, to część energii może ulec odbiciu (I1), rozproszeniu (I2) i absorpcji (I3), a pozostała ilość energii przechodzi (I).
I0 = I1 + I2 + I3 +I
Zazwyczaj zjawiska odbicia, rozproszenia i absorpcji występuję jednocześnie. Jeżeli jednak I1 + I2 << I3 to możemy mówić, że zachodzi tylko, zjawisko absorpcji światła.
Zmiana natężenia światła -dI przy przejściu przez warstwę o dowolnie małej grubości dl w roztworze, w którym stężeniu substancji pochłaniającej wynosi c, wyraża się wzorem:
-dI ~ c I dt
-dt = μ c I dl
gdzie μ jest współczynnikiem absorpcji. Z tego równania można wyliczyć natężenie światła przechodzącego.
![]()
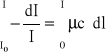
I = I0 e -μcl
Jest to prawo Lamberta-Beera, które mówi, że natężenie światła przechodzącego przez roztwór substancji absorbującej zależy od natężenia światła padającego, stężenia i grubości warstwy roztworu oraz od współczynnika absorpcji. Współczynnik absorpcji jest wielkością charakteryzującą właściwości absorpcyjne substancji.
Prostszy zapis matematyczny prawa absorpcji otrzymuje się po zlogarytmowaniu wzoru
lg I = lg I0 - μcl | lg e
czyli:
![]()
Wprowadzając oznaczenie
![]()
i ![]()
można napisać
E = εcl
![]()
W spektroskopi E nosi nazwę ekstynkcji lub gęstości optycznej. Stosunek natężeń wiązek świetlnych można łatwo zmierzyć, dlatego ekstynkcja jest podstawowa wielkością optyczną, którą wyznacza się doświadczalnie. Wielkość ε jest to współczynnik ekstynkcji, który ma taki sam sens fizyczny jak współczynnik absorpcji μ. Współczynnik ekstynkcji ε liczbowo jest równy ekstynkcji warstwy roztworu o jednostkowej grubości i jednostkowym stężeniu.
Inną wielkością używaną w spektroskopii jest transmisja T wyrażona w %.
![]()
Związek między transmisją a ekstynkcją jest następujący
![]()
Substancje w różny sposób absorbuję światło o różnej częstotliwości. Dlatego współczynnik ekstynkcji ε jest funkcją częstości lub inaczej długości fali
ε(γ) ; ε(λ)
gdzie: ![]()
c − prędkość światła
Zależność współczynnika ekstynkcji ε od długości fali lub częstości nazywa się. widmem absorpcji. Widmo absorpcji jest charakterystyczne dla danej substancji.
Widmo absorpcji substancji zależy od struktury cząsteczek tej substancji.. Za pochłanianie fal optycznych w zakresie widzialnym i w ultrafiolecie są odpowiedzialne elektrony walencyjne, czyli tzw. elektrony Π i σ. Widma te w spektroskopii nazywa się widmami elektronowymi. Typowym przykładem widm elektronowych są widma absorpcji roztworów barwników organicznych.
W spektroskopii molekularnej obok czterech liczb kwantowych (n, l, m, s) wprowadza się nową liczbę kwantową λ opisującą elektron w cząsteczce. Weźmy pod uwagą cząsteczkę dwuatomową. Wektor całkowitego momentu pędu elektronu walencyjnego w takiej cząsteczce może ustawić się pod różnymi kątami do prostej łączącej jądra atomów. Rzut momentu pędu na tę prostą jest skwantowany zgodnie z zasadami mechaniki kwantowej. Wynikająca z tego kwantowania liczba kwantowa λ może przybierać wartości o, 1, 2,…. Jeżeli stan elektronu jest opisany liczbą kwanyową λ=0 nazywa się go elektronem σ, dla λ=1 mamy elektron Π.
Aby wyjaśnić charakter absorbcyjny widm elektronowych i ich związek ze strukturą cząsteczki należy rozpatrzyć zmiany energii cząsteczki jakie mogą zachodzić pod wpływem enegrii dostarczanej z zewnątrz. Na energie cząsteczki składają się między innymi energia elektonów Π i σ(Eo) energia oscylacji (Eosc) atomów w cząsteczce i energia rotacji cząsteczki (Eror). Energia ta jest skwantowana, czyli może przyjmować tylko ściśle określone wartości. Zbiór tych wartości można przedstawić na schemacie w
postaci poziomów energetycznych cząsteczki:
Oznaczenia:
0, 1, 2, 3… dozwolone wartości energii rotacyjnej − poziomy rotacyjne
0, 1, 2, 3… dozwolone wartości energii oscylacyjnej − poziomy oscylacyjne
A− podstawowy poziom elektronowy, który odpowiada stanowi stacjonarnemu elektronów w cząsteczce
B− pierwszy wzbudzony poziom elektronowy
C− drugi wzbudzony poziom elektronowy
Najniższej wartości energii elektronu odpowiada poziom E0, czyli elektronowy poziom podstawowy. Charakteryzuje od energie elektronów cząsteczki w stanie stacjonarnym. Poziomy E1, S2, i dalsze charakteryzują energie jaką posiada cząsteczka w pochłonięciu kwantu energii, czyli cząsteczka w tzw. stanie wzbudzonym. Zmiany energii cząsteczki przedstawia się na schemacie jako przejścia między poziomami energetycznymi. Jeżeli np. cząsteczka pochłonęła kwant hν, taki że jej energia E1=Ec+hν, to przechodzi ona z poziomu podstawowego E0 do poziomu wzbudzonego E1, co na schemacie zaznaczono strzałką A.
Doświadczalnie stwierdzono, że przy pochłanianiu światła przez cząsteczki zachodzą zmiana energii elektronów, energii oscylacji i rotacji. Zmiany energii rotacji są mniejsze od zmian energii elektronów.
ΔErot<ΔEosc<ΔEel
Na schemacie poziomów energetycznych cząsteczki zaznaczono to w ten sposób, że każdemu poziomowi elektronowemu towarzyszy układ poziomów oscylacyjnych miedzy którymi znajdują się poziomy rotacyjne.
Wstanie stacjonarnym cząsteczki znajdują się na najniższym poziomie elektronowym i na jednym z najniższych poziomów oscylacyjnych i rotacyjnych. Podczas absorpcji światła cząsteczki mogą przejść do wyższych poziomów oscylacyjnych i rotacyjnych elektronowego stanu wzbudzonego, co na schemacie zaznaczono strzałkami b, c, d. Dlatego podczas przejścia cząsteczek ze stanu elektronowego podstawowego do stanu wzbudzonego, absorpcji ulega nie jeden rodzaj kwantów (linia absorpcji) lecz zbiór różnych kwantów pochłanianych w różnej ilości przez substancje czyli pasmo absorpcji.
Widmo absorpcji związków organicznych w roztworach składa się z kilku pasm w zakresie fal widzialnych ultra fioletowych (UV). Każde pasmo odpowiada przejściu między elektronowym poziomem podstawowym i jednym z poziomów elektronowych wzbudzonych (pasmo I i II). Na wykresie ε = f(λ) [lub E = f(λ)] każde pasmo jest przedstawione za pomocą krzywej podobnej do pierwszej krzywej Gausa. Na rys. 146 przykładowo przedstawiono widmo absorpcji witaminy B2.
Typowymi przyrządami do pomiaru widm absorpcji są różnego rodzaju spektrofotometry, za pomocą których można zmierzyć ekstynkcję badanej substancji w zależności od długości fali lub częstotliwości światła absorbowanego. Widmo absorpcji można również badać dowolnym zestawem pomiarowym, który pozwoli wyznaczyć E = f(λ).
Absorpcję światła widzialnego i ultrafioletu przez cząsteczki wykorzystuje się w badaniach biologicznych i technologicznych do:
− badania struktury substancji; z położenia maksimum pasm absorpcji można wnioskować o tych parametrach określających strukturę substancji, które są związane z elektronami Π i σ.
analizy ilościowej; z wartości ekstynkcji E wyznacza się stężenie substancji − stanowi to podstawę kolorymetrii.
Wyszukiwarka
Podobne podstrony:
Ćw.8, dc, GPF, Fizyka lab, Ściągi
Opis 52, dc, GPF, Fizyka lab, Ćw. 52,57
Ćw.4, dc, GPF, Fizyka lab, Ściągi
Ćw.4(1), dc, GPF, Fizyka lab, Ściągi
Ćw.2, dc, GPF, Fizyka lab, Ściągi
Ćw. 6, dc, GPF, Fizyka lab, Ściągi
Ćw.3, dc, GPF, Fizyka lab, Ściągi
ściąga z fizyki, dc, GPF, Fizyka lab, Ściągi, sciąga z fizyki
OPTYKA(1), dc, GPF, Fizyka lab, Ściągi, Ściągi, Ściągi, OPTYKA
Transformacja Lorentza, dc, GPF, Fizyka lab, Ściągi, Ściągi, Ściągi, TRANSFORMACJA LORENZA
Fizyka-ściąga, dc, GPF, Fizyka lab, Ściągi, ściągi Fiza
Rach. błędumm, dc, GPF, Fizyka lab, Ściągi, Ściągi, Ściągi, Rachunek błędu
więcej podobnych podstron