Wykorzystanie techniki monowarstw Langmuira w sensoryce
Marcin Broniatowski
Część teoretyczna
Podstawowe pojęcia z fizykochemii powierzchni
Definicja surfaktantów
Faza, to jedno z najbardziej podstawowych pojęć chemii i fizyki oznaczające część badanego układu, która wykazuje w całej swojej masie jednakowe właściwości fizyczne i chemiczne (opisane jednakowym równaniem stanu) i jest ograniczona wyraźnie od reszty układu. Jeżeli otaczający nas świat stanowi „układ”, to jest on zbiorem wielkiej liczby faz różniących się stanem skupienia, czy też składem. Poszczególne fazy stykają się ze sobą, a obszar ich zetknięcia nazywamy granicą faz.
Istnieją cząsteczki, które wykazują powinowactwo do gromadzenia się na granicach międzyfazowych. Jeżeli ograniczymy rozważania do granicy faz ciecz/gaz lub ciecz/ciecz, to związki takie nazywamy surfaktantami. Cząsteczka typowego surfaktanta wykazuje budowę blokową. Składa się z części liofilowej (tzw. głowy) i liofobowej (tzw. ogona). W przypadku surfaktantów adsorbujących się na granicy faz woda/powietrze, „głową” jest hydrofilowa grupa polarna, zaś „ogonem” - hydrofobowy łańcuch węglowodorowy. Cząsteczki surfaktantów mogą zawierać więcej niż jeden łańcuch węglowodorowy (np. triglicerydy zawierają trzy), a czasami więcej niż jedną „głowę” (np. tzw. bolaformy zawierają dwie). Grupa polarna cząsteczki surfaktanta może ulegać jonizacji w wodzie; mamy wówczas do czynienia z surfaktantami jonowymi: (kationowymi lub anionowymi) lub też nie ulega jonizacji (surfaktanty niejonowe).
Na granicy faz woda/powietrze część hydrofilowa cząsteczki surfaktanta silnie oddziałuje z cząsteczkami wody, „zakotwiczając” całą cząsteczkę w warstwie powierzchniowej, natomiast hydrofobowy łańcuch węglowodorowy unika kontaktu z fazą wodną i zazwyczaj w warstwie powierzchniowej skierowany jest w stronę powietrza.
Surfaktanty, które rozpuszczają się w wodzie (np. sole kwasów tłuszczowych, IV- rzędowe sole amoniowe) tworzą na jej powierzchni monowarstwę adsorpcyjną, zwaną często monowarstwą Gibbsa, podczas gdy cząsteczki surfaktantów nierozpuszczalnych w wodzie tworzą, po naniesieniu na powierzchnię wody w odpowiednim rozpuszczalniku, nierozpuszczalne monowarstwy Langmuira.
Definicja napięcia powierzchniowego
Cząsteczka we wnętrzu fazy ciekłej znajduje się w polu sił o symetrii kulistej, natomiast na granicy faz ciecz/gaz symetria ta zostaje zaburzona, a siły działające na cząsteczkę nie równoważą się, co schematycznie ilustruje poniższy rysunek
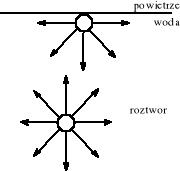
Ponieważ w fazach skondensowanych dominują oddziaływania o ujemnej energii potencjalnej (przyciąganie międzycząsteczkowe), cząsteczki znajdujące się na granicy oddzielającej fazę skondensowaną od próżni lub gazu rozrzedzonego są „wciągane” do wnętrza fazy skondensowanej. Przenoszenie cząsteczek z wnętrza roztworu na granicę faz jest procesem wymagającym wykonania pracy przeciwko siłom spójności, a przy założeniu, że operacja ta wykonywana jest w stałej temperaturze, bez zmiany objętości fazy skondensowanej i w sposób quasi - statyczny, to praca ta równa jest zmianie energii swobodnej układu. Pozwala to zdefiniować napięcie powierzchniowe (γ) jako cząstkową pochodną energii swobodnej Helmholtza, F, względem rozpatrywanej powierzchni, A:
γ = ∂F/∂A
Zjawisko adsorpcji na granicy faz woda/powietrze
Zjawisko gromadzenia się cząsteczek substancji rozpuszczonej na powierzchni roztworu (granica faz roztwór/powietrze) nazywa się adsorpcją. W sposób ilościowy adsorpcja jest opisywana zależnością wiążącą napięcie powierzchniowe (γ) z aktywnością cząsteczek surfaktanta w roztworze (dla rozcieńczonych roztworów surfaktanta aktywność można zastąpić stężeniem molowym). Zależność taką wyznaczoną w stałej temperaturze nazywa się izotermą. W przypadku substancji rozpuszczalnych w wodzie istnieją trzy podstawowe rodzaje izoterm γ = f(c), co ilustruje rysunek 2.
Krzywa 1 przedstawia adsorpcję dodatnią, charakterystyczną dla wielu rodzajów cząsteczek organicznych niebędących typowymi surfaktantami, np. dla roztworu etanolu, czy acetonu w wodzie. Krzywa 2 przedstawia adsorpcję ujemną (cząsteczki substancji rozpuszczonej unikają granicy faz roztwór/powietrze), charakterystyczną dla roztworów większości soli nieorganicznych, a również dla niektórych związków organicznych silnie ulegających hydratacji, np. sacharozy. Natomiast krzywa 3 przedstawia adsorpcję dodatnią, charakterystyczną dla typowych surfaktantów. Początkowo przy wzroście stężenia surfaktanta w roztworze obserwuje się silny spadek napięcia powierzchniowego, zaś przy pewnym stężeniu c następuje gwałtowna zmiana przebiegu izotermy, i od tego momentu γ przestaje się zmniejszać ze wzrostem stężenia surfaktanta. Stężenie c, przy którym następuje opisywane zjawisko nazywa się krytycznym stężeniem micelizacji, CMC. Przy tym stężeniu w roztworze tworzą się agregaty cząsteczek surfaktanta (w większości przypadków są to kuliste micele).
Termodynamiczny opis procesu adsorpcji na granicy faz woda/powietrze przy założeniu równowagi termodynamicznej pomiędzy wnętrzem roztworu a jego powierzchnią podał Gibbs, wprowadzając pojęcie nadwyżki powierzchniowej Γ, określającej nadmiar cząsteczek surfaktanta na powierzchni granicznej w stosunku do równoważnej objętości fazy stężeniowej.
Γ = -(c/RT)(dγ/dc)T = -(1/RT)(dγ/dlnc)T
Nierozpuszczalne monowarstwy Langmuira różnią się od monowarstw adsorpcyjnych (Gibbsa) przede wszystkim sposobem powstania i opisem termodynamicznym. W przypadku monowarstw Langmuira nie można mówić o nadwyżce powierzchniowej, lecz o „dwuwymiarowym” stężeniu, gdyż przyjmuje się, że monowarstwy te są nierozpuszczalne, czyli całość substancji naniesionej na powierzchnię wody pozostaje na powierzchni międzyfazowej i nie przechodzi do wnętrza roztworu. Istotnym pojęciem związanym z monowarstwmi Langmuira jest ciśnienie powierzchniowe π, definiowane jako:
π = γ0 - γ
gdzie γ0 jest napięciem powierzchniowym czystej wody, a γ zaś napięciem powierzchniowym powierzchni wody pokrytej monowarstwą Langmuira. Ciśnienie powierzchniowe (π) można traktować jako dwuwymiarowy odpowiednik ciśnienia (p). Najstarszym i dotychczas nadal często stosowanym sposobem badania monowarstw Langmuira jest wyznaczanie zależności ciśnienia powierzchniowego od powierzchni przypadającej na cząsteczkę, przy stałej temperaturze i ciśnieniu zewnętrznym. Zależność tę powszechnie nazywa się izotermą π-A.
Historia badań monowarstw Langmuira
Pierwsze informacje o zastosowaniu monowarstw przez człowieka pochodzą z Mezopotamii z około 1800 roku p.n.e. Istniała tam metoda wróżenia polegająca na wylewaniu niewielkich ilości oliwy na powierzchnię wody znajdującej się w cynowej misie. W zależności od zachowania się warstwy oliwy na powierzchni wody, losy ludzkie miały układać w taki, czy inny sposób. Tysiąc lat później metoda ta pojawiła się w starożytnej Grecji, gdzie była zwana lekomancją (gr. lekon - misa; manteja - wróżenie).
Najwcześniejszym technicznym zastosowaniem monowarstw przez człowieka była japońska sztuka grafiki: sumi-nagashi. Kroplę japońskiego tuszu nanosi się na powierzchnię wody, a tusz rozprzestrzenia się po powierzchni tworząc dyfuzyjne wzory, które następnie są wynoszone na papier kładziony delikatnie na powierzchnię wody.
Starożytne opisy wylewania oliwy na powierzchnię morza w celu uśmierzenia fal skłoniły Beniamina Franklina do podjęcia naukowych obserwacji. Uczony ten wylewał niewielkie ilości oliwy na powierzchnię stawu w Claphown i obserwował wygładzanie fal oraz błyskawiczne rozprzestrzenianie się oliwy na powierzchni wody. Wielkim entuzjastą wylewania oliwy na sztormowe fale był w XIX wieku w Anglii John Shields, który proponował, aby wszystkie statki obowiązkowo posiadały zawsze odpowiednią ilość oliwy na wypadek sztormu.
Pierwsze naukowe badania zjawisk powierzchniowych podjął Lord Rayleigh, który między innymi badał wpływ warstw powierzchniowych oleju z oliwek na napięcie powierzchniowe wody. Jako pierwszy oszacował, że warstwy takie mają grubość od 10 do 20 Å. Rayleigh uważał, że warstwy oliwy na wodzie rozprzestrzeniają się tak długo, aż osiągną grubość jednej molekuły. Sądził, że gdyby udało się określić grubość takiej warstwy, to byłby to pierwszy bezpośredni pomiar rozmiarów cząsteczek organicznych. Niestety nie znalazł on wówczas metody przeprowadzenia dokładnego pomiaru.
Prace Rayleigha kontynuowała Agnes Pockels, konstruując proste urządzenie do sprężania monowarstw. Pockels po raz pierwszy opisała izotermy ciśnienia powierzchniowego w funkcji powierzchni przypadającej na cząsteczkę. Stymulowany pracami doświadczalnymi poprzednich badaczy Irwing Langmuir stworzył naukowe podwaliny w dziedzinie badań monowarstw, za co w 1932 roku otrzymał nagrodę Nobla. Jego słynna teoria, przedstawiona w roku 1915, wyjaśniała zjawiska adsorpcji w sposób jasny, prosty i ilościowy. Do badań ciśnień powierzchniowych, Langmuir opracował specjalny przyrząd zwany „wagą”, z którą związane jest dzisiaj jego nazwisko. W urządzeniu tym ruchoma barierka oddziela powierzchnię czystej wody od obszaru pokrytego monowarstwą, a pomiar polega na rejestracji zmian ciśnienia wywieranego przez warstwę podczas przesuwania barierki (kompresja warstwy). Langmuir potwierdził, że warstwy powierzchniowe mają grubość monomolekularną oraz wyciągnął wniosek, że cząsteczki tworzące monowarstwę na powierzchni wody są odpowiednio zorientowane, a mianowicie są zwrócone polarnymi grupami funkcyjnymi w stronę wody, zaś długimi, niepolarnymi łańcuchami w kierunku powietrza. Jego eksperymenty wyjaśniły przyczyny, dlaczego jedne cząsteczki są zdolne do tworzenia stabilnych monowarstw, zaś inne nie.
Metodę wynoszenia monowarstw Langmuira z powierzchni swobodnej wody na podłoże stałe opracowała Katarine Blodgett, pracująca razem z Irvinem Langmuirem w General Electric Research Laboratory. Warstwy takie nazwano następnie warstwami Langmuira - Blodgett (LB). Warstwy Langmuira-Blodgett wyniesione na stałe podłoża znalazły liczne zastosowania praktyczne, między innymi w sensoryce, diagnostyce medycznej, technologii komputerowej i elektronice, katalizie i wielu innych dziedzinach przemysłu precyzyjnego. Wynika to z możliwości tworzenia nowych materiałów, czy też modyfikowania właściwości materiałów już znanych z dokładnością na poziomie cząsteczek.
Charakterystyka monowarstw Langmuira
Monowarstwy Langmuira otrzymuje się poprzez naniesienie na swobodną powierzchnię wody (lub roztworu wodnego) roztworu substancji tworzącej monowarstwę (najczęściej związku o charakterze amfifilowym) w lotnym rozpuszczalniku organicznym. Po odparowaniu rozpuszczalnika, na powierzchni wody powstaje nierozpuszczalna monowarstwa Langmuira. Równowaga termodynamiczna pomiędzy monowarstwą Langmuira a subfazą wodną ustala się bardzo powoli, więc monowarstwa Langmuira w chwili jej badania jest tworem nierównowagowym. Z upływem czasu od powstania monowarstwy powoli ustalała się równowaga pomiędzy monowarstwą Langmuira, a otaczającymi ją fazami. Przejawia się to powolnym spadkiem ciśnienia powierzchniowego, π, wywieranego przez monowarstwę albo na skutek rozpuszczania się jej cząsteczek w fazie wodnej (ustalanie się równowagi pomiędzy fazą ciekłą, a monowarstwą Langmuira), albo w wyniku parowania cząsteczek tworzących monowarstwę Langmuira (ustalanie się równowagi pomiędzy fazą gazową a monowarstwą), lub też agregacji cząsteczek surfaktanta zachodzącej w monowarstwie. Zależność ciśnienia powierzchniowego od czasu π-t określa stabilność monowarstwy: im wolniejszy spadek ciśnienia powierzchniowego w czasie tym stabilniejsza jest monowarstwa.
Zależność ciśnienia powierzchniowego od powierzchni przypadającej na cząsteczkę mierzona w stałej temperaturze (izoterma π-A) stanowi najbardziej podstawowy sposób opisu zjawisk zachodzących w monowarstwie podczas kompresji/ekspansji. Monowarstwę naniesioną na swobodną powierzchnię wody (lub wodnego roztworu) na wadze Langmuira można sprężać za pomocą ruchomej barierki, zaś ciśnienie powierzchniowe podczas sprężania rejestruje się za pomocą tensjometru (najczęściej typu Wilhelmiego). Postać izotermy π-A zależy od tego, jakiego rodzaju związek chemiczny tworzy monowarstwę Langmuira, oraz od temperatury, w jakiej prowadzony jest pomiar.
Stan monowarstwy Langmuira
W czasach, gdy Langmuir badał nierozpuszczalne monowarstwy znane były trzy stany materii: gazowy, ciekły i stały (stan ciekłokrystaliczny nie był wówczas jeszcze dokładnie poznany). Monowarstwa Langmuira stanowi twór dwuwymiarowy: cząsteczki w warstwie mogą zachowywać się jak dwuwymiarowy gaz, dwuwymiarowa ciecz lub dwuwymiarowy kryształ.
Izoterma π-A najczęściej nie rejestruje gazowego stanu monowarstwy, gdyż wówczas ciśnienie powierzchniowe jest bliskie zeru, w zakresie błędu pomiarowego tensjometru. Zgodnie z podstawowymi teoriami, w monowarstwie w stanie gazowym, cząsteczki leżą płasko na powierzchni wody, a odległości pomiędzy nimi są znaczne. Tego typu monowarstwa może być opisana za pomocą dwuwymiarowego równania gazu doskonałego: πA = nRT
Podczas sprężania monowarstwy, cząsteczki zbliżają się do siebie i dochodzi do przejścia fazowego pierwszego rodzaju gaz - ciecz rozprężona (ang. liquid expanded, w skrócie LE). Cząsteczki tworzące monowarstwę zachowują się jak dwuwymiarowa ciecz izotropowa, a łańcuchy węglowodorowe nie leżą już płasko na powierzchni wody, lecz są skierowane w stronę powietrza. W stanie cieczy izotropowej nie obserwuje się żadnego uporządkowania długich osi cząsteczek. Łańcuchy są skierowane w stronę powietrza pod różnymi kątami w stosunku do powierzchni wody, występują też liczne defekty gauche podobnie jak w ciekłych węglowodorach, powodujące zginanie się łańcuchów.
Przy dalszej kompresji dochodzi do kolejnego przejścia fazowego pierwszego rodzaju: ciecz rozprężona - ciecz skondensowana (ang. liquid expanded LE - liquid condensed LC). Przy dalszym sprężaniu dochodzi do przejścia fazowego ze stanu cieczy skondensowanej LC do stanu stałego monowarstwy (ang. solid S). Nie dla wszystkich cząsteczek tworzących monowarstwy Langmuira daje się zaobserwować wszystkie opisane powyżej stany monowarstwy, dla wielu substancji (np. kwas oleinowy) osiągany jest tylko stan cieczy rozprężonej (LE) lub cieczy skondensowanej (LC).
Kryterium przypisania stanu monowarstwy do jednego z wyżej omówionych może być wartość ściśliwości monowarstwy, zdefiniowana poniższym wzorem:
![]()
Wartości parametru ściśliwości monowarstw są bardzo małe (rzędu 10-4) i dosyć niewygodne w użyciu, dlatego analizując stan monowarstwy używa się najczęściej modułu ściśliwości monowarstwy CS-1, który jest zdefiniowany poniższym równaniem:
![]()
Zgodnie z przyjętą klasyfikacją dla stanu ciekłego rozprężonego (LE) wartości CS-1 zawierają się w przedziale 12,5 - 100 mN/m, a dla stanu ciekłego skondensowanego od 100 - 250 mN/m. Powyżej 250 mN/m stan monowarstwy określany jest jako stały.
Przy dalszym sprężaniu monowarstwy w obszarze wysokich ciśnień powierzchniowych izoterma π-A przechodzi przez maksimum, lub też osiąga obszar stały (plateau), który rozciąga się do powierzchni cząsteczkowych, które są mniejsze od powierzchni przekroju poprzecznego cząsteczek. Takie zachowanie izotermy świadczy o tym, że doszło do załamania struktury monowarstwy, które można traktować jako przejście fazowe struktura dwuwymiarowa - struktura trójwymiarowa. Załamanie monowarstwy nazywa się często kolapsem, a odpowiedające mu ciśnienie powierzchniowe ciśnieniem kolapsu πcoll.
Podstawy sensoryki
Sensor chemiczny jest to urządzenie, które przetwarza chemiczną informację, począwszy od stężenia określonego składnika próbki, po ogólny skład matrycy, na sygnał użyteczny analitycznie.
Informacja chemiczna może pochodzić od reakcji chemicznej oznaczanego składnika lub od fizycznej właściwości badanego systemu. Chemiczny sensor zawiera dwa podstawowe elementy: chemicznie selektywną warstwę receptorową i element przetwornikowy. Wiele sensorów zawiera również separator - najczęściej w formie membrany. W części receptorowej sensora informacja chemiczna jest przekształcana w formę energii, która może być mierzona przez przetwornik. Głównym zadaniem przetwornika jest konwersja mierzonego parametru na sygnał: elektryczny, optyczny lub akustyczny. Przetwornik nie wykazuje selektywności chemicznej. Chemiczne sensory można sklasyfikować wg typu zastosowanego przetwornika. Dzielą się na 4 podstawowe kategorie: termiczne, masowe, elektrochemiczne i optyczne.
W wielu nowoczesnych sensorach w każdej z czterech wymienionych powyżej kategorii stosowana jest technika wielowarstw Langmuira-Blodgett. Zastosowanie tej techniki może dotyczyć części receptorowej sensora lub też części przetwornikowej.
Zastosowanie warstw Langmuira-Blodgett w sensoryce i innych dziedzinach techniki staje się czynnikiem stymulującym badania tych układów realizowane w wielu czołowych ośrodkach badawczych. Zanim otrzyma się wielowarstwę na stałym podłożu metodą Langmuira-Blodgett należy stworzyć monowarstwę Langmuira na powierzchni wody, a następnie przenieść ją za pomocą odpowiednio dopracowanej procedury wynoszenia na odpowiednio przygotowane podłoże stałe. Taka kolejność rzeczy stymuluje badania monowarstw Langmuira na granicy faz woda/powietrze. Ponadto oddziaływania międzycząsteczkowe, które mogą znaleźć potencjalne zastosowania w sensorach badane są najpierw na wadze Langmuira na swobodnej powierzchni wody. W takim przypadku cząsteczki będące w przyszłym sensorze warstwą receptorową tworzą monowarstwę Langmuira na powierzchni wody, a substancja (analit), której obecność i stężenie w układzie określać ma sensor, znajduje się rozpuszczona w subfazie wodnej. Cząsteczki obecne w subfazie wodnej oddziałują z cząsteczkami tworzącymi monowarstwę Langmuira, co przejawia się w przebiegu izoterm ciśnienia powierzchniowego π - A, stabilności monowarstw (zależność π - t), zależności modułu sprężystości od powierzchni przypadającej na cząsteczkę CS-1 -A, wartości ciśnień kolapsu oraz innych wielkościach, które można mierzyć przy pomocy dodatkowych urządzeń podczas kompresji monowarstwy (np. potencjał powierzchniowy, moment dipolowy, gęstość powierzchniowa i inne).
Składnikiem warstw Langmuira-Blodgett wykorzystywanych w sensorach, czy też innych układach modelowych są często kwasy tłuszczowe, głównie długołańcuchowe, nasycone, gdyż są wzorcowymi cząsteczkami tworzącymi monowarstwy Langmuira, a ich zachowanie na granicy faz woda/powietrze jest dokładnie przebadane. Kwasy stosowane w badaniach i tworzące monowarstwy Langmuira, to: kwas laurynowy CH3-(CH2)10-COOH, kwas mirystynowy CH3-(CH2)12-COOH, kwas palmitynowy CH3-(CH2)14-COOH, kwas stearynowy CH3-(CH2)16-(COOH), kwas arachidowy CH3-(CH2)18-COOH i kwas behemowy CH3-(CH2)20-COOH. W trakcie ćwiczenia wykorzystany będzie czternastowęglowy kwas mirystynowy (systematyczna nazwa tego kwasu to kwas tetradekanowy).
Kwasy karboksylowe tworzące monowarstwę Langmuira, a właściwie ich „głowa” polarna, czyli grupa -COOH zanurzona w subfazie wodnej, oddziałują z rozpuszczonymi w subfazie wodnej kationami, co przejawia się w kształcie i położeniu izotermy π-A, gdy porówna się izotermę uzyskaną dla danego kwasu na ultraczystej wodzie z izotermą π-A uzyskaną na roztworze soli danego metalu. Oddziaływanie z kationami jest selektywne, w związku z czym wielowarstwy kwasów karboksylowych wyniesione na stałe podłoże za pomocą metody Langmuira - Blodgett mogą znaleźć zastosowanie w sensoryce. Układy te mogły by być zastosowane do oznaczania stężeń jonów metali ciężkich oraz toksycznych metali przejściowych (np. chromu) w wodach powierzchniowych i ściekach.
Część eksperymentalna
Opis używanego sprzętu (schemat wagi Langmuira)
Na powyższym rysunku przedstawiono schemat wagi Langmuira. Głównym elementem wagi Langmuira jest teflonowa wanienka o powierzchni 300 cm2. Wanienkę wypełnia się ultraczystą, redestylowaną wodą, tak, aby zaobserwować górny menisk. Następnie za pomocą mikrostrzykawki nakrapia się na powierzchnię wody odpowiednią objętość roztworu surfaktanta w lotnym rozpuszczalniku organicznym. Lotny rozpuszczalnik odparowuje z powierzchni wody w przeciągu kilku minut, a na powierzchni pozostają tylko cząsteczki surfaktanta, po upływie tego czasu można rozpocząć kompresję. Monowarstwę kompresuje się za pomocą ruchomej barierki, której prędkość w szerokim zakresie można regulować za pomocą programu obsługującego urządzenie. Teflonowa wanienka wagi Langmuira zwykle montowana jest na łaźni wodnej, stąd istnieje możliwość dokładnego termostatowania układu podczas eksperymentu. Pomiar ciśnienia powierzchniowego dokonywany jest za pomocą odpowiedniego sensora działającego w oparciu o metodę Wilhelmiego pomiaru napięcia (ciśnienia) powierzchniowego. Metoda Wilhelmiego jest jedną z metod pomiaru napięcia powierzchniowego, polegających na odrywaniu obiektu (prostokątnej płytki) od powierzchni wody. Płytka powinna być wykonana z materiału o idealnej zwilżalności (kąt zwilżania płytki wynosi 0 stopni), zwykle wykonana jest z platyny lub odpowiedniej bibuły chromatograficznej. W praktyce stosuje się głównie bibułę, gdyż pozwala to uniknąć pracochłonnej procedury czyszczenia płytki platynowej po każdym pomiarze.
Waga Langmuira jest połączona poprzez interfejs z komputerem i obsługiwana przez odpowiedni program stworzony przez producenta wagi Langmuira, firmę NIMA (Coventry UK).
Wykonanie Ćwiczenia
Celem ćwiczenia jest przebadanie oddziaływania cząsteczek kwasu mirystynowego tworzących monowarstwę Langmuira z jonami z grupy cynkowców obecnymi w subfazie wodnej.
I). Przygotowanie roztworu kwasu mirystynowego
Na wadze analitycznej odważyć około 5 mg kwasu mirystynowego w kolbce miarowej o objętości 10 cm3. Kolbkę uzupełnić chloroformem do kreski miarowej i wymieszać.
II). Przygotowanie roztworów chlorków cynkowców.
Z kolb o objętości 250 cm3 zawierających roztwory chlorków: cynku, kadmu i rtęci o stężeniu 0,01mol/dm3 każdy, pobrać po 5 cm3, przenieść ilościowo do podpisanych kolb o objętości 500cm3 i uzupełnić wodą redestylowaną do kresek. W ten sposób otrzymuje się roztwory Zn2+, Cd2+ i Hg2+ o stężeniu 10-4M.
III). Obsługa wagi Langmuira.
Włączyć program obsługujący wagę Langmuira.
Za pomocą aspiratora ściągnąć wodę z wagi Langmuira, rynienkę teflonową oczyścić przecierając delikatnie powierzchnię rynny watą nasączoną chloroformem (proszę uważać, żeby nie porysować teflonu !!!). Przy wszelkich operacjach przy wadze Langmuira należy uważać, żeby nie uszkodzić tensjometru (nie szarpnąć płytki Wilhelmiego). Po oczyszczeniu rynienkę napełnić wodą redestylowaną w celu wypłukania resztek rozpuszczalników organicznych i zanieczyszczeń. Wodę ściągnąć za pomocą aspiratora. Ponownie napełnić rynienkę wodą redestylowaną, tak by osiągnąć wypukły menisk. Za pomocą instrukcji close barier przeskanować powierzchnię wagi z największą możliwą prędkością w celu usunięcia ewentualnych zanieczyszczeń. Gdy barierka zatrzyma się w pobliżu sensora, za pomocą aspiratora ostrożnie oczyścić powierzchnię wody pomiędzy barierką a sensorem, uważając, by nie zahaczyć aspiratorem o bibułkę sensora. Otworzyć barierkę za pomocą instrukcji open.
Powyższą procedurę stosuje się za każdym razem, po zmierzeniu kolejnej izotermy.
IV) Pomiar izoterm kwasu mirystynowego
Pomiar izotermy kwasu mirystynowego na czystej wodzie:
Wagę napełnić wodą redestylowaną, po oczyszczeniu powierzchni, za pomocą mikrostrzykawki nakropić odpowiednią objętość kwasu mirystynowego. Odczekać 5 minut, następnie rozpocząć kompresję. Po zarejestrowaniu izotermy, wyniki zapisać na dysku.
Pomiar izotermy kwasu mirystynowego na 10-4M roztworze Zn2+
Napełnić wagę roztworem Zn2+ o stężeniu 10-4M, po oczyszczeniu powierzchni nakropić odpowiednią objętość kwasu mirystynowego, odczekać 5 minut na odparowanie chloroformu z powierzchni wody, zarejestrować izotermę, wyniki zapisać na dysku.
Pomiar izotermy kwasu mirystynowego na 10-4M roztworze Cd2+
Napełnić wagę roztworem Cd2+ o stężeniu 10-4M, dalej jak wyżej.
Zmierzyć izotermę kwasu mirystynowego na 10-4M roztworze Hg2+
Sporządzić roztwór Hg2+ o stężeniu 10-6 mol/dm3.
Zmierzyć izotermę kwasu mirystynowego na 10-6M roztworze Hg2+
Opracowanie wyników
Za pomocą programu Excel (lub innego) sporządzić dwa wykresy zbiorcze zawierające: 1) izotermę kwasu mirystynowego na wodzie i izotermy na 10-4M roztworach Zn2+, Cd2+, Hg2+; 2) izotermę kwasu mirystynowego na wodzie i izotermy na roztworach Hg2+ (10-4 i 10-6M). Korzystając z izoterm zebranych w wykresie 1 obliczyć swobodne energie kompleksowania:
![]()
Wartości energii kompleksowania zebrać w tabeli.
Korzystając z izoterm zebranych w wykresie 1 obliczyć dla każdego z czterech układów moduły ściśliwości CS-1. Na wykresie 3 przedstawić zależności CS-1 w funkcji powierzchni A (CS-1-A).
Sprawozdanie
Sprawozdanie przygotowuje się indywidualnie. W sprawozdaniu należy krótko scharakteryzować monowarstwy Langmuira i metody ich badania (na podstawie notatek sporządzonych w trakcie ćwiczenia). Należy zwrócić uwagę na zastosowanie warstw Langmuira-Blodgett w sensoryce i ewentualne zastosowanie badanego w trakcie ćwiczenia kwasu mirystynowego do wykrywania kationów metali z grupy cynkowców.
Należy umieścić wykres 1, a następnie go dokładnie omówić. W dalszej kolejności umieścić tabelkę z wartościami swobodnych energii kompleksowania jonów Zn2, Cd2+ i Hg2+ przez kwas mirystynowy w monowarstwie Langmuira. Wartości porównać ze sobą, skomentować i skorelować z ewentualnym wykorzystaniem kwasu mirystynowego w sensoryce. Następnie umieścić wykres 2, omówić, uwzględniając zastosowanie warstw kwasu mirystynowego w sensoryce. W dalszej kolejności umieścić wykres 3 (CS-1 - π). Proszę omówić jak zmienia się stan monowarstwy kwasu mirystynowego pod wpływem różnych jonów i spróbować skorelować to z uporządkowaniem cząsteczek kwasu mirystynowego w monowarstwie.
1
B obszar pokryty monowarstwą
A obszar czystej wody
tensjometr
teflonowa
wanienka
ruchoma
barierka
do termostatu
Wyszukiwarka
Podobne podstrony:
materiały prosecy i techniki produkcyjne laborki sem v
Konspekt - wiertarka, Studia materiały, Dydaktyka techniki
08 Wykorzystywanie techniki komputerowej
Materiały na egzamin, Materiały pomocnicze Technik Informatyk
masalski, chemia materiałów, GALWANO TECHNIKA
Podstawa programowa z techniki, szkoła, Materiały do techniki(technika)
uwaga, AGH-materiały, TPEZ Technika Podziemnej Eksploatacji Złóż
ŚCIĄGA Z MECHANIKI GRUNTÓW, AGH-materiały, TPEZ Technika Podziemnej Eksploatacji Złóż
BRAK NAZWY, AGH-materiały, TPEZ Technika Podziemnej Eksploatacji Złóż
Wykorzystanie technik jądrowych w medycynie
Psychologia religii - egzamin, 11. Wulff D - Techniki stymulacji i deprywacji sensorycznej - Psychol
MateriaL,oznawstwo i Techniki W Sprawozdanie 2F id 284248
03 Wykorzystanie technik inform Nieznany (2)
Wykorzystanie techniki badania PET CT
sciaga materialy niezelazne, Technik BHP, materiałoznastwo (licha2) (1) (krzycho800)
MateriaL,oznawstwo i Techniki W Skrypt 1A id 284244
odpowiedzi z odkrywki, AGH-materiały, TPEZ Technika Podziemnej Eksploatacji Złóż
więcej podobnych podstron