Konspekt lekcji „ Estry „
Poziom nauczania: gimnazjum
Podręcznik: „Chemia i my”
Cele lekcji:
Dydaktyczno - wychowawcze:
Kształtowanie myślenia przez analogie,
Kształtowanie umiejętności wyciągania wniosków,
Kształtowanie aktywnej i badawczej postawy ucznia,
Rozwijanie wyobraźni,
Kształtowanie umiejętności samodzielnego poszukiwania i przetwarzania informacji,
Wdrażanie do systematycznej i dokładnej pracy.
Operacyjne.
Uczeń:
Poda wzór ogólny estru,
Wskaże substraty potrzebne do otrzymania określonego estru,
Wyjaśni mechanizm reakcji estryfikacji i zapisze równanie reakcji chemicznej,
Umie nazwać produkty reakcji estryfikacji,
Wymieni właściwości fizyczne estrów,
Wykaże właściwości chemiczne estrów,
Poda zastosowanie estrów.
Metody nauczania:
Wiodąca: naprowadzająca - poszukująca
Wspomagająca: problemowa (rodzaj rozumowania: dedukcyjny)
Środki dydaktyczne:
doświadczenie chemiczne,
odczynniki: etanol, kwas octowy, stężony kwas siarkowy (VI),
sprzęt: probówki, łapa do probówek, pipeta, zlewki, palnik, trójnóg, siatka azbestowa,
b) modele kulkowe,
c) prezentacja multimedialna .
Tok lekcji:
Część organizacyjna: sprawdzenie listy obecności oraz pracy domowej (czas: 5 minut)
Część nawiązująca.
Pytania:
Przedstaw ogólną budowę cząsteczki alkoholu,
Zbuduj cząsteczkę alkoholu etylowego za pomocą modeli pręcikowo - kulkowych,
Zapisz wzór strukturalny tego alkoholu na tablicy i zaznacz jego grupę funkcyjną,
Przedstaw ogólną budowę cząsteczki kwasu karboksylowego,
Zbuduj cząsteczkę kwasu octowego za pomocą modeli pręcikowo-kulkowych,
Zapisz wzór strukturalny tego kwasu na tablicy i zaznacz jego grupę funkcyjną,
c) Część postępująca:
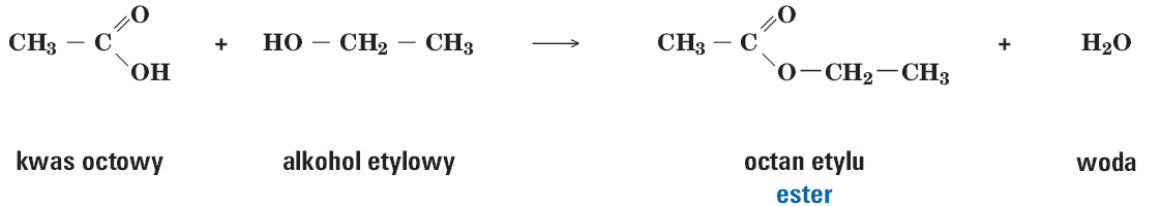
Estry - otrzymywanie i nazewnictwo.
Problem: Czy alkohol etylowy reaguje z kwasem octowym? - pytanie do uczniów;
Uczniowie modelują produkt rekcji między kwasem octowym i alkoholem etylowym -modele pręcikowo-kulkowe;
Uczniowie proponują doświadczenie, które potwierdzi ich hipotezy.
Doświadczenie 1. (Pokaz nauczycielski)
Doświadczenie nr 1. (Pokaz nauczycielski)
Temat: Reakcja kwasu octowego z alkoholem etylowym.
Cel: Zbadanie czy zachodzi reakcja miedzy powyższymi związkami.
Czynności |
Obserwacje |
Do probówki dodajemy równe ilości alkoholu etylowego i kwasu octowego. Następnie dodajemy kilka kropel stężonego kwasu siarkowego (VI).
Zawartość probówki ogrzewamy do wrzenia.
|
Pojawia się charakterystyczny (specyficzny) zapach zmywacza do paznokci.
|
Wnioski: Kwas octowy reaguje z alkoholem etylowym.
Wzór ogólny estrów:
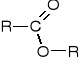
R- gdzie, jednakowe lub różne grupy węglowodorowe
Nazwy estrów są dwuczłonowe. Pierwszą część nazwy estru tworzymy od nazw zwyczajowych lub systematycznych kwasów, dodając do rdzenia tej nazwy końcówkę -an. Drugą część nazwy estru stanowi nazwa rodnika węglowodorowego, pochodzącego z cząsteczki alkoholu.
Wyjaśnienie mechanizmu reakcji estryfikacji.
Wyjaśnienie mechanizmu reakcji estryfikacji na modelach.
Podczas otrzymywania estru w cząsteczce kwasu pęka wiązanie węgiel-tlen, natomiast
w cząsteczce alkoholu pęka wiązanie tlen - wodór.
Cząsteczkę wody tworzy grupa -OH pochodząca z kwasu i atom wodoru pochodzący
z cząsteczki alkoholu. Pozostałe elementy kwasu karboksylowego i alkoholu łączą się tworząc cząsteczkę estru.
KWAS + ALKOHOL ![]()
ESTER + WODA
Mimo podobieństwa do reakcji zobojętniania kwasu z zasadą, reakcja estryfikacji ma inny mechanizm, a powstały ester nie ma charakteru soli.
Właściwości fizyczne estrów.
-Ciecz (estry o mniejszej liczbie atomów węgla),
-Bezbarwne,
-Charakterystyczny zapach,
-Nie rozpuszczające się w wodzie,
-Lotne.
Właściwości chemiczne estrów.
Reakcje hydrolizy:
-hydroliza kwasowa (reakcja odwracalna)
C3H7COOC2H5 + H2O ![]()
C3H7COOH + C2H5OH
-hydroliza zasadowa (reakcja nieodwracalna)
C3H7COOC2H5 + NaOH ![]()
CH3COONa + C2H5OH
Występowanie i zastosowanie.
Z estrami praktycznie mamy do czynienia codziennie, ponieważ jest to grupa związków, najliczniejsza i najbardziej rozpowszechniona w przyrodzie.
W przyrodzie estry występują w owocach i kwiatach dając im specyficzny zapach
np.: maślan etylu-zapach ananasa, są także składnikiem substancji zapachowych wydzielanych przez zwierzęta i owady w celu przyciągania partnera.
Wiele estrów charakteryzuje się przyjemnym zapachem, z tego powodu wykorzystuje się je w przemyśle perfumeryjnym i spożywczym jako substancje zapachowe i smakowe. Mają także zastosowanie jako rozpuszczalniki np.: otrzymany octan etylu stosowany jest jako zmywacz do paznokci, w medycynie, w motoryzacji (biopaliwa, oleje syntetyczne).
Część podsumowująca.
- Utwórz wzory estrów. Wstaw właściwe podstawniki alifatyczne miejsca R.
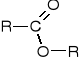
Octan nonylu
Maślan etylu
Propanian oktylu
Octan propylu
R = CH3, C2H5 , C3H7, C8H17, C9H19.
- Uzupełnij równania reakcji estryfikacji. Wstaw odpowiednie wzory we właściwe miejsca. Nazwij substraty i produkty reakcji
CH3OH + ….. ![]()
CH3COOCH3 + …..
CH3OH + ….. ![]()
C2H5COOCH3 + …..
C2H5OH + ….. ![]()
….. +H2O
C3H7OH + ….. ![]()
….. + H2O
CH3COOC2H5, CH3COOH, C2H5COOCH3, C2H5COOC3H7, C3H7COOC2H5, H2O, C2H5COOH, C2H5OH.
Praca domowa
Ułóż :
- Równania otrzymywania: octanu propylu, mrówczanu metylu, mrówczanu butylu.
- Równania reakcji hydrolizy w środowisku kwaśnym: octanu etylu, maślanu etylu, maślanu propylu.
Wyszukiwarka
Podobne podstrony:
Prezentacja o wodzie, Podreczniki Oraz Lektury Do Szkoly, prezentacje z chemi, Prezentacje
POL spis lektur, Do szkoły
Temat 1 Spis lektur do szkoły średniej
spacer z panią jesienią, Dokumenty do szkoły, przedszkola; inne, konspekty i scenariusze
Charakterystyka średniowiecza oraz sztuka epoki, Przydatne do szkoły, średniowiecze
estry, prace do szkoły (wypracowania) itp
Czerwiec, Do szkoły, podręczniki szkoła podstawowa klasa 0 zerówka
Sklepy cynamonowe - biografia Schulza - opracowanie i streszczenia, Przydatne do szkoły, streszczeni
Cechy epoki średniowiecza, podręczniki szkoła średnia liceum technikum klasa 3 trzecia testy, przyda
III do końca Uczeń w drodze do szkoły., Alll, Studia, IV semestr, Konspekty
scenariusz zajeć dla dzieci 3- letnich , Dokumenty do szkoły, przedszkola; inne, konspekty i scenari
Luty, Do szkoły, podręczniki szkoła podstawowa klasa 0 zerówka
II strona Uczeń w drodze do szkoły, Alll, Studia, IV semestr, Konspekty
Droga do szkoły-konspekt, nauczanie zintegrowane, Konspekty kl. 2
Reformy Sejmu Konwokacyjnego, podręczniki szkoła średnia liceum technikum klasa 3 trzecia testy, prz
Układ oddechowy i krwionośny, podręczniki szkoła średnia liceum technikum klasa 3 trzecia testy, prz
Przygotowanie do tworzenia prezentacji, prakatyki pedagogiczne, gimnazjum- konspekty, informatyka
inscenizacja -wszytkiie gr. Polska, Dokumenty do szkoły, przedszkola; inne, konspekty i scenariusze
prezentacja do szkoły
więcej podobnych podstron