Postulaty Bohra:
I: ![]()
II: ![]()
Cząstki elementarne:
Trwałe:
- protony
- elektrony
- fotony
- neutrino
Nietrwałe:
- pozytony
- mezony
- hiperiony
- neutrony
- antyneutrony
Związki chem. O momencie dipolowym równym 0:
CH4, CCl4, C(NO2)4, CO2
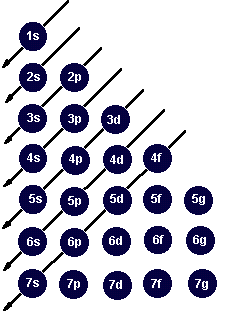
Liczby kwantowe:
- główna - n n = 1, 2, 3 ...
- poboczna (orbitalna) - l l = 0, 1, 2, ..., (n-1)
- magetyczna - m ![]()
- spinowa - s s = ½ , -½
Główna liczba kwantowa - n - określa energię elektronu w atomie, która wynika z odległości elektronu od jądra atomowego. Zespół elektronów o tej samej głównej liczbie kwantowej nosi nazwę powłoki elektronowej.
Poboczna liczba kwantowa - l - określa precezyjnie stan energetyczny elektronu przy określonej głównej liczbie kwantowej n. Charateryzuje więc ona konfigurację orbitalu atomowego.
Magnetyczna liczba kwantowa - m - oznacza zmiany stanu energetycznego atomu, wynikajace ze skręcenia płaszczyzny orbitalu elektronowego pod wpływem pola magnetycznego.
Orbital - porządna funkcja falowa, spełniające równanie Schroedinera (dla konkretnej kombinacji liczb kwantowych)
Elektroujemność - jest to wielkość która charakteryzuje tendencję atomu znajdującego się w cząsteczce do przyciągania ku sobie elektronów.
Hybrydyzacja - w chemii kwantowej to matematyczne przekształcenie funkcji orbitalnych, polegające na "skrzyżowaniu" dwóch lub więcej orbitali atomowych, na skutek czego powstają nowe orbitale, posiadające inny kształt i energię. W istocie hybrydyzacja jest operacją matematyczną ułatwiającą skonstruowanie teorii orbitali walencyjnych, a nie rzeczywistym zjawiskiem fizycznym.
Wiązania (różnice elektroujemności):
Atomowe - 0 - 0,2
Atomowe spolaryzowane - 0,3 - 1,6
Jonowe - >1,7
Kwasy Zasady
Mocne:
HCl LiOH
HNO3 KOH
H2SO4 NaOH
HClO4 Ba(OH)2
Sr(OH)2
Średnie:
H3PO4 Ca(OH)2
H2SO3
Słabe:
HNO2 Al(OH)3
H2S Fe(OH)2
H2CO3 Fe(OH)3
CH3COOH Mg(OH)2
Zn(OH)2
NH4OH
Cu(OH)2
Broensted: kwas dawca protonów, zasada biorca protonów
Arrhenius: kwas dysocjuje z wydzieleniem H+, zasada d. z wydzieleniem OH-
pp. s - dla l = 0
pp. p - dla l = 1
pp. d - dla l = 2
pp. f - dla l = 3
pp. g - dla l = 4
Wyszukiwarka
Podobne podstrony:
Chemia Materiałów Notatki do egzaminu
psychologia emocji i motywacji notatki do egzaminu
Technologie informacyjne - wykład 2-4, AM SZCZECIN, Informatyka - Wykłady
Historia Polski XX wieku Materiały do egzaminu historia polski XXw wykład! 11 12
Stateczność - 4-10 - Zagadnienia do egzaminu, Akademia Morska, Stateczność - Wykłady
Notatki do egzaminu
notatki-do-egzaminu, stosunki międzynarodowe
Technologie informacyjne - wykład 2-8, AM SZCZECIN, Informatyka - Wykłady
Technologie informacyjne - wykład 2-3, AM SZCZECIN, Informatyka - Wykłady
notatka do egzaminu, studia pedagogiczne, Psychologia Ogólna
filozofia bezpieczeństwa - notatka do egzaminu, AON BN
GOSPODARKA WODNO-ELEKTROLITOWA, STOMATOLOGIA, II ROK, Fizjologia, NOTATKI DO EGZAMINU
Notatki do egzaminu, Studia, Psychologia UW - materiały do zajęć, UWPsych - Psychologia rozwoju czło
NERWOWY I - notatki, STOMATOLOGIA, II ROK, Fizjologia, NOTATKI DO EGZAMINU
więcej podobnych podstron