Pojęcie kwasu i zasady |
Definicja historyczna: kwasy mają smak kwaśny.
Teoria Arrheniusa: kwas odszczepia w wodzie jony H+, zasada jony OH-.
Teoria wprowadza pojęcie hydrolizy; tłumaczy przebieg dysocjacji wielostopniowych. Zawodzi w wypadku rozpuszczalników niewodnych.
Teoria Lewisa: kwas jest akceptorem pary (par) elektronowych, zasada zaś - donorem.
|
Teoria rozpuszczalnikowa: kwas tworzy kation identyczny z kationem rozpuszczalnika; zasada tworzy anion identyczny z anionem rozpuszczalnika.
Przykłady:
1 |
Ciekły amoniak autodysocjuje: 2NH3 NH4+ + NH2- Tak więc chlorek amonu (NH4Cl) jest kwasem w ciekłym amoniaku.
|
2 |
Kwas octowy autodysocjuje: 2CH3COOH CH3COOH2+ + CH3COO- Tak więc octany są zasadami w lodowatym CH3COOH. |
Pojęcie kwasu i zasady |
Teoria Brnsteda: kwas i zasada związane są zależnością
kwas zasada + proton
Żadna substancja nie może samorzutnie odłączyć protonu, więc w układzie musi istnieć substancja zdolna ten proton przyłączyć. Stąd istotną rolę gra rozpuszczalnik.
Rozpuszczalniki dzielimy na aprotyczne i protolityczne. Te drugie są zdolne do przyłączenia lub odłączenia protonu i do autoprotolizy:
2H2O H3O+ + OH
2CH3COOH CH3COOH2+ + CH3COO
2NH3(ciekły) NH4+ + NH2
Rozpuszczalniki protolityczne dzielą się na
protofilne (protonoakceptorowe, zasadowe), chętnie przyłączające protony, np. pirydyna:
C5H5N + H+ C5H5NH+
protogenne (protonoakceptorowe, kwaśne), chętnie oddają protony, np. kwas octowy czy mrówkowy
amfiprotyczne (amfoteryczne), które zależnie od warunków przyłączają lub oddają protony, np. woda:
H2O + OH H3O+ oraz H2O H+ + OH
czy etanol:
C2H5OH + H+ C2H5OH2+
oraz
C2H5OH C2H5O + H+
Pojęcie kwasu i zasady. Teoria Brnsteda (c.d.) |
(Zauważmy, że reakcja autodysocjacji jest równowagowa i opisuje ją stała równowagi. Dla wody ta stała Kw=1014. Jest to tzw. iloczyn jonowy wody)
Tak więc w układzie istnieją zawsze pary sprzężone kwas-zasada:
kwas1 + zasada2 zasada1 + kwas2
Przykład: słaby kwas mrówkowy w wodzie:
HCOOH + H2O HCOO + H3O+
kwas1 : HCOOH; kwas2 : H3O+ ;
zasada1 :HCOO; zasada2 : H2O.
|
Zgodnie z teorią Brnsteda reakcja zobojętnienia w rozpuszczalniku protolitycznym sprowadza się do reakcji
H3O+ + OH 2H2O (w wodzie)
NH4+ + NH2- 2NH3 (w ciekłym amoniaku)
zaś reakcja hydrolizy soli - do reakcji substancji jonowej z wodą, np.
NH4+ + Cl- + H2O NH3 + Cl- + H3O+
(zamiast słabego kwasu NH4+ powstaje silny kwas Cl-, więc roztwór staje się kwaśny).
Siła jonowa i aktywność jonów w roztworze |
Przykład (poglądowy, nie ścisły):
Weźmy 1 M roztwór NaCl w wodzie. W 1 dm3 roztwór zawiera 1 mol jonów Na+, 1 mol jonów Cl- i ok. 55 moli cząsteczek H2O.
Na każde 55 cząsteczek H2O przypadają 2 jony. W przestrzeni jony oddzielone są (średnio) zaledwie dwiema cząsteczkami wody!
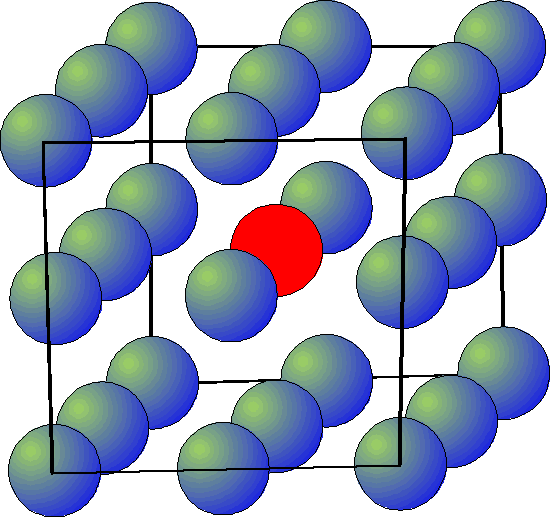
Oznacza to, że jony silnie oddziałują ze sobą elektrostatycznie. Brak jest wody do izolowania ich od siebie; mogą więc tworzyć się tzw. pary jonowe, ruchliwość jonów jest ograniczona...
Wygląda to tak, jak gdyby było mniej jonów, niż to wynika ze stężenia soli.
Siła jonowa i aktywność jonów w roztworze (c.d.) |
Miarą oddziaływań międzyjonowych w roztworze jest siła jonowa:
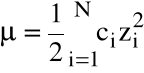
(ci - stężenie molowe i-tego jonu, zi - jego ładunek)
Jeżeli trzeba uwzględnić oddziaływania międzyjonowe, zamiast stężenia molowego jonu wprowadzamy jego aktywność:
ai=ci.fi
gdzie fi - współczynnik aktywności i-tego jonu, obliczany ze wzoru Debay'a-Hückela (1923):
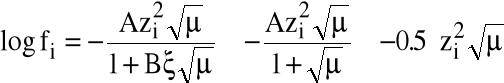
gdzie A, B - stałe, - średnica uwodnionego jonu.
jon |
.10-8 [cm] |
Sn4+, Ce4+, Th4+, Zr4+ H3O+, Al3+, Fe3+, Cr3+ Mg2+, Be2+ Li+, Ca2+, Cu2+, Zn2+, Sn2+, Fe2+, Ni2+, Co2+ Sr2+, Ba2+, Cd2+, Hg2+, S2-, CH3COO- Na+, H2PO4-, Pb2+, CO32-, SO42-, CrO42-, HPO42-, PO43- OH-, F-, SCN-, HS-, ClO4-, Cl-, Br-, I-, NO3-, K+, NH4+, Ag+ |
11 9 8 6 5 4 3
|
Siła jonowa i aktywność jonów w roztworze (c.d.) |
Przykład: Obliczmy współczynnik aktywności i aktywność jonu Sr2+ w 0.01 M roztworze SrCl2, w obecności 0.01 M roztworu KCl.
Obliczamy siłę jonową roztworu:
=1/2.(0.01.4+0.01.1+0.03.1)=0.04
Stosujemy prawo Debay'a-Hückela (wiedząc, że A=0.51, B=3.3.107, =5.10-8 cm):
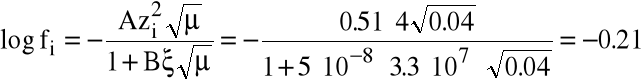
zatem fi=0.49.
|
Prawo Debay'a-Hückela stosuje dla sił jonowych <0.1.
|
Mocne kwasy i zasady Rozpuszczalniki wyrównujące i różnicujące |
Jeśli do wody wprowadzimy cząsteczkę (lub jon), która ma zdolność oddawania protonu większą niż jon H3O+, to przereaguje ona w cząsteczkami H2O, a produktem będzie jon H3O+. Reakcja ta przebiegnie ilościowo (całkowicie), bo istnieje nadmiar cząsteczek wody.
W takim roztworze nie ma niezdysocjowanych cząsteczek: są to silne kwasy. Ich reakcje dysocjacji traktujemy jako nierównowagowe (strzałka w jedną stronę).
Te same kwasy w innych rozpuszczalnikach mogą mieć różną, niekoniecznie dużą moc. Woda jest tu więc rozpuszczalnikiem wyrównującym.
Są też rozpuszczalniki różnicujące. Np. lodowaty kwas octowy ma mocniejsze własności protonodonorowe niż woda. Niektóre kwasy znane jako mocne będą w tym rozpuszczalniku tylko częściowo zdysocjowane.
Słabe kwasy i zasady |
Rozpatrzmy kwasy, które nie dysocjują całkowicie.
W równowadze z jonami pozostają niezdysocjowane cząsteczki, np.:
CH3COOH + H2O H3O+ + CH3COO-
Są to kwasy słabe. Równowagę ich dysocjacji opisuje stała równowagi, tutaj:
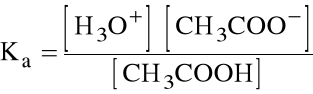
Stałe dysocjacji są stablicowane, zwykle w postaci ich ujemnych logarytmów dziesiętnych:
pKa = logKa
Np. dla kwasu octowego: pKa=4.8, tzn. Ka=1.8.105.
|
Identycznie rozpatrujemy słabe zasady. Np. zasada amonowa dysocjuje wg reakcji
NH4OH NH4+ + OH
(właściwiej byłoby zapisać NH3.H2O)
Reakcję tę opisuje stała dysocjacji zasadowej Kb:
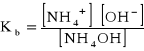
© J. Gliński, w. 6, p. 4
Wyszukiwarka
Podobne podstrony:
prawo ochrony środowiska, 14 15 odpady - pojęcie i rodzaje, zasady
Pojęcie i miejsce zasady subsydiarności w nowej konstytucji,
Otrzymanie określonego kwasu i zasady
Pojęcie i miejsce zasady subsydiarności w nowej konstytucji,, Pojęcie i miejsce zasady subsydiarnośc
1 pojecia, zrodla zasady prawa karnego, prawo karne intertemporane do wyslania
podstawowe pojecia oraz zasady dotyczace oblicznia dochodu zalacznik nr 5
POJECIE SKLADKI I ZASADY JEJ USTALANIA Monika W âĂĺ éT jcik(4)
1 Pojęcie i zasady organizacji finansów w przedsiebiorstwieid 9604 ppt
Pojecie źródła cechy zasady i systematyka prawa cywilnego, prawo cywilne z umowami w administracji(1
więcej podobnych podstron