Iwona Ryłko 08.04.2006
WIMiC, rok II, gr. I
MANGANOMETRIA
Manganometria - metoda miareczkowania przy użyciu mianowanych roztworów nadmanganianów, gł. nadmanganianu potasu, które są utleniaczami substancji oznaczanych; nadmanganometria.
Manganometryczne oznaczanie wapnia - zasada oznaczenia
Jony wapnia reagując z jonami szczawianowymi, tworzą biały, trudno rozpuszczalny osad szczawianu wapniowego
![]()
Dla otrzymania grubokrystalicznego osadu szczawianu wapnia reakcję strącania przeprowadza się na gorąco. Dodatkowo roztwór zawierający jony wapnia zakwasza się kwasem solnym, aby zapobiec zbyt szybkiemu wytrącaniu osadu po dodaniu odczynnika strącającego, jakim jest szczawian amonu. W środowisku kwaśnym CaC2O4, nie wytrąca się, gdyż jest on rozpuszczalny w silnych kwasach. Dodając powoli amoniak do gorącego roztworu, w obecności oranżu metylowego jako wskaźnika, zmienia się odczyn roztworu i powoduje wytrącanie się grubokrystalicznego osadu CaC2O4. Osad ten ponadto poddaje się procesowi „starzenia” poprzez ogrzewanie go na łaźni wodnej.
Osad, po przesączeniu i przemyciu, rozpuszczany jest w kwasie siarkowym zgodnie z reakcją:
![]()
Wydzielony kwas szczawiowy można oznaczyć przez miareczkowanie manganianem (VII) w środowisku kwaśnym:
![]()
Ta metoda oznaczania wapnia jest typową metodą pośrednią, gdyż w miareczkowaniu nie biorą udziału jony Ca+, lecz jony C2O42-. Ponieważ CaC2O4 jest związkiem stechiometrycznym, to liczba moli wapnia jest w nim równa liczbie moli jonów szczawianowych.
Wykonanie oznaczenia
- otrzymaną próbkę rozcieńczyć wodą destylowaną w kolbie miarowej do 100 cm3, po czym pobrać z niej pipetą 20 (25) cm3. Roztwór przenieść do zlewki, rozcieńczyć wodą destylowaną do ok. 100 cm3 i dodać 1 cm3 stężonego kwasu solnego. Zlewkę ogrzać do ok. 80°C.
- do mieszanego roztworu dodawać małymi porcjami 10 cm3 4% roztworu szczawianu amonu oraz kilka kropel oranżu metylowego. Po dodaniu całości szczawianu amonu próbkę zobojętnić 2 M roztworem NH3aq, intensywnie mieszając, do zmiany zabarwienia wskaźnika na żółtą, po czym dodać jeszcze 1 cm3 nadmiaru NH3aq.
- całość ogrzewać na łaźni wodnej przez 1 godzinę. Wytrącony osad przenieść na twardy sączek i przemywać 0,1% roztworem szczawianu amonu do zaniku reakcji na chlorki, po czym osad przemyć dwukrotnie wodą destylowaną. Kilka kropel przesączu po zakwaszeniu kwasem siarkowym, nie powinno odbarwiać jednej kropli manganianu (Vii) potasu.
- przemyty osad wraz z sączkiem przenieść do zlewki. Do całości dodać ok. 50 cm3 gorącego (ok. 60°C) 1 M kwasu siarkowego (VI). Miareczkować na gorąco roztworem manganianu (VII) potasu do lekko różowego zabarwienia roztworu. Zabarwienie musi się utrzymać przez 30 sekund.
Wyniki pomiarów i obliczenia
Ca2+
12,2
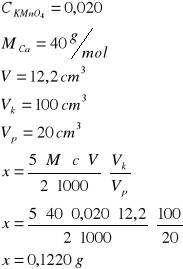
Manganometryczne oznaczanie kwasu szczawiowego - zasad oznaczenia
Stężenie kwasu szczawiowego można wyznaczyć manganometryczne, korzystając z mianowanego roztworu KMnO4. Opiera się to na następującej reakcji utlenienia - redukcji:
![]()
Wykonanie oznaczenia
- otrzymany do analizy roztwór kwasu szczawiowego rozcieńczyć wodą w kolbie miarowej do 100 cm3 i dokładnie wymieszać. Z przygotowanego roztworu pobrać pipetą do trzech kolbek stożkowych po 20 (lub 25) cm3 roztworu, dodać ok. 20 cm3 wody destylowanej oraz ok. 40 cm3 1 M roztworu H2SO4. Roztwór ogrzać na łaźni wodnej do ok. 55 - 60°C i miareczkować mianowanym roztworem manganianu (VII) potasu do pojawienia się bladoróżowej barwy. Barwa powinna się utrzymać przez 30 sekund.
Oznaczenie wykonać trzykrotnie. Masę kwasu szczawiowego w otrzymanej do analizy próbce obliczyć ze wzoru:
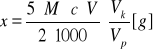
Wyniki pomiaru i obliczenia
C2O42-
19,5
19,5
19,6
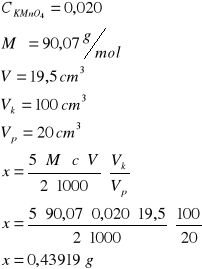
3
Wyszukiwarka
Podobne podstrony:
Iwona Dziewońska Wieliczka
manganometria mail Nieznany
praca zaliczeniowa - Iwona Dłubała, psychologia
Mianowanie roztworu manganianu (VII) potasu
Mangan
mangan
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
manganometrja(Ca)
Ściąga - manganometria, MANGANOMETRIA-KMnO4-
Alkohole Utl alkoholi manganianem
4.Analiza jakościowa kationów. Reakcja kationu manganu (Mn2+). NaOH, NH4OH, MnSO4., Państwowa Wyższa
TEST NA REMEDIAL 2 , Author: Iwona Dębosz
CHEMIA SANITARNA - szczykowska, sprawozdanie - sporządzanie roztw mianoanych do oznaczenia fosforu o
CHEMIA SANITARNA - szczykowska, sprawozdanie - sporządzanie roztw mianoanych do oznaczenia fosforu o
mangan
manganometria15
8 Manganometria(1)
Dekret definitywnego zatwierdzenia stetutu Drogi Neokatechumenalnej 2008 kard Ryłko Słoweński
więcej podobnych podstron