ĆWICZENIE 2
EKSTRAKCJA I SUBLIMACJA
ODCZYNNIKI
- wodny roztwór barwnika
- wodny roztwór NiCl2
- wodny roztwór jodu
- chloroform
- jod
SPRZĘT
- rozdzielacz
- statyw
- lejek
- cylindry miarowe
- zlewki
- kolba okrągłodenna
CEL ĆWICZENIA
Celem ćwiczenia jest zapoznanie się z technikami ekstrakcji i sublimacji.
WSTĘP TEORETYCZNY
Ekstrakcja
Ekstrakcja jest to metoda rozdziału mieszaniny lub oczyszczania substancji, która polega na przeprowadzeniu substancji z jednej fazy, w której jest ona rozpuszczona lub zawieszona do drugiej ciekłej fazy. Najczęściej stosowana techniką jest wydzielanie obojętnego związku organicznego, jego roztworu lub zawiesiny (osadu lub cieczy) w wodzie przez wytrząsanie z rozpuszczalnikiem organicznym (niemieszalnym z wodą), w którym dany związek jest rozpuszczalny. Związki organiczne są zazwyczaj lepiej rozpuszczalne w rozpuszczalnikach organicznych niż w wodzie i dlatego mogą być ekstrahowane z roztworów wodnych.
Prawo podziału Nernsta
Proces ekstrakcji opisuje prawo podziału Nernsta - jeśli do układu dwóch niemieszających się lub słabo mieszających się cieczy tworzących dwie warstwy, doda się pewną ilość substancji trzeciej rozpuszczalnej w obu cieczach, to nastąpi podział tej substancji pomiędzy dwie fazy ciekłe zgodnie z wartością współczynnika podziału
![]()
K = const. (współczynnik podziału Nernsta),
cA i cB = stężenie substancji w fazach A i B czyli:
Stosunek stężeń substancji rozpuszczonej w dwóch niemieszających się z sobą i pozostających stanie równowagi ciekłych fazach A i B jest wielkością stałą w danej temperaturze.
Ekstrakcja jest skuteczna wtedy, gdy substancja rozpuszcza się dużo lepiej w jednej z dwóch faz, czyli gdy K znacznie odbiega od jedności. Gdy K < 100, to ekstrakcja wielokrotna z użyciem nowych porcji rozpuszczalnika jest bardziej efektywna.
Technika ekstrakcji:
Ekstrakcję przeprowadza się w rozdzielaczu kulistym lub gruszkowym zaopatrzonym w korek i umieszczonym w pierścieniu na statywie. Rozdzielacz napełnia się najwyżej do 2/3 objętości, przy czym ekstrahent powinien stanowić 1/3 objętości roztworu ekstrahowanego.
Jest to proces, który zachodzi na granicy dwóch faz, dlatego celu zwiększenia efektywnej powierzchni zetknięcia się obu faz stosuje się wytrząsanie ekstrahowanej mieszaniny z rozpuszczalnikiem do ekstrakcji (ekstrahentem). Podczas doboru rozpuszczalnika do ekstrakcji bierze się pod uwagę dwa kryteria:
Rozpuszczalność substancji ekstrahowanej
Łatwość usunięcia rozpuszczalnika z ekstraktu
Najczęściej używane rozpuszczalniki to: eter dietylowy, benzen, toluen, chloroform, dichlorometan, eter naftowy.
Podczas wytrząsania rozdzielacz odwraca się nóżką do góry, jedną ręką trzymając za kran a drugą przytrzymując korek. Po odwróceniu rozdzielacza należy otworzyć kran w celu wyrównania ciśnień. Wytrząsa się i odpowietrza aż atmosfera w rozdzielaczu wysyci się parami rozpuszczalnika i ciśnienie nie będzie się zmieniać. Potem zawartość rozdzielacza energicznie wytrząsa się przez 1-2 minuty.
Następnie rozdzielacz umieszcza się w statywie celu rozdzielenia warstw pamiętając o wyciągnięciu korka. Warstwa organiczna w zależności od gęstości użytego ekstrahenta znajduje się w warstwie górnej albo dolnej.
Do fazy ekstrahującej podczas jednokrotnej ekstrakcji może przejść tylko taka ilość ekstrahowanej substancji, którą określa prawo podziału Nernsta i o której decyduje użyta ilość fazy ekstrahującej. Z tego powodu wytrząsanie należy na ogół powtarzać wielokrotnie. Kilkakrotne wytrząsanie z małą ilością rozpuszczalnika jest zawsze bardziej celowe niż jednokrotne od razu z całą jego ilością.
Aby zmniejszyć rozpuszczalność ekstrahowanej substancji w wodzie dodaje się substancji jonowej np. NaCl, co powoduje tzw. wysalanie do fazy organicznej.
Wyznaczanie stężenia roztworów na podstawie prawa Lamberta - Beera
Pochłanianie światła w rozcieńczonych roztworach substancji barwnych opisuje prawo Lamberta - Beera, które wiąże osłabienie natężenia przechodzącego strumienia światła z drogą optyczną wiązki, stężeniem i rodzajem substancji barwnej.
Stosunek natężenia promieniowania przepuszczonego I do padającego Io dla danej częstości nazywany jest transmitancją T próbki przy tej częstości:
![]()
Natężenie promieniowania przechodzącego przez próbkę zmienia się z długością drogi optycznej (grubości próbki, l) oraz stężeniem molowym substancji absorbującej, c, zgodnie z prawem Lamberta - Beera:
![]()
ε - molowy współczynnik absorpcji (współczynnik ekstynkcji) 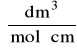
Molowy współczynnik absorpcji zależy od częstości promieniowania padającego i przyjmuje największe wartości dla tych częstości, przy których absorpcja jest najbardziej intensywna.
Absorbancja związana jest z transmitancją zależnością:
![]()
lub ![]()
Stąd prawo Lamberta - Beera może przyjąć postać:
A = ε c l
Sublimacja
Rys. 1.
Sublimacja i resublimacja to zjawiska przeciwstawne polegające na przechodzeniu substancji prostej z fazy stałej do gazowej i odwrotnie. Niektóre związki chemiczne pod ciśnieniem atmosferycznym nie występują w postaci cieczy w żadnej temperaturze. Wykresy fazowe tych substancji charakteryzują się punktem potrójnym leżącym powyżej ciśnienia 1 atmosfery (rysunek 1). Do substancji takich należy na przykład ditlenek węgla, który w warunkach normalnych jest gazem, ale w temperaturze -79°C resublimuje. Stały CO2 zwany jest suchym lodem.
Jod jest pierwiastkiem, który również sublimuje; w temperaturze pokojowej jest stały, a po ogrzaniu przechodzi w postać fioletowych par. Jod w postaci pary jest łatwo wchłaniany przez drogi oddechowe. W wodach morza Bałtyckiego zawartość soli jodkowych (NaI) jest dość duża. Jodki utleniają się do wolnego jodu pod wpływem ogrzewania przy dostępie tlenu, co ma miejsce na gorącym piasku plaży. Proces sublimacji i resublimacji jodu jest przedmiotem eksperymentu, który pozwala na izolację czystego jodu z mieszaniny.
Podobnie postępuje się w przypadku wielu związków chemicznych, np. pirazolu i jego pochodnych:
pirazol (R = H) i jego 3,5-dipochodne (np. R = CH3)
III. WYKONANIE ĆWICZENIA
1. Ekstrakcja pojedyncza
a). umieścić suchy i czysty rozdzielacz na statywie z pierścieniem
b). wlać do rozdzielacza przy użyciu lejka 15 cm3 roztworu wodnego barwnika i 25 cm3 chloroformu.
c). zamknąć rozdzielacz korkiem, przechylić nóżką do góry i podtrzymując korek od dołu otworzyć kran w celu wyrównania ciśnień
d). zamknąć kran i trzymając rozdzielacz w tej samej pozycji wstrząsnąć 2-3 razy i ponownie otworzyć kran
e). czynności wytrząsania i odpowietrzania powtarzać tyle razy, aż ciśnienie przestanie wzrastać podczas wytrząsania
f). energicznie wytrząsać przez minutę
g). umieścić rozdzielacz w pierścieniu, wyjąć korek i pozostawić w spokoju w celu rozdzielenia warstw
h). dolną warstwę chloroformową wypuścić do zlewki
2. Ekstrakcja wielokrotna
a). świeżą porcję wodnego roztworu barwnika ekstrahować kolejno pięcioma porcjami po 5 cm3 chloroformu
b). ekstrakty zbierać do ponumerowanych uprzednio zlewek
c). porównać intensywność zabarwienia w poszczególnych frakcjach
d). zlać wszystkie frakcje z ekstrakcji wielokrotnej i porównać zabarwienie z roztworem po ekstrakcji pojedynczej (wlać do cylindrów miarowych takie same objętości roztworów i porównać barwę patrząc na nie z góry)
3. Ekstrakcyjny rozdział jodu i chlorku niklowego
Do rozdzielacza wlać 20 cm3 wodnego roztworu jodu i chlorku niklawego oraz 5 cm3 chloroformu. Wytrząsać, rozdzielić warstwy. Warstwę wodną powtórnie wytrząsać z 5 cm3 chloroformu. Na szkiełko zegarkowe pobrać kilka kropel warstwy wodnej i przeprowadzić reakcję charakterystyczną skrobi z jodem. Stwierdzić, w której warstwie następuje koncentracja jodu. Na podstawie otrzymanego wyniku określić, czy współczynnik podziału K dla jodu i chlorku niklawego jest większy czy mniejszy od jedności.
4. Sublimacja jodu z mieszaniny jod- krzemionka
W zlewce o pojemności 250 cm3 umieścić na dnie zlewki cienką warstwą mieszaninę jodu z
piaskiem. Na krawędzi zlewki postawić kolbę okrągłodenną napełnioną zimna wodą. Umieścić zestaw na trójnogu nakrytym siatką izolującą zlewkę od płomienia palnika. Delikatnie ogrzewać zawartość zlewki.
Procesowi sublimacji będzie towarzyszyć pojawianie się fioletowych par jodu a na zewnętrznej powierzchni kolbki pojawią się igły resublimowanego czystego jodu.
OPRACOWANIE WYNIKÓW
Wyniki opracować zgodnie ze wzorem sprawozdania i wytycznymi prowadzącego.
Literatura:
Artur I. Vogel, Preparatyka organiczna, WNT, Warszawa 1984.
Bolesław Pochwic, Preparatyka organiczna, PWN, Warszawa 1978.
A. Rokosz, Ćwiczenia z chemii ogólnej i nieorganicznej, PWN, Warszawa 1974.
6
6
Wyszukiwarka
Podobne podstrony:
7981
7981
7981
7981
7981
7981
7981
7981
praca-magisterska-wa-c-7981, Dokumenty(2)
7981
7981
09 PODSTAWY PRAWNE FUNKCJONOWANIA ZOZid 7981 pptx
więcej podobnych podstron