Sobiesław Torliński 6.04.2002
Ćwiczenie 7
WPŁYW SIŁY JONOWEJ ROZTWORU NA STAŁĄ DYSOCJACJI
SŁABEGO KWASU WYZNACZONĄ Z POMIARÓW SEM OGNIW
Wstęp teoretyczny:
Pomiary średnich współczynników aktywności elektrolitów wykazały, że ich wartości zależą nie tylko od stężenia danego elektrolitu, ale, co ważniejsze, od stężenia wszystkich pozostałych jonów w roztworze. Dla uwzględnienia tego faktu, Lewis i Randall (1916), wprowadzili pojęcie tzw. siły jonowej roztworu I, zdefiniowanej za pomocą równania:
![]()
w którym: ci oraz zi oznaczają stężenie oraz wartościowość i - tego jonu (i). Tak określona siła jonowa roztworu elektrolitu uzyskała później (1923) teoretyczne uzasadnienie w teorii mocnych elektrolitów Debye'a - Hückela i okazała się rzeczywistą miarą oddziaływania jonów danego elektrolitu z pozostałymi jonami roztworu. Celowość posługiwania się siłą jonową roztworu unaoczniła się jeszcze bardziej po stwierdzeniu (teoria mocnych elektrolitów Debye'a - Hückela), że w roztworach rozcieńczonych, współczynniki aktywności danego elektrolitu są takie same we wszystkich roztworach o tej samej sile jonowej.
Należy ponadto zwrócić uwagę na fakt, że współczynniki aktywności poszczególnych jonów są, jak dotąd, wielkościami obliczeniowymi. Z pomiarów współczynników aktywności otrzymuje się średnią aktywność danego elektrolitu.
Teoretycznego obliczenia współczynników aktywności dokonali w roku 1923 Debye i Hückel. Obliczenia swoje oparli na tzw. modelu chmury elektronowej, który znalazł szerokie zastosowanie w późniejszych teoriach roztworów elektrolitów i ich właściwości.
W modelu chmury jonowej zakłada się, że dowolny jon roztworu elektrolitu, zwany jonem centralnym, otacza się chmurą jonów, której wypadkowy ładunek jest równy co do wielkości ładunkowi jonu centralnego ale ma przeciwny znak. Temu porządkującemu działaniu pola elektrycznego, pochodzącego od jonu centralnego, przeciwdziała ruch cieplny dążący do równomiernego, bezładnego rozmieszczenia jonów. Debye i Hückel, w oparciu o model chmury jonowej i przy uwzględnieniu jedynie oddziaływań elektrostatycznych pomiędzy jonami (a więc zaniedbując oddziaływanie pomiędzy jonami a cząsteczkami rozpuszczalnika), dowiedli, że średni współczynnik aktywności ![]()
elektrolitu, dysocjującego na jony o wartościowościach z+ i z-, wyraża się za pomocą równania:
![]()
Równanie to zwane granicznym prawem Debye'a - Hückela, umożliwia obliczenie średnich współczynników aktywności elektrolitów w roztworach o stężeniach nie wyższych od 0,01 M.
Na wartość potencjału dyfuzyjnego na granicy zetknięcia dwóch roztworów elektrolitów, wywierają wpływ dwa czynniki: stosunek aktywności elektrolitu po obydwu stronach membrany oraz różnica w liczbach przenoszenia anionu i kationu.
Korzystając z tego, że liczby przenoszenia elektrolitu można wyrazić za pomocą ruchliwości:
![]()
otrzymujemy uproszczoną postać tzw. równania Hendersona na potencjał dyfuzyjny na granicy zetknięcia się dwóch roztworów tego samego elektrolitu o różnych stężeniach:
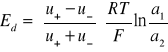
Literatura:
„Chemia fizyczna” - L. Sobczyk, A. Kisza, PWN W - wa, 1977
„Chemia fizyczna” - K. Pigoń, Z. Ruziewicz, PWN W - wa, 1980
Wykaz substancji chemicznych stosowanych w zadaniu:
chinhydron
roztwór kwasu octowego
roztwór kwasu chlorooctowego
roztwór kwasu mrówkowego
roztwór wodorotlenku sodowego
Oświadczenie:
Oświadczam, że zapoznałem się z kartami charakterystyk wyżej wymienionych substancji
i znane mi są właściwości tych substancji, sposoby bezpiecznego postępowania z nimi oraz zasady udzielania pierwszej pomocy w nagłych wypadkach.
Wyszukiwarka
Podobne podstrony:
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
chemia fizyczna-ćwiczenie 22, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Kolokwium nr 2, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Chemia fizyczna 05, chemia fizyczna, chemia, FIZYCZNA, 5, Ćwiczenie 05
Chemia fizyczna 03, chemia fizyczna, chemia, FIZYCZNA, 3, Ćwiczenie 03
Chemia fizyczna 04, chemia fizyczna, chemia, FIZYCZNA, 4, Ćwiczenie 04
chemia fizyczna-ćwiczenie 13, chemia w nauce i gospodarce Uł, semestr V, sprawozdania chemia fizyczn
oddziaływania, Studia, Chemia, fizyczna, ćwiczenia
ĆWICZENIE 5 I 6 CHEMIA FIZYCZNA, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
fala świetlna-cechy, Studia, Chemia, fizyczna, ćwiczenia
ĆWICZENIE 13 I 14, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
napięcie powierzchniowe, Studia, Chemia, fizyczna, ćwiczenia
Przykl Zad Koll 3-cie sem3 HD CD 2010, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium
więcej podobnych podstron