Robert Maniura
Sprawozdanie z ćwiczenia nr B-7: Skręcalność optyczna.
1. Wstęp teoretyczny:
Pod pojęciem aktywności optycznej rozumiemy zazwyczaj zjawisko skręcania płaszczyzny światła spolaryzowanego liniowo. Zdolność do skręcania płaszczyzny polaryzacji mają związki o ściśle określonym rozkładzie przestrzennym atomów. W przypadku kryształów skręcalność optyczna jest wynikiem śrubowego rozkładu atomów. Kwarc np. może być lewo lub prawoskrętny w zależności od skrętu spirali w komórce elementarnej. Ze spiralną strukturą związana jest także aktywność optyczna układów polipeptydowych. Bardziej interesująca jest jednak aktywność optyczna wynikająca z rozkładu atomów w pojedynczych cząsteczkach. Zdolność do skręcania płaszczyzny polaryzacji wykazuje wiele związków chemicznych w postaci cieczy oraz roztworów co dowodzi, że rozpatrywana właściwość fizyczna tkwi w samych cząsteczkach. Ogólnie można powiedzieć, że dyskusję aktywności optycznej cząsteczek można sprowadzić do zagadnienia warunków symetrii. Zjawisko aktywności optycznej obserwuje się tylko wtedy, gdy cząsteczki nie mają płaszczyzn symetrii, ale pozbawione są równocześnie środka symetrii lub przemiennych osi symetrii. Warunki te sprowadzają się do kryterium istnienia danej substancji w postaci dwóch form, które będąc odbiciami zwierciadlanymi nie dadzą się jednak na siebie nałożyć.
Najczęstszym przypadkiem związków optycznie aktywnych są pochodne zawierające asymetryczne atomy węgla (cztery różne podstawniki wokół danego atomu).W przypadku jednego asymetrycznego atomu węgla związek jest zawsze optycznie aktywny. Efektywność skręcalności wyrażona np. skręcalnością właściwą jest zależna od zróżnicowania polaryzowalności podstawników, ale nawet w przypadku podstawienia izotopowego wykrywalna jest aktywność optyczna.
Jeżeli cząsteczka zawiera więcej niż jeden asymetryczny atom węgla to może ona, ale nie musi, wykazywać aktywność optyczną. Związki o dwu lub większej liczbie ośrodków asymetrii mogą być optycznie nieaktywne, jeżeli asymetryczne ugrupowania atomów są parami identyczne i rozmieszczone względem siebie jak odbicie zwierciadlane. Jest to bowiem jednoznaczne z pojawieniem się płaszczyzny symetrii. Ogólnie związek z dwoma asymetrycznymi atomami węgla może występować w czterech stereoizomerach. Jest to ich maksymalna liczba. Dla n ośrodków asymetrii maksymalna liczba stereoizomerów wynosi 2n.
Prócz węgla, wiele innych atomów stanowić może centrum asymetrii, a więc Si, Ge czterowiązalny N (w solach czwartorzędowych i N-tlenkach), niektóre metale Cu, Pt i Pd, które tworzą tetraedryczne związki koordynacyjne. Znane są także aktywne optycznie związki piramidalne azotu, o ile zahamowana jest inwersja (przeskok atomu azotu z wolną parą elektronową przez podstawę płaszczyzny piramidy - efekt parasolowy), a także arsenu, fosforu, antymonu oraz siarki (sulfotlenki).
Znaczną grupę związków optycznie aktywnych stanowią dyssymetryczne układy atomów tworzących prostopadle do siebie płaszczyzny w rodzaju pochodnych bifenyli z zahamowaną rotacją, spirany, czy wreszcie alleny. Na koniec trzeba wymienić związki zawierające odpowiednio podstawione atomy o konfiguracji oktaedrycznej. Znanych jest wiele metali, które tworzą związki o sześciu centrach koordynacji. Najłatwiej uzyskać jest optycznie aktywne związki kompleksowe z ligandami dwukleszczowymi. Wśród innych ciekawych związków dyssymetrycznych warto zwrócić uwagę na te, które mają strukturę śrubową (np. heksahelicen, spiralne makrocząsteczki).
Skręcalność optycznie czynnej substancji jest zależna od długości fali spolaryzowanego światła. Zależność tę nazywamy dyspersją skręcalności optycznej. W zakresach widma dostatecznie odległych od pasm absorbcji elektronowej substancji, dyspersję skręcalności optycznej opisuje równanie:
![]()
W równaniu tym λ jest długością fali światła przechodzącego przez substancję, λoi - długością fali odpowiadającą maksimum i - tego aktywnego pasma absorpcyjnego badanej substancji, Ki zaś - stałą charakterystyczną dla tego pasma. W najprostszych przypadkach wystarcza uwzględnić wpływ jednego tylko pasma absorbcji, przez co wzór poprzedni upraszcza się do postaci podanej przez P. Drudego:
![]()
Opracowanie wyników:
Skręcalność właściwą obliczam z zależności:
![]()
gdzie: c - stężenie roztworu sacharozy wyrażone w [g/cm3], c = 30 [g/cm3]; d - grubość próbki w [dm], d = 2 [dm]; - średni kąt skręcania płaszczyzny.
[nm] |
2 |
1 [0] |
2 [0] |
3 [0] |
4 [0] |
5 [0] |
śr. [0] |
Skręcalność właściwa |
1/ |
550 |
302500 |
52,9 |
53 |
52,95 |
52,93 |
53,05 |
52,97 |
88,28 |
1,133 |
560 |
313600 |
51,7 |
51,75 |
51,66 |
51,72 |
51,7 |
51,71 |
86,18 |
1,160 |
570 |
324900 |
49,2 |
49,3 |
49,22 |
49,3 |
49,25 |
49,25 |
82,09 |
1,218 |
580 |
336400 |
47,12 |
47,15 |
47,13 |
47,02 |
47,05 |
47,09 |
78,49 |
1,274 |
590 |
348100 |
45,35 |
45,4 |
45,3 |
45,32 |
45,38 |
45,35 |
75,58 |
1,323 |
600 |
360000 |
43,9 |
43,95 |
43,91 |
43,94 |
43,9 |
43,92 |
73,20 |
1,366 |
610 |
372100 |
42,22 |
42,3 |
42,25 |
42,31 |
42,27 |
42,27 |
70,45 |
1,419 |
620 |
384400 |
41,15 |
41,2 |
41,17 |
41,14 |
41,19 |
41,17 |
68,62 |
1,457 |
630 |
396900 |
40,49 |
40,55 |
40,5 |
40,53 |
40,58 |
40,53 |
67,55 |
1,480 |
640 |
409600 |
39,36 |
39,4 |
39,38 |
39,35 |
39,43 |
39,38 |
65,64 |
1,523 |
650 |
422500 |
38,65 |
38,6 |
38,61 |
38,63 |
38,7 |
38,64 |
64,40 |
1,553 |
W tabeli powyżej zamieszczono wartości skręcalności właściwej dla kolejnych wartości , oraz wielkości występujące w równaniu Drudego:
![]()
(gdzie: 0 i k są stałymi charakterystycznymi dla danej substancji i noszą odpowiednio nazwę stałej dyspersji i stałej skręcalności)
które przedstawiamy w postaci:
![]()
lub
![]()
gdzie: ![]()
; ![]()
Do sprawdzenia tej zależności sporządzamy wykres odwrotności skręcalności właściwej od kwadratu długości fali. Stałe A i B określamy metodą najmniejszych kwadratów (współczynniki regresji liniowej) i wynoszą one:
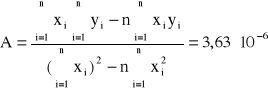
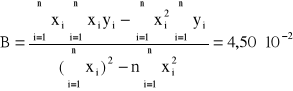
Błędy regresji liniowej:
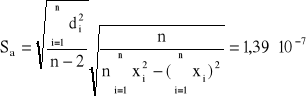

Stałe A i B wynoszą odpowiednio: A = 3,63*10-6, B = 4,50*10-2. Z założeń ![]()
; ![]()
obliczyć można k i 0 i wynoszą one odpowiednio: k = 2,75*105, 0 = 111,24 [nm].
3. Wnioski:
Sacharoza w obszarze dalekim od pasma absorbcyjnego, które leży w nadfiolecie, bardzo dobrze spełnia równanie Drudego. Analizując wyniki pomiaru przedstawione na wykresie możemy stwierdzić, że zależność odwrotności kąta skręcenia roztworu sacharozy od kwadratu długości fali jest zależnością liniową. Zatem wnioskujemy, że wzrost długości fali niesie za sobą zmniejszenie kąta skręcalności roztworu sacharozy.
4. Literatura:
L. Sobczyk, A. Kisza, K. Gatner, A. Koll - Eksperymentalna chemia fizyczna.
3
Wyszukiwarka
Podobne podstrony:
Pomiary gwintów metodami optycznymi, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 3
Wzmacniacze optyczne, Studia, sprawozdania, sprawozdania od cewki 2, Dok 2, Dok 2, POLITECHNIKA LUBE
Prawo inżynierskie i ochrona własności intelektualnych. Wykład 3, Studia, Politechnika Łódzka - Pend
Testy biodegradacji, Studia, Politechnika
Chf9, Studia, Politechnika
Wyznaczanie stałej reakcji szybkości zmydlania estru, Studia, Politechnika
CH.F.L9, Studia, Politechnika
ZAKAAD CHEMI FIZYCZNEJ, Studia, Politechnika
C15, Studia, Politechnika
podstawowe informacje o ochronie prawnej wzorów przemysłowych, Studia - Politechnika Śląska, Zarządz
Sprawko spawalnictwo 1, studia, studia Politechnika Poznańska - BMiZ - Mechatronika, 2 semestr, obro
dziadek25, Studia, Politechnika
4 2 vademecum echosondy (w tym przykładzie wodnej), studia, studia Politechnika Poznańska - BMiZ - M
LABORKA7, Studia, Politechnika
Wyznaczanie stopnia asocjacji kwasu octowego w rozpuszczalni, Studia, Politechnika
deacon1, Studia, Politechnika
Destylacja wojtek, Studia Politechnika Poznańska, Semestr I, Chemia, Chemia laboratoria, Destylacja
Liczby przenoszenia jonów, Studia, Politechnika
103, Studia Politechnika Poznańska, Semestr II, I pracownia fizyczna, LABORKI WSZYSTKIE, FIZYKA 2, F
więcej podobnych podstron