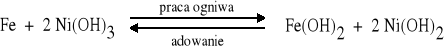Klucz elektrolityczny |
przewodnik jonowy łączący elektrolity i umożliwiający przepływ prądu. [ | - granice faz; || - klucz elektrolityczny] |
|
|
Anoda |
|
|
|
Potencjał półogniwa |
|
SEM |
|
Wzór Nernsta |
|
Półogniwa I rodzaju |
|
|
|
||
1. Półogniwo cynkowe |
Zn / Zn2+ |
Zn = Zn2+ + 2 e |
2. Półogniwo miedziowe |
Cu / Cu2+ |
Cu = Cu2+ + 2 e |
3. Półogniwo wodorowe |
Pt, H2 (g) / H+ aq |
H2 = 2 H+ + 2 e |
|
Zbudowane z platynowej płytki pokrytej rozdrobnioną platyną czyli tzw. czernią platynową; zanurzoną w 1 M kwasie solnym i opłukiwana gazowym wodorem, wprowadzonym do układu pod ciśnieniem 1013 hPa. |
|
4. Półogniwo chlorowe |
Pt, Cl2 / Cl- |
Cl2 + 2 e = 2 Cl- |
Półogniwa II rodzaju |
|
|||
|
||||
1. Półogniwo chlorosrebrowe |
Ag, AgCl / Cl- |
Ag + Cl- = AgCl + e |
||
2. Półogniwo kalomelowe |
Hg, Hg2Cl2 / Cl- |
2 Hg + 2 Cl- = Hg2Cl2 + 2 e |
||
|
|
|||
Półogniwa III rodzaju (tzw. redox) |
|
|||
|
||||
1. Półogniwo |
Pt / Fe3+ , Fe2+ |
Fe3+ + e = Fe2+ |
||
2. Półogniwo |
Pt / MnO4-, Mn2+, H+ |
MnO4- + 8 H+ + 5 e = Mn2+ + H2O |
||
|
|
|
||
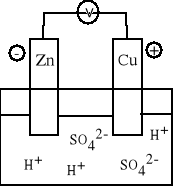
A (-) Zn | roztwór H2SO4 | Cu (+) K Anoda: Zn = Zn2+ + 2e Katoda: 2 H+ + 2e = H2 Zn + H2SO4 = ZnSO4 + H2 Zn + 2 H+ = Zn2+ + H2 |
|
Ogniwo to składa się z zanurzonych w roztworze kwasu siarkowego (VI) płytek cynkowej i miedzianej połączonych metalicznym przewodnikiem. Na powierzchni obu zanurzonych w cieczy płytek wydziela się wodór. Do roztworu przechodzą kationy cynku, elektrony zaś przewodnikiem płyną ku płytce miedzianej, na której powierzchni zachodzi redukcja kationów wodorowych. Jest ogniwem nieodwracalnym. W ogniwie zachodzą procesy niezależnie czy układ jest zamknięty czy otwarty. |
|
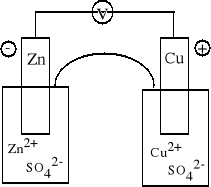
A (-) Zn | Zn2+ || Cu2+ | Cu (+) K
Anoda: Zn = Zn2+ + 2e Katoda:
Cu2+ + 2e = Cu Zn + Cu2+ = Cu + Zn2+ |
|
Ogniwo odwracalne. Przed zamknięciem obwodu nie zachodzi żadna reakcja chemiczna, ustala się jedynie równowaga dynamiczna w półogniwach tworzących ogniwo.
|
|
A (-) Zn | Zn2+ || H+ | H2, Pt (+) K |
A (-) Pt, H2 | H+ || Cu2+ | Cu (+) K |
|
Anoda: Zn = Zn2+ + 2 e Katoda: 2 H+ + 2 e = H2 Ogólnie: Zn + 2 H+ + 2 e = Zn2+ + H2 + 2 e |
Anoda: H2 = 2 H+ + 2 e Katoda: Cu2+ + 2 e = Cu Ogólnie: Cu2+ + H2 + 2 e = Cu + 2 H+ + 2 e |
|
A (-) Pb | Pb2+ || Cu2+ | Cu (+) K |
||
Anoda: Pb = Pb2+ + 2 e |
Katoda: Cu2+ + 2 e = Cu |
|
Ogólnie: Pb + Cu2+ + 2 e = Cu + Pb2+ + 2 e |
||
A (-) Zn | roztwór ZnCl2 ,NH4Cl | MnO2, C (grafit) (+) K |
|
Stosowane do zasilania przenośnych urządzeń elektrycznych i elektronicznych: latarek; aparatów słuchowych, kalkulatorów. |
|
Anoda: Zn = Zn2+ + 2 e |
Katoda: Mn+IV + 2 e = Mn+II |
Ogólnie: Zn + 2 NH4Cl + 2 MnO2 = [Zn(NH3)2]Cl2 + Mn2O3 + H2O |
|
Akumulator ołowiowy (kwasowy) A (-) Pb | roztwór H2SO4 | PbO2, Pb (+) K |
|
Elektrodami są płyty ołowiowe pokryte gąbczastym ołowiem stanowiące anodę oraz płyty ołowiane pokryte warstwą tlenku ołowiu (IV), będące katodą. Płyty te zanurzone są w roztworze kwasu siarkowego (VI) - 37%. |
|
Anoda: Pb + SO42- = PbSO4 + 2e |
Katoda: PbO2 + 4 H+ + SO42- + 2e = PbSO4 + 2 H2O |
Rozładowanie akumulatora (proces samorzutny zachodzący podczas pracy akumulatora) Pb + 2 SO42- + PbO2 + 4 H+ = 2 PbSO4 + 2 H2O Ładowanie akumulatora (regeneracja akumulatora - proces wymuszony przez zewnętrzne źródło prądu) 2 PbSO4 + 2 H2O = Pb + 2 SO42- + PbO2 + 4 H+ Ogólnie:
|
|
Akumulator Edisona (alkaliczny) A (-) Fe, Fe(OH)2 | roztwór KOH | Ni(OH)2, Ni(OH)3, Ni (+) K
|
|
Anodę stanowi żelazo, katodę mieszanina niklu i jego stałych związków. Elektrolitem jest 20% wodny roztwór wodorotlenku potasu. |
|
Anoda: Fe + 2 OH- = Fe(OH)2 + 2e |
Katoda: 2 Ni(OH)3 + 2e = 2 Ni(OH)2 + 2 OH- |
Ogólnie:
|
|
Wyszukiwarka
Podobne podstrony:
zelazo chrom mangan, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
reakcje w roztworach maturalne, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
miedź, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
CHEMIA NIEORGANICZNA, Nauka, chemia(1)
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
chemia10, NAUKA, chemia, lab
Opis(11), Nauka, Chemia
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
CHEMIA KOSMETYCZNA Chemia nieorganiczna (tlenki, kwasy, sole
Chemia nieorganiczna egzamin
Chemia nieorganiczna sciaga
iloczynrozw, ~ NOTATKI, przedmioty obowiązkowe I rok, Chemia Nieorganiczna, Kolokwia
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
więcej podobnych podstron