CHEMIA NIEORGANICZNA- zajmuje się wszystkimi pierwiastkami, ich powstawaniem, zastosowaniem, reakcjami, parametrami, które decydują o przebiegu tych reakcji.
Skorupa ziemska w 92% zbudowana jest z 8 pierwiastków:
- O- 47%
- Si- 27%
- Al.- 8%
- Fe- 5%
- Ca- 3,5%
- Na- 2,7%
- K- 2,5%
- Mg- 2%
Pierwiastki, które mogą występować w stanie wolnym to O2, N2, S, Au
C- węgiel- tworzy nieliczne związki nieorganiczne, takie jak: tlenki węgla, kwas węglowy H2CO3, związek węgla z N (azot) i S (siarka). Związki organiczne to związki C z wodorem oraz ich pochodne.
11H- WODÓR
Jest to pierwiastek najbardziej rozpowszechniony we wszechświecie. H na ogół występuje w związkach chemicznych. Tworzy więcej związków chemicznych niż każdy inny pierwiastek. W stanie wolnym występuje jako H2
Izotopy:
11H- zwykły (prot)
21H- deuter
31H- tryt
Wodór jest najlżejszym z gazów i jest najlepszym przewodnikiem ciepła ze znanych gazów.
Jest niezbyt aktywny chemicznie. Może istnieć jako gaz palny o silnych właściwościach redukujących:
2H+O (dwie objętości wodoru i jedna obj.tlenu)
Jest to tzw. mieszanina piorunująca- niebezpieczna, gdy mieszaninę H i O zainicjujemy tą reakcją i ogrzejemy ją do 450°C. jest to reakcja wybuchowa. Można ja też zainicjować poprzez iskrę elektryczną lub przez zetkniecie z płomieniem.
H2- WODÓR CZĄSTECZKOWY- w pewnych warunkach ulega dysocjacji termicznej, (czyli rozpadowi chemicznemu pod wpływem temperatury na inne substancje proste lub złożone, zawsze są to cząsteczki, nigdy jony)
Wodór ogrzany od 3000°C do 4000°C ulega dysocjacji termicznej na wodór atomowy.
H2↔(3000÷4000°C) 2H
Jest to reakcja odwracalna. 2H jest nietrwały. Procesem odwrotnym jest tu proces egzotermiczny, (czyli proces związany z wydzieleniem ciepła).
Wodór służy do topienia bądź cięcia metali. WODÓR ATOMOWY jest bardziej aktywny niż wodór cząsteczkowy.
WODORKI- są to połączenia wodoru z innymi pierwiastkami. W zależności od elektroujemności wyróżniamy trzy grupy wodorków:
- wodorki jonowe (solopodobne)- są to połączenia H z litowcami i cięższymi berylowcami (Ca, Sr, Ba). Są to ciała stałe, krystaliczne, barwy białej, siec jonowa. W stanie stopionym przewodzą prąd elektryczny. Zawierają jon wodorkowy H-. w reakcji z H2O wydzielają wolny wodór H2.
- wodorki kowalencyjne (cząsteczkowe)- są to połączenia wodoru z pierwiastkami grupy 14÷17 układu okresowego oraz z B (bor). Są to często gazy lub łatwo lotne ciecze. Nie przewodzą prądu elektrycznego (wiązania kowalencyjne), mają zróżnicowane właściwości (np. NH3 jest zasadą, a HCl kwasem). Najtrwalsze są połączenia z pierwiastkami z II okresu. Najważniejsze: H2O, H2S, HF, NH3.
- metaliczne (międzywęzłowe)- są to połączenia wodoru z pierwiastkami bloku d oraz Be i Mg. Mają zazwyczaj zmienny skład- wodorki niestechiometryczne PtH2,7
- pośrednie- wodór z pierwiastkami bloku f. Mają właściwości pośrednie między wodorkami jonowymi a metalicznymi LaH2,76
METODY OTRZYMYWANIA WODORU
- na skalę laboratoryjną
Aktywne metale z H2O
np. 2Na + 2H2O = H2 + 2 NaOH
Metale nieszlachetne z mocnym kwasem
np. Zn + 2HCl = ZnCl2 + H2
Elektroliza wody (może być również stosowana na skalę przemysłową)
2H2O↔ 2H2↑ + O2↑
Np. Al., Zn- metale wykazujące właściwości niemetali (tzn. mogące reagować z mocnymi kwasami bądź mocnymi zasadami) z mocnymi wodorotlenkami
- na skalę przemysłową
Z gazu wodnego
C + H2O = CO + H2
H2 + CO + H2O = CO2 + 2H2
Z gazu ziemnego
CH4 + H2O = CO + 3H2
CH4 + 2H2O = CO2 + 4H2
CO + H2O = CO2 + H2
Prosta poprowadzona od B (bor) do At (astat) oddziela- poniżej metale, powyżej- niemetale; ma prostej - półmetale
.
CECHY METALI:
- w kryształach występuje wiązanie metaliczne (występują jony dodatnie- tzw. rdzenie atomowe [jonowe]). Zajmują węzły w sieci przestrzennej kryształu, a pozostałą przestrzeń wypełnia chmura bardzo ruchliwych elektronów- gaz elektronowy. Wiązanie metaliczne tworzy trwałą strukturę, ale nie jest ono tak sztywne jak w diamencie. Wiązania charakteryzują się ścisłym upakowaniem atomów.
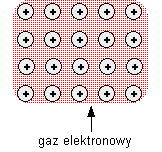
WIĄZANIE METALICZNE, występuje w dwóch układach:
Układ regularny, który dzieli się na:
- sieć (A1)- w której atomy sytuują się w rogach, na podstawie górnej i dolnej oraz na ścianach..
- sieć (A2)- przestrzennie (wewnętrznie) centrowana, atomy występują w rogach oraz jeden atom znajduje się w środku.
Układ heksagonalny- w układzie tym podstawą jest sześcian, wewnątrz są trzy atomy, które są ułożone w trójkąt.
- w temperaturze pokojowej metale są ciałami stałymi z wyjątkiem Hg (rtęć)
- metale maja połysk metaliczny i gładką powierzchnię. Mają także duży współczynnik odbijania światła. Pary metali są zazwyczaj jednoatomowe.
- metale są ciągliwe (można je wyciągnąć w postaci drutu) i kowalne (można im nadawać różne kształty).
- są dobrymi przewodnikami ciepła i prądu. Temperatura ich topnienia jest wysoka. Wysoko topliwym metalem jest Mo (molibden) i W (wolfram).
- twardość metali:
Litowce są miękkie (można je kroić nożem )
Chrom jest bardzo twardy (jak diament)
- każdy metal ma określona gęstość:
ρ<5g/cm3 to są metale lekkie
ρ>5g/cm3 to są metale ciężkie
najlżejszy jest Li (lit), najcięższy Os (osm)
- metale na ogół tworzą tlenki. Metale mogą tworzyć tlenki o charakterze zasadowym (Na2O); amfoterycznym (Zn); kwasowym.
- metale tworzą stopy (stopy mają lepszą odporność mechaniczną i chemiczne niż metale); np. wyroby jubilerskie.
WŁAŚCIWOŚCI CHEMICZNE METALI:
- zdolność do oddawania elektronów i przechodzenia w jony dodatnie, czyli wykazują charakter elektrododatni. Metale różnią się między sobą charakterem elektrododatnim i tutaj istotne znaczenie ma wartość energii jonizacji (jest to energia potrzebna do oderwania elektronu z obojętnego atomu metalu). Im mniejsza wartość tej energii, tym łatwiej następuje oderwanie elektronu od atomu, tym silniejszy charakter elektrododatni ma metal i mówimy, że jest tym bardziej aktywny.
Najprostszą metodą mierzenia aktywności metali jest zdolność wypierania jednego metalu z roztworu jego soli przez inny metal. Gdybyśmy np. wzięli roztwór siarczanu miedzi (CuSO4) i wrzucili do niego kawałki cynku (Zn), to po pewnym czasie te kawałki pokryłyby się nalotem metalicznej miedzi. Zaszedł proces:
Cu+2SO4 + Zn0 = Cu0 + Zn+2SO4
Cu+2 + 2e- = Cu0
Zn0 - 2e- = Zn+2
Z tego procesu widać, że Zn, chętniej od miedzi, chce być jonem niż obojętnym atomem. Stąd wynika, że Zn jest bardziej aktywny niż Cu, czyli ma silniejszy charakter elektrododatni. Badając w ten sposób różne pary metali stworzono SZEREG AKTYWNOŚCI METALI:
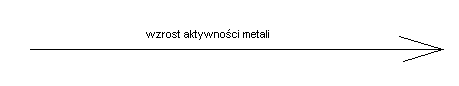
Li K Ca Mg Al Mn Zn Fe Cd Co Ni Sn Pb H2 Cu Hg Ag Au Pt
H2 - standardowy potencjał = 0
Szereg aktywności metali jest uproszczoną formą szeregu napięciowego metali. W szeregu napięciowym pierwiastki są uszeregowane w kolejności rosnących standardowych potencjałów elektrodowych. Część metali wykazuje ujemne, a część dodatnie potencjały standardowe.
- potencjał elektrodowy:
Jeżeli włożymy metal do roztworu jego soli, to na granicy faz metal- roztwór tworzą się skoki potencjałów (jest to tzw. potencjał elektrochemiczny). Wynika to z dążności metali do przechodzenia do roztworu w postaci jonów.
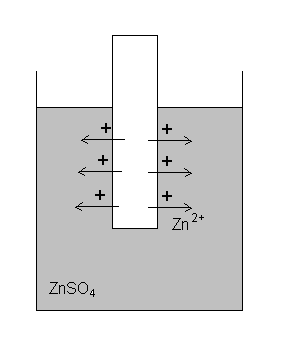
Część atomów cynku z tej płytki przejdzie do roztworu w postaci dwudodatnich jonów, zachodzi proces
Zn - 2e- → Zn2+
W wyniku tego procesu płytka cynkowa ładuje się ujemnie (pozostaje na niej nadmiar elektronów), a wokół niej gromadzi się warstwa ładunków dodatnich.
Nie udało się doświadczalnie zmierzyć potencjału elektrochemicznego pojedynczej elektrody. Można tylko zmierzyć różnice między dwoma elektrodami. Żeby zmierzyć potencjał takiej pojedynczej elektrody trzeba było przyjąć jakąś elektrodę wzorcową (standardową). Jako tę elektrodę przyjęto normalną elektrodę wodorową, której potencjał założono równy 0.
1. WŁAŚCIOWŚCI SZEREGU AKTYWNOŚCI METALI
NA LEWO OD WODORU |
NA PRAWO OD WODORU |
Mają ujemne potencjały elektrochemiczne |
Mają dodatnie potencjały elektrochemiczne |
Są to metale nieszlachetne |
Są to metale szlachetne i półszlachetne |
Wypierają wodór z kwasów, a te najbardziej aktywne, czyli na początku szeregu, wypierają nawet wodór z H2O
Zn + 2HCl→ ZnCl2 + H2↑
Na + H2O → NaOH + H2↑ |
Reagują tylko z mocnymi kwasami i utleniającymi, nie wypierają wodoru z kwasów, tylko tworzą odpowiednie połączenia tlenowe.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O |
2. W miarę malejącej aktywności obserwujemy zmniejszanie się następujących właściwości:
zdolności do oddawania elektronów (charakteru elektrododatniego)
trwałości jonów
zdolności przyłączania tlenu
charakteru zasadowego tlenków
mocy wodorotlenków
Al., Zn, Sn, Pb wykazują pewne cechy niemetali, wykazują charakter amfoteryczny, wykazują pewne cechy wspólne:
mogą występować w postaci prostych kationów, ale mogą też wchodzić w skład złożonych anionów, np. Zn2+- prosty kation; ZnO22—złożony anion.
Wodorotlenki tych metali wykazują charakter amfoteryczny
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Zn(OH)2 + NaOH → Na2ZnO2 + H2O
W obu przypadkach zachodzi reakcja zobojętnienia.
Sole metali o charakterze amfoterycznym ulegają hydrolizie.
OGÓLNE METODY OTRZYMYWANIA METALI
Metale występują w przyrodzie w postaci minerałów (rud lub kruszców). W przyrodzie nigdy nie mamy do czynienia z czystą rudą, czyli zawierającą 100% czystego składnika. Zawsze rudom towarzyszą pewne zanieczyszczenia i noszą one nazwę ZŁOŻE. Im więcej tego złoża tym mniej opłacalna jest przeróbka rudy w kierunku uzyskania czystego metalu. Stąd oczywiście są próby tzw. wzbogacania rudy. Proces polega na usuwaniu zanieczyszczeń. Jedną z popularnych metod wzbogacania rud jest FLOTACJA. W tym procesie wykorzystuje się różnicę w zwilżalności wodą składników rudy. Kruszy się ją i mieli na drobne kawałki; następnie miesza z wodą zawierającą środek pianotwórczy (np. olej sosnowy). Przez powstałą gęstą masę płynną przepuszcza się pod ciśnieniem powietrze (do dołu). W wyniku tego procesu pierwiastek zbiera się na powierzchni w postaci piany, a złoże (zanieczyszczenie) gromadzi się na dole. Pianę się zbiera, osusza, otrzymując w ten sposób rudę wzbogaconą we właściwy składnik. Wzbogaconą rudę poddaje się PROCESOWI METALURGICZNEMU.
Metale w przyrodzie występują albo w stanie rodzimym jako wolny metal (metale szlachetne), albo w postaci związków chemicznych (metale nieszlachetne)' jako związki; np. rudy: siarczanowe, siarczkowe, tlenkowe, węglanowe, chlorkowe.
Istnieje bardzo wiele metod otrzymywania metali. Większość otrzymuje się za pomocą flotacji na drodze:
REDUKCJI
Jest to proces, który stosujemy do otrzymywania metali chemicznie mało aktywnych (cyna, ołów, nikiel, cynk, miedź). Składa się on z dwóch etapów:
I. Sprowadza się do przeprowadzenia rudy metalu w tlenek metalu.
Proces przebiega w sposób najbardziej uproszczony, gdy głównym składnikiem rudy jest węglan. Wystarczy ogrzać rudę węglanową do odpowiedniej temperatury i węglan ulega rozkładowi do tlenku metalu i dwutlenku węgla, np. węglan cynku
ZnCO3 →temp.→ ZnO + CO2
Jeżeli głównym składnikiem rudy jest siarczek jakiegoś metalu, aby przeprowadzić siarczek w tlenek prażymy tę rudę siarkową tlenem:
2ZnS + 3O2→ 2ZnO + 2SO2
II. Redukcja tlenku metalu do wolnego metalu. Najczęściej stosowanymi reduktorami w tym procesie są: węgiel, tlenek wapnia, magnez, glin, a rzadziej żelazo lub wodór:
ZnO + C → Zn0 + CO
Szczególnym przypadkiem procesu redukcji jest ALUMINOTERMIA. W procesie tym jako reduktor stosuje się sproszkowany glin. Wykorzystuje się tu duże powinowactwo glinu do tlenu (glin nie tylko łatwo łączy się z tlenem, ale i wykazuje zdolność odbierania tlenu od innych metali). Metodą aluminotermiczną otrzymuje się przede wszystkim takie metale jak mangan i chrom:
Cr2O3 + 2Al → 2Cr0 + Al2O3
Żeby taki proces zaszedł, trzeba go zainicjować, czyli ogrzać do odpowiedniej temperatury. W celu zainicjowania procesu aluminotermicznego stosuje się mieszanki, tzw. TERMITY, np. mieszanina tlenku żelaza (III) (Fe2O3) ze sproszkowanym glinem. Termit ogrzewa się do odpowiedniej temperatury inicjując właściwy proces aluminotermiczny.
ELEKTROLIZY
Na tej drodze otrzymujemy metale wysoko aktywne, a wiec litowce i berylowe. Stosuje się ja również do otrzymywania metali wysokiej czystości, np. miedzi, mówimy wówczas o miedzi elektrolitycznie czystej, cynku, glinu. Elektrolizie poddajemy albo wodne roztwory związków danego metalu, albo też związki w postaci stopionej, np. glin otrzymujemy w wyniku elektrolizy stopionego Al2O3.
I i II grupa układu okresowego
1 GRUPA - litowce
Występowanie
Są to metale bardzo aktywne chemiczne, dlatego tez występują w przyrodzie tylko w postaci związków chemicznych, najczęściej w postaci halogenów, (czyli związków z pierwiastkami z grupy 17- fluorowcami). W przyrodzie najbardziej rozpowszechnione są: sód, potas, znacznie rzadziej występuje Li, Rb, Cs, Fr jest pierwiastkiem promieniotwórczym i w przyrodzie występuje w ilościach śladowych.
Właściwości fizyczne:
Litowce to metale lekkie, barwy srebrzystej, są ciałami stałymi w warunkach normalnych, tak miękkie, że można je kroić nożem. Na powietrzu matowieją, gdyż są nieodporne na działanie czynników atmosferycznych, tzn. tlenu i wilgoci. W związku z tym, w celu ochrony litowców przed działaniem czynników atmosferycznych, przechowuje się je w nafcie. Charakteryzują się niskimi temperaturami topnienia (poniżej 100°C, wyjątek stanowi lit, który topi się w około 180°C).
W obrębie grupy, w miarę wzrostu liczby atomowej (im cięższy litowiec) obniża się temperatura topnienia.
Właściwości chemiczne:
- struktura powłoki walencyjnej ns1 - na powłoce walencyjnej mają jeden elektron, który chętnie oddają, wchodząc w reakcje chemiczne, więc występują na +1 stopniu utlenienia.
- mają silny charakter elektrododatni, który w obrębie grupy rośnie wraz ze wzrostem liczby atomowej.
- są najsilniejszymi reduktorami
- bardzo łatwo łączą się z tlenem, szczególnie w podwyższonej temperaturze, przy czym lit w tych samych warunkach daje tlenek litu Li2O, a pozostałe litowce dają nadtlenki, np. nadtlenek sodu- Na2O2. Tlenki cięższych litowców otrzymujemy w reakcji ich nadtlenków z odpowiednimi litowcami:
Na2O2 + 2Na → 2Na2O
- litowce, jak i ich tlenki i nadtlenki energicznie reagują z wodą, dając wodorotlenki:
2Na + 2H2O→ 2NaOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑ (to nie jest litowiec, reakcja przykładowa :)
Na2O + H2O → 2NaOH
BaO2 + 2H2O → Ba(OH)2 + H2O2 (to nie jest litowiec, reakcja przykładowa :)
Na2O2 + 2H2O → 2NaOH + H2O2
- dość łatwo łączą się z fluorem i chlorem. Reagują również z siarką, dając dwa rodzaje soli: siarczki (Na2S) oraz wielosiarczki (Na2Sx; gdzie x = 2÷6)
- w podwyższonej temperaturze litowce reagują z wodorem, dając wodorki (NaH). Wodorki litowców są typu jonowego. Z uwagi na bardzo silny charakter elektrododatni litowców, wodór w tych związkach występuje na „ -1” stopniu utlenienia. Wodorki te również energicznie reagują z wodą, dając wodorotlenki i wydziela się wolny wodór:
NaH + H2O → NaOH + H2↑
Otrzymywanie litowców
Litowce są bardzo aktywne i wykazują silne właściwości redukujące, toteż można je otrzymać tylko na drodze elektrolizy stopionych soli.
OTRZYMYWANIE SODU
Metaliczny sód otrzymuje się na drodze elektrolizy stopionego chlorku sodu NaCl. Jako że chlorek sodu topi się w temperaturze 801°C, dodaje się do niego pewna ilość chlorku wapnia CaCl2, wówczas taka mieszanka topi się w temperaturze ok.500°C.
NaCl → Na+ + Cl-
W procesie katodowym (na katodzie) następuje redukcja metalicznego sodu wolnego, a więc do katody dążą dodatnie jony sodu, a na dodatniej anodzie, do której dążą jony chlorkowe, następuje ich utlenienie do wolnego chloru:
K(-): Na+ + e- → Na0
A(+): 2Cl- → Cl2↑ + 2e-
TYPOWE ZWIĄZKI
Generalnie związki litowców są barwy białej, z wyjątkiem tych związków, w których występują barwne aniony, jak chromiany (CrO42- - żółte), dichromiany (Cr2O72- - pomarańczowe), manganiany (VII) (MnO2- - fioletowe). Większość soli litowców jest dobrze rozpuszczalne w wodzie.
1. NaCl- chlorek sodu (sól kuchenna)- najbardziej popularny, otrzymujemy go przez eksploatację pokładu albo odparowywanie solanek.
KCl- chlorek potasu
Powyższe chlorki są podstawowymi związkami sodu i potasu, stosowanymi do otrzymywania innych związków tych metali.
2.NaNO3- azotan sodu (saletra czylijska)
KNO3- azotan potasu (saletra indyjska)
Azotany jako minerały noszą nazwę saletry. Związki te są stosowane m.in. jako nawozy, dostarczają bowiem roślinom bardzo ważnego składnika, jakim jest azot, a saletra indyjska dodatkowo potasu.
3.Na2CO3- węglan sodu (soda kalcynowana)
K2CO3- węglan potasu
Otrzymywanie Na2CO3 na skalę przemysłową metodą SOLVAYA:
CaCO3 → CaO + CO2
NH3 + CO2 + H2O → NH4HCO3
Reakcja podwójnej wymiany:
NH4HCO3 + NaCl → NaHCO3 + NH4Cl
Kalcynacja sody: ogrzewanie NaHCO3 bez dostępu powietrza w temperaturze ok. 180°C.
2NaHCO3→180°C→ Na2CO3 +CO2 + H2O
W procesach prowadzonych na skalę przemysłową bardzo ważną sprawą są również produkty „odpadowe”. W procesie Solvaya takim produktem jest NH4Cl, który jest istotnym źródłem amoniaku, w związku z czym nie traktuje się go jako odpadu lecz przerabia dalej do uzyskania amoniaku. CO2 wykorzystywany w pierwszym etapie otrzymujemy z wapienia:
CaCO3→ CaO + CO2 - wynik termicznego rozpadu. [CaO- wapno palone]
Dalej przerabiamy CaO:
CaO + H2O → Ca(OH)2 - wapno gaszone
Przy użyciu Ca(OH)2 odzyskujemy amoniak z chlorku amonu:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 (gazowy) + 2H2O
W ten sposób ostatecznym produktem odpadowym w amoniakalnej metodzie Solvaya otrzymywania sody kalcynowanej jest CaCl2
NaOH- wodorotlenek sodu, ważny surowiec przemysłu chemicznego stosowany do wyrobu mydła i barwników organicznych.
Otrzymywanie NaOH:
Na drodze elektrolizy solanki w elektrolizie Castra- Kelnera. Elektrolizer ten składa się z dwóch komór. Pierwsza z nich wypełniona jest solanką (wodny roztwór NaCl), katodę stanowi metaliczna rtęć, natomiast anoda jest grafitowa. W wyniku elektrolizy na katodzie rtęciowej wydziela się metaliczny sód (w procesie redukcji) i tworzy on z rtęciową katodą tzw. AMALGAMAT (stop rtęci z innym metalem, w tym przypadku z sodem, w zależności od stosunku ilościowego rtęci do innego metalu, amalgamat może być w fazie stałej lub ciekłej), natomiast na grafitowej anodzie wydziela się gazowy chlor:
KHg(-): Na+ + e- → Na0
Agraf.(+): 2Cl- → Cl2(↑) + 2e-
Ten amalgamat sodowy przenosimy do drugiej komory, wypełnionej czystą wodą. Amalgamat pełni tutaj rolę anody, natomiast katoda jest żelazna. Sód zawarty w amalgamacie reaguje z wodą i otrzymujemy wodorotlenek i wolny wodór, (który wydziela się na katodzie grafitowej).
Na + H2O → NaOH + H2 (↑)
Ostatecznymi produktami procesu elektrolizy solanki są: NaOH, Cl2 (↑), H2 (↑).
2 GRUPA - berylowce
Są to typowe metale, przy czym beryl wykazuje cechy amfoteryczności.
Ra (rad)- jest pierwiastkiem promieniotwórczym, powstaje w wyniku rozpadu uranu, (dlatego rad towarzyszy zawsze rudom uranu).
Berylowce występują w postaci związków chemicznych (jako chlorki, węglany, siarczany, krzemiany).
Minerały Ca i Mg
- CaCO3 (kalcyt)- minerały te mogą nazywać się:
wapień- powstaje z muszli organizmów morskich
kreda- powstaje ze szczątkowych małych organizmów
marmur- powstaje z wapienia (gdy na wapień działa wysoka temperatura i wysokie ciśnienie).
- MgCO3 - magnezyt
- CaSO4 - anhydryt
- CaSO42H2O - gips
- [(Ca,Mg)(CO3)2] - dolomity
- Ca3(PO4)2 - fosforyt (głównym składnikiem jest fosforan (V) wapnia i apatyt
- 3Ca3(PO4)2 * Ca(OH)2 - hydroksyapatyt (główny składnik ludzkich zębów)
WŁAŚCIOWŚCI BERYLOWCÓW
- są to metale miękkie, lekkie, o barwie szaro- białej
- najmniej aktywny jest beryl. W obrębie grupy wraz ze wzrostem liczby atomowej wzrasta aktywność, charakter zasadowy tlenków, moc wodorotlenków, rozpuszczalność soli (najsilniejszy to Ba i Ra)
- reagują z kwasami:
Ca + 2HCl → CaCl2 + H2 (↑)
- beryl reaguje z mocnymi wodorotlenkami, a pozostałe pierwiastki są odporne na działanie mocnych wodorotlenków:
Be + NaOH + H2O → NaHBeO2 + H2 (↑) {wodoroberylan sodu}
- cięższe berylowce to: Ca, Sr, Ba (chroni się je przed zetknięciem z powietrzem)
- struktura powłoki walencyjnej - ns2 (dwa elektrony walencyjne, które oddają wchodząc w reakcje, w związku z tym występują na +2 stopniu utlenienia)
- beryl najchętniej tworzy związki, w których występuje wiązanie kowalencyjne (atomowe), a cięższe berylowe tworzą raczej związki o wiązaniu jonowym.
OTRZYMYWANIE
Ca- na drodze elektrolizy stopionej soli (CaCl2)
Mg- na drodze elektrolizy stopionej mieszaniny MgCl2 z dodatkiem NaCl lub na drodze redukcji tlenku magnezu węglem:
MgO + C → Mg0 + CO
ZWIĄZKI Ca i Mg
Tlenki
MgO, CaO- ciała stałe o barwie białej (lub bezbarwne), topią się w wysokiej temperaturze. Otrzymujemy je w wyniku dysocjacji termicznej węglanów:
CaCO3→temp→ CaO + CO2
lub w wyniku dysocjacji termicznej wodorotlenku:
Ca(OH)2 →temp→CaO + H2O
Zastosowanie MgO- do materiałów ogniotrwałych.
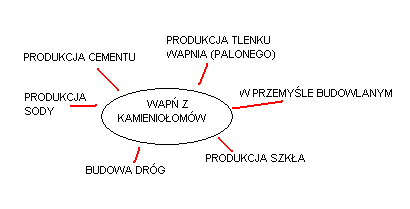
Zastosowanie CaO- w budownictwie, rolnictwie (nawóz), przemyśle szklarskim czy chemicznym.
Wodorotlenki
Mg(OH)2 Ca(OH)2
Otrzymujemy je:
- w wyniku reakcji tlenku z H2O
CaO +H2O → Ca(OH)2 - proces gaszenia wapna
- w reakcji rozpuszczalnych soli z mocnymi wodorotlenkami:
Mg2+ + 2OH- → Mg(OH)2 (↓)
Ca2+ + 2OH- → Ca(OH)2 (↓)
Właściwości:
Mg(OH)2 - rozpuszcza się w wodzie opornie, a wodny roztwór tego wodorotlenku wykazuje słaby odczyn zasadowy.
Ca(OH)2 - rozpuszcza się w wodzie nieco lepiej, wodny roztwór tego wodorotlenku ma wygląd zawiesiny, dlatego często jest nazywany mlekiem wapiennym lub wodą wapienną. Wodny roztwór ma silny odczyn zasadowy: Ca(OH)2 + CO2 → CaCO3 + H2O - jest to reakcja twardnienia zaprawy murarskiej.
ZASTOSOWANIE BERYLOWCÓW
Ra- w lecznictwie
Ba- jako związek BaSO4 ma zastosowanie jako biała farba mineralna; w medycynie (pochłania promienie rentgena), stosowany jako kontrast w prześwietleniach (np. żołądka)
Mg- ma zastosowanie jako stopy (najbardziej rozpowszechniony to elektron- zawiera do 98% Mg, a reszta to Al., Zn, Si).
Ca- jako CaCO3
Wietrzenie skał - CaCO3 + H2O + CO2 → Ca(HCO3)2
Ca(HCO3)2 - wodorowęglan wapnia- dobrze rozpuszcza się w wodzie, występuje w postaci wodnych roztworów, (gdy CO2 się ulatnia to reakcja zachodzi odwrotnie)
Mg i Ca jako makroelementy są niezbędne do prawidłowego funkcjonowania organizmów. Niedobór magnezu wynika z nadmiernego wysiłku fizycznego czy schorzeń serca. Mg ułatwia przyswajalność wapnia, jest bardzo dobrym lekiem na stresy, zaburzenia psychiczne, poprawia pamięć, poprawia pracę mięśni, wspomaga pracę serca, zapobiega miażdżycy, utrzymuje w organizmie prawidłową równowagę Ca, Na, K i P.
- jest to środkowa część układu okresowego, od 3 do 12 grupy.
- są to metale, które dobrze przewodzą ciepło i prąd elektryczny
- są stosunkowo mało aktywne chemicznie
- chętnie tworzą stopy
- wykazują wysoką temperaturę wrzenia i topnienia (wyjątek stanowi grupa 12- cynkowe. Ich temperatury topnienia niższe: Zn= ok. 420°C, Cd= ok. 320°C, Hg= ok. -40°C.)
- pierwiastki bloku d na ostatniej powłoce maja 2 elektrony walencyjne ns2 (wyjątki ns1). Ich elektrony mieszczą się również na powłoce (n-1)d1÷10
- mogą występować na stopniu utlenienia od +1 do +8
- trwałe jony (w większości przypadków) tworzą się, gdy metal przechodząc w stan jonowy traci elektrony z powłoki s i pozostają mu elektrony na powłoce d (np. Zn 3d104s2 → Zn2+), albo gdy tracą elektrony z powłoki s i z powłoki d (np. Sc 3d14s2 → Sc3+)
Właściwości metali na niskich stopniach utlenienia (+1, +2): są to silne reduktory, mają właściwości zasadowe i chętnie tworzą wodorotlenki.
Właściwości metali na średnich stopniach utlenienia (+3, +4, +5): ich związki mają charakter amfoteryczny.
Właściwości metali na wysokich stopniach utlenienia (+6, +7, +8): są silnymi utleniaczami, mają właściwości kwasowe.
- w odniesieniu do danego pierwiastka proste kationy tworzą chętnie pierwiastki na niskim stopniu utlenienia. Pierwiastki na wyższym stopniu utlenienia wchodzą w skład złożonych anionów. Mn2+- prosty kation; Mn+7O4- - złożony anion.
W obrębie grupy skłonność do tworzenia prostych kationów maleje wraz ze wzrostem liczby atomowej (tzn. im cięższy pierwiastek, tym mniej chętnie tworzy prosty kation)
- większość metali daje związki barwne (Fe- żółte lub zielone etc.) (← chemia laboratoryjna)
- chętnie tworzą związki kompleksowe, przy czym w związkach tych pełnia role atomu centralnego w jednostce koordynacyjnej, np. [HgI4]2- ; [Ag(NH3)2]7
24Cr (chrom)
Może występować na stopniach utleniania od +1 do +6 (niektóre związki chromu na danym stopniu utlenienia nie są trwałe)
Najtrwalsze związki - chrom na +3
Mniej trwałe, gdy jest na +2 lub +6
Chrom w przyrodzie występuje jako minerał (chromit) FeO*Cr2O3= FeCr2O4
Właściwości:
Barwa srebrzysto- biała
Twardy (twardość zbliżona do diamentu)
Wysokotopliwy (1800°C)
Dobrze przewodzi prąd elektryczny i ciepło
Odporny na działanie czynników atmosferycznych
Leży na lewo od wodoru, dlatego roztwarza się w HCl i H2SO4 , ale nie roztwarza się HNO3 , ponieważ ulega pasywacji (pasywacja- pokrywanie się metalu ochronną warstewką)
Zastosowanie:
Do pokrywania innych metali w celu ochrony ich przed korozja- chromowanie
Jako dodatek do stali wysokogatunkowych, (ponieważ chrom poprawia twardość i odporność mechaniczna stali)
Otrzymywanie:
- na drodze redukcji- metoda aluminotermicza
1 etap
Chromit prażymy z sodem w atmosferze powietrza. Produktem jest chromian sodu, który jest rozpuszczalny w H2O. Wyłągowujemy go i otrzymujemy go w postaci wodnego roztworu, następnie zakwaszamy, więc chromian sodu przechodzi w dwuchromian.
2 etap
Redukcja dichromianu węglem.
Związki chromu:
- związki z Cr na +2 stopniu utlenienia- są to połączenia mniej trwałe, mają właściwości redukujące, charakter zasadowy. Tworzy CrO i wodorotlenek Cr(OH)2 , który bardzo szybko utlenia się do Cr(OH)3 . Ich sole mają barwę niebieską.
- związki z Cr na +3 stopniu utlenienia - mają charakter amfoteryczny, tworzą Cr2O3 , Cr(OH)3 .
Cr2O3 - ciało stałe o barwie szaro- zielonej. Stosowany jest jako zielona farba mineralna. W przyrodzie towarzyszy minerałom (KORUND) (głównym składnikiem jest tlenek glinu). Korund ma barwę białą. Po zmieszaniu Cr2O3 z korundem powstanie barwa czerwona, a gdy w większych ilościach dodamy Cr2O3 to barwa będzie zielona. Cr2O3 jest wysokotopliwy- (2000°C)
Otrzymywanie:
-- Cr2O3
Przez termiczny rozkład Cr(OH)2 ulega dysocjacji (produktem jest CrO i H2O)
Redukcja lub termiczny rozkład dichromianów
Może tworzyć proste kationy 3+ lub aniony CrO2- lub Cr(OH)4- lub Cr(OH)6-3 zależnie od stężenia reagentów i pH roztworu.
-- Cr(OH)3- wykazuje właściwości amfoteryczne, może również dysocjować. W obecności mocnych kwasów dysocjuje na kation Cr
H3O+ + CrO2- ↔ Cr(OH)3 ↔ Cr3+ + 3OH-
Może również dysocjować w obecności mocnych wodorotlenków jako słaby kwas.
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6] lub NaCrO2
słaby kwas ↑
- związki z Cr na +6 stopniu utlenienia
Tworzy tlenek CrO3- - ciało stałe, krystalizuje, tworzy igły barwy czerwonej, jest BEZWODNIKEM KWASOWYM. W reakcji z woda daje oksokwasy chromu (VI).
H2CrO7
H2CrO4
CrO3 + H2O → H2CrO4 - (gdy dużo wody)
CrO3 + H2O → H2CrO7 - (gdy mało wody); jest na czele grupy polikwasów chromu
CHROMIANY (VI) I DICHROMIANY (VI)
Rozpuszczają się dobrze w wodzie
Maja właściwości utleniające
Ich wodne roztwory mają barwę żółtą, a dichromiany pomarańczową
Mogą nawzajem w siebie przechodzić, co zależy od pH roztworu
2CrO42- + 2H3O+ ↔ CrO72- + 3H2O
Cr2O72- + OH- ↔ 2CrO42- + H2O
Cr2O72- + I- + H3O+ → Cr3+ + I2 + H2O
Cr6+ + +3e→ Cr3+ /∙2
2I- - 2e → I2 /∙3
Cr to także ważny składnik w organizmie człowieka. W miarę starzenie się lub w wyniku nadmiernego wysiłku fizycznego następuje ubytek chromu. Brak Cr może powodować cukrzycę, choroby serca i wzrost cholesterolu.
25Mn (mangan)
Należy do grupy 7
Powłoka walencyjna 3d54s2
Może występować na stopniach utlenienia od +1 do +7 (gdy jest na +2 to związek jest najtrwalszy)
Występuje w postaci rud tlenkowych:
MnO2- PIROLUZYT
Mn3O4- HAUSMANIT
Właściwości:
Ma barwę srebrzysto- szarą
Należy do grupy metali ciężkich
Stosunkowo nisko topliwy metal
W szeregu aktywności metali leży na lewo od wodoru, co oznacza, że roztwarza się w kwasach z wydzieleniem H (roztwarza się łatwo, a łatwość ta zależy od postaci Mn, tym lepiej, im jest mocniej rozdrobniony)
Zastosowanie:
W postaci stopów, jako żelazomangan, stosowany jest w produkcji stali do jej odtlenienia
Manganin- stop na bazie Cu (3% Mn, 4% Ni)- jego opór elektryczny w niewielkim stopniu zależy od temperatury- przewody elektryczne, z których konstruuje się precyzyjne opornice
Otrzymywanie:
- z hausmanitu na drodze redukcji (reduktor- sproszkowany Al) metodą aluminotermiczną.
3Mn3O4 + 8Al0 → 9Mn0 + 4Al2O3
Mn3O4
2Mn3+ + 6e → 2Mn0
+8e- /∙3
1Mn2+ + 2e → Mn0
Al0 - 3e → Al3+
-3e- /∙8
Związki manganu:
Na +2 stopniu utlenienia związki mają charakter redukujący i zasadowy.
MnSO4
MnO
Mn(OH)2 - łatwo ulega utlenieniu do Mn(OH)4
Na +3 stopniu utlenienia związki są nietrwałe, łatwo ulegają rozkładowi w procesie dysproporcji (do +2 i +4 stopnia utlenienia)
Na +4 stopniu utlenienia związki manganu mają charakter amfoteryczny, przy czym sole (gdzie Mn jest na +4 st. utl.) są nietrwałe w postaci roztworów. Trwałym związkiem jest MnO2. MnO2 jest brunatny i stosowany jest jako katalizator, jako pochłaniacz w maskach gazowych.
MnO2 + 4HCl → MnCl2 + Cl0 + 2H2O
Mn+4 + 2e- → Mn+2
2Cl- - 2e- → Cl20
2MnO2+ 2H2SO4 → 2MnSO4 + O20 + 2H2O
Mn+4 + 2e- → Mn+2 /∙2
2O-2 - 4e- → O20
W reakcji z kwasem stopień utlenienia zmienia się z +4 na +2.
Z mocnymi wodorotlenkami:
2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O
Mn+4 + 2e- → Mn+6 /∙ 2
O20 - 4e- → 2O-2
Na +6 stopniu utlenienia- związki te wywodzą się od kwasu H2MnO4 (kwas ten znany jest tylko w postaci jego soli)
MnO4- - nietrwałe, mają właściwości utleniające. Są nietrwałe w środowisku kwaśnym i obojętnym. Trwałe są w środowisku silnie zasadowym (w środowisku zasadowym, w postaci wodnych roztworów są zielone). Nietrwałość polega na tym, że ulegają rozkładowi w procesie dysproporcji (dysproporcja do +7 i +4 st.utl.).
W środowisku kwaśnym:
3MnO4-2 + x H3O+ → MnO2 + 2MnO4- + 6H2O
Mn+6 + 2e- → Mn+4
Mn+6 - e- → Mn+7 /∙ 2
-6 + x = -2
x = 4
W środowisku obojętnym:
3MnO4-2 + 2H2O → MnO2 + 2MnO4- + x OH-
Mn+6 + 2e- → Mn+4
Mn+6 - e- → Mn+7 /∙ 2
-6 = -2 - x
x = 4
Na +7 stopniu utlenienia związki manganu mają charakter silnie utleniający.
Mn2O7 - oleista ciecz barwy ciemnej. Bezwodnik kwasowy HMnO4 - kwas mocny o silnych właściwościach utleniających (istnieje tylko w postaci roztworów rozcieńczonych o barwie fioletowej). Związki Mn w zależności od środowiska ulegaja redukcji:
- w środowisku kwaśnym - do +2 st.utl.
- w środowisku słabo alkaicznym - do +4 st.utl.
- w środowisku zasadowym - do +6 st.utl.
Mn2O7 + H2O → HMnO4 kwas manganowy (VII)
26Fe (żelazo) 3d64s2
Właściwości, występowanie:
Żelazo jest metalem ciężkim, trudnotopliwym, niezbyt twardym, ciągliwym, o barwie biało- szarej. Występuje w odmianach alotropowych: α- odmiana trwała w warunkach normalnych- ferromagnetyk, β - paramagnetyk i γ. Żelazo rozpuszcza się w kwasach nieutleniajacych i rozcieńczonych utleniających; w stężonych kwasach azotowym i siarkowym ulegają pasywacji, ogrzany reaguje z tlenem, chlorem, siarką, fosforem i krzemem, w powietrzu wilgotnym już w temperaturze pokojowej pokrywa się warstwą uwodnionych tlenków (rdza), występuje na następujących stopniach utlenienia +2, +3 (związki te są najtrwalsze), rzadko +5, +6; tworzy sole podwójne i związki kompleksowe {4Fe + [3 Fe(CN)6]-4 →Fe4[Fe(CN)6]3}
Występowanie w postaci minerałów:
Fe2O3- hematyt
Fe3O4- magnetyt
Fe2S- piryt
Występuje też w organizmach żywych- wchodzi w skład hemoglobiny.
Otrzymywanie:
Metaliczne żelazo otrzymuje się przez redukcję Fe2O3 wodorem oraz przez termiczny rozkład karbonylku żelaza Fe(CO)5.
Otrzymywanie żelaza w procesie wielkopiecowym: (http://www.bbc.co.uk/history/games/blast/blast.shtml)
Surowcem do otrzymywania żelaza są jego rudy. Proces redukcji prowadzi się w wielkim piecu. Napełnia się go na przemian warstwami rudy i koksu, po czym wdmuchuje od dołu powietrze nagrzane do 1200-1300°C. Węgiel zawarty w koksie spala się do CO2 rozgrzewając zawartość. W wyższych częściach pieca CO2 redukuje się węglem do CO, który z kolei redukuje tlenki żelaza. Finalnym produktem otrzymywanym w wielkim piecu jest surówka zbierająca się w stanie płynnym na dnie pieca:
100- 200°C- odwadnianie i osuszanie wsadu
400°C- I etap redukcji rudy żelaza (III)
3Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
500°C
Fe3O4 + 4CO → 3Fe + 4CO2
FeO + CO → Fe + CO2
Fe w postaci gąbczastej masy działa katalitycznie na proces rozkładu tlenku węgla:
2CO → C + CO2
Powstaje roztwór stały węgla w żelazie - surówka zawierająca 2÷5 % węgla oraz Si, Mn, fosfor i siarkę.
Surówka szara- węgiel jako grafit, 2÷3 % Si, ~ 1% Mn, przeznaczona najczęściej na odlewy.
Surówka biała- węgiel jako cementyt (Fe3C), mało Si, ~ 2% Mn, przerabia się ją na stal (odwęglanie surówki).
29Cu (miedź)
Występowanie i właściwości:
Cu występuje na +1 i +2 stopniu utlenienia (związki trwałe). W przyrodzie występuje zarówno w stanie rodzimym, jako wolny metal, jak i w postaci związków, głównie siarczków, węglanów i tlenków:
Cu2S- chalkozym
CuFeS2- chalkopiryt
Cu(OH)2CO3 {= Cu(OH)2∙CuCO3}- malachit [węglan wodorotlenek miedzi (II)]
Miedź jest ciałem stałym, różowym, kowalnym i miękkim. Na powietrzu pokrywa się tlenkiem Cu2O (czerwony), a jeżeli w powietrzu jest wilgoć to pojawia się zielony nalot (Cu(OH)2∙CuCO3). Nie roztwarza się w kwasach nieutleniających, roztwarza się w HNO3 i stężonym H2SO4 w podwyższonej temperaturze. Nie wypiera wodoru z kwasu:
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Otrzymywanie:
Są dwa sposoby otrzymywania Cu:
REDUKCJA (otrzymujemy miedź surową, zawierającą wiele zanieczyszczeń)- 3 etapy
Prażenie rudy miedzi w celu utlenienia zanieczyszczeń.
Topienie wyprażonego koncentratu, powstają dwie fazy ciekłe: 1- kamień miedziowy zbierający się na dole i 2- żużel krzemianowy zawierający zanieczyszczenia i gromadzący się na górze.
Przeróbka kamienia miedziowego (w piecach konwektorowych)- przedmuchiwanie powietrza przez kamień:
Cu2S + O2 → Cu2O + SO2 (+ Cu2S) autoredukcja:
Cu2S + 2Cu2O → 6Cu + SO2
ELEKTROLIZA miedzi surowej:
Elektrolit: CuSO4 + H2SO4
Anoda: grube płyty z miedzi surowej
Katoda: cienkie blachy z miedzi elektrolitycznie czystej
A(+): Cu→ Cu2+ + 2e-
K(-): Cu2+ + 2e- → Cu
Związki miedzi:
Cu2O- kupryt, ciało stałe, czerwone, używane do barwienia szkła i porcelany; otrzymujemy przy powolnym utlenianiu miedzi przy niepełnym dostępie powietrza. Wyjątkowo związek ten, (w którym Cu występuje na +1 stopniu utlenienia) jest trwalszy od CuO (+2 stopień utlenienia).
CuO- ciało stałe, barwy czarnej, otrzymuje się je przy intensywnym utlenianiu miedzi.
Cu(OH)2- (Cu na +1 stopniu utlenienia nie tworzy wodorotlenków). Otrzymujemy: Cu2++2OH- → Cu(OH)2(↓) w postaci błękitnego osadu, ma słaby charakter amfoteryczny (w NaOH rozpuszcza się na gorąco), bardzo dobrze rozpuszcza się w amoniaku:
Cu(OH)2 + 4NH4OH → Cu(NH3)4(OH)2 + 4H2O (wodorotlenek tetraamina miedzi (II))
Cu(OH)2 + 2OH- → [Cu(OH)4]2-
Zastosowanie:
Miedź znajduje zastosowanie w elektrotechnice, do wyrobu przewodów elektrycznych.
Stopy miedzi: brązy (Cu+Sn) do wyrobu dzwonów, pomników, mosiądze (Cu+Zn).
30Zn (cynk)
- przedstawiciel grupy 12
- powłoka walencyjna 3d104s2
- +2 stopień utlenienia w związkach
Właściwości:
Metal barwy srebrzysto- białej
Należy do grupy metali ciężkich
Na powietrzu powoli się utlenia
Leży na lewo od wodoru w szeregu aktywności metali
Roztwarza się w mocnych kwasach i mocnych zasadach
W temperaturze pokojowej jest metalem mało plastycznym, ale po wyżarzeniu (100-150°C) staje się plastyczny
Chętnie tworzy związki kompleksowe jako atom centralny
Zastosowanie:
Ważny metal użytkowy- stopy (mosiądz Cu+Zn)
Pokrywanie innych metali w celu ochrony przed korozją
Ważny dla organizmu- utrzymuje barierę odpornościową organizmu i stymuluje rozwój mięśni
Występowanie:
ZnS- blenda cynkowa minerały
ZnCO3-smitsonit
Otrzymywanie:
1.Na drodze redukcji:
- przeprowadzenie rudy w tlenek cynku
Zn- niskotopliwy (420°C), wrze w 900°C
ZnS + O2 →800-950°C→ ZnO + SO2
ZnCO3 →800-950°C→ ZnO + CO2
- redukcja węglem
ZnO + C → ~1300°C→ Zn (postać gazowa) + CO
Stosuje się tzw. odbieralniki w celu zestalenia pary cynku. Otrzymany cynk jest nieczysty.
2.Elektroliza (cynk o dużej czystości)
- przeprowadzamy rudę w tlenek cynku (jak wyżej)
- tlenek cynku roztwarza się w kwasie siarkowym, siarczan cynku poddaje się elektrolizie.
ZnO + H2SO4 → ZnSO4
ZnSO4 → Zn2+ + SO42-
Sumaryczne równanie elektrolizy:
ZnSO4 + H2O → Zn0 + ½ O2 + H2SO4
Zn powstaje na katodzie. Jony siarczanowe bardzo trudno poddają się redukcji.
- Sole cynku są białe (bezbarwne, chyba, że anion jest barwny)
- tlenek i wodorotlenek cynku maja charakter amfoteryczny:
Zn + ½ O2 → ZnO
Zn(OH)2 →T→ ZnO + H2O
Zn2+ + 2OH- → Zn(OH)2 (↓)
Zn(OH)2 ↔H+↔ Zn2+ + 2OH-
Zn(OH)2 ↔OH-↔ ZnO22- + 2H+
Zn(OH)2 + 2OH- → ZnO22- + 2H2O
[Zn(OH)4]2-
Zn(OH)2 + 4NH3∙H2O → [Zn(NH3)4](OH)2 + 4H2O
- grupy 13-18, występują metale, niemetale, półmetale i gazy szlachetne.
- struktura powłoki walencyjnej ns2np1÷6
- stopień utlenienia od +3 do +8
9F (fluor)
- pierwszy pierwiastek grupy 17
- stopień utlenienia [-1]
- najsilniej elektroujemny pierwiastek
13Al (glin)
- grupa 13
- struktura powłoki walencyjnej 3s2p1
- +3 stopień utlenienia w związkach
- bardzo rozpowszechniony w przyrodzie
- silnie toksyczny
Minerały:
- glinokrzemiany
- korund Al2O3
- boksyty (skały o zmiennym składzie- różnie uwodniony tlenek glinu) Al2O3∙2H2O ; AlO(OH)
- kriolit Na3AlF6
Właściwości:
barwa srebrzysto- szara, miękki, łatwo ulega odkształceniu, bardzo duże powinowactwo do tlenków innych metali
ulega pasywacji na powietrzu, w podwyższonej temperaturze odbiera tlen od tlenków innych metali
amfoteryczny (leży na lewo od wodoru)
AlO2- + H3O+ ↔ Al(OH)3 ↔ Al3+ + 3OH-
Zastosowanie:
stopy z miedzią
elektrotechnika, części maszyn, przewody, oprawy kabli
Otrzymywanie:
Na drodze elektrolizy:
Przeróbka boksytu do tlenku glinu
- metoda mokra- reakcja z wodnym NaOH (120-1200°C)
- metoda sucha- spiekanie z Na2CO3 i CaCO3 (1200°C)
2. Elektroliza tlenku glinu
boksyt → NaAlO2→ Al(OH)3→ Al.2O3
- tlenek glinu nie rozpuszcza się w wodzie, topi się w wysokiej temperaturze ~2050°C, dlatego robi się mieszaninę tlenku glinu z kriolitem o temperaturze topnienia ~900°C
- elektrolitem w elektrolizie jest stopiona mieszanina tlenku glinu i kriolitu.
Al2O3→ 2Al3+ + 3O2-
Związki:
tlenek i wodorotlenek (charakter amfoteryczny) barwy białej
wodorotlenek występuje jako minerał w przyrodzie
tlenek- korund- Al2O3 - związek bardzo twardy i wysokotopliwy, dlatego służy do wyrobu materiałów ognioodpornych, materiałów szlifierskich
otrzymuje się w wyniku dysocjacji termicznej Al(OH)3
Ałuny- podwójne siarczany metali jedno- i trójwartościowych
MI2SO4∙MIII2(SO4)3∙24H2O
MIMIII(SO4)2∙12H2O
- metale jednowartościowe to litowce lub NH4+
- metale trójwartościowe to: Al, Cr, Fe, Co, np.:
NH4Al(SO4)2∙12H2O
- stosowane w garbarstwie, przemyśle papierniczym, tekstylnym, do dezynfekcji błon śluzowych.
14 GRUPA - węglowce
węgiel 6C - niemetal
krzem 14Si i german 32Ge - półmetale
cyna 50Sn i ołów 82Pb - metale
Grupa 14 jest grupą pośrednią w układzie okresowym, usytuowana jest między pierwiastkami grup początkowych (silnie elektrododatnimi), a grup końcowych (silnie elektroujemnymi)
- struktura powłoki walencyjnej: ns2np2, 4 elektrony walencyjne
- skłonność do tworzenia czterech zhybrydyzowanych wiązań kowalencyjnych typu s-p3
- od 4 stopnia utlenienia (typowego dla C) trwałość pierwiastków do połączeń maleje, a od 2 rośnie.
6C (węgiel)
Występowanie i odmiany:
Występuje w przyrodzie głównie w postaci związków organicznych albo pochodnych organicznych (występuje w ropie, gazie ziemnym- metan). Jeżeli chodzi o związki nieorganiczne to w postaci węglanów
W stanie wolnym węgiel występuje w postaci trzech odmian alotropowych:
(alotropia- zjawisko polegające na występowaniu pierwiastków w dwóch lub więcej odmianach różniących się budową krystaliczną i strukturą sieci przestrzennej. Zjawisko to odnosi się tylko o pierwiastków, nie dotyczy związków)
DIAMENT- występuje w przyrodzie w sposób naturalny, niezbyt rozpowszechniony. Jest to ciało stałe, bezbarwne, przezroczyste, o bardzo dużej twardości. Jest izolatorem, charakteryzuje się dużym współczynnikiem załamania światła, jest odporny chemicznie. Ze względu na te właściwości jest stosowany jako metal materiał szlifierski, do cięcia stali i metali, jako końcówki wierteł. Oszlifowany diament to brylant. Diament krystalizuje w układzie regularnym. Komórka elementarna ma kształt sześcianu.
W połowie lat 80-tych odkryto węgiel cząsteczkowy (fulereny). Najbardziej znany fuleren to 60C (cząsteczki fulerenu składają się z 12 pierścieni pięciokątnych oraz różnej liczby pierścieni sześciokątnych i są wewnątrz puste). Im większa liczba atomów tym przyjmuje różne formy.
Węgiel aktywny- „sadza”, składa się z węgla bezpostaciowego (węgiel bezpostaciowy to zbiorowisko mikrokryształów grafitu), ma strukturę porowatą, dobrze rozwiniętą powierzchnię, silne właściwości absorpcyjne, stosowany w maskach gazowych i w filtrach wodnych.
Węgiel tworzy związki organiczne, ale również nieorganiczne. Węgliki, halogenki węgla itp.
CO- czad, jest to związek trujący, łączy się z hemoglobiną krwi i blokuje przyswajanie tlenu przez hemoglobiną. Jest to gaz bezwonny, bezbarwny, słabo rozpuszcza się w wodzie. To gaz trwały, ma właściwości redukujące, mało aktywny chemicznie.
Otrzymywanie CO:
W reakcji niepełnego spalania węgla w tlenie: C + ½ O2→ CO
Reakcja redukcji ditlenku węgla węglem: CO2 + C → 2CO
Z gazu wodnego lub generatorowego (gaz generatorowy otrzymuje się przepuszczając przez warstwę rozżarzonego koksu od dołu powietrze). W dolnej warstwie koksu zachodzi reakcja pełnego utleniania:
C+ O2 → CO2
W wyższych warstwach w temperaturze 900-1000°C:
CO2 + C → 2CO
Równowaga reakcji przesuwa się w prawo.
CO2- ditlenek węgla to gaz bezwonny, nieaktywny chemicznie, dobrze rozpuszcza się w wodzie. Łatwo ulega skropleniu pod zwiększonym ciśnieniem. Skroplony CO2 to ciecz o niskiej gęstości. Ciekły dwutlenek krzepnie w temperaturze -57°C pod zwiększonym ciśnieniem ok.5 at. Zestalony CO2 ma wygląd lodu. Stosowany jest jako środek chłodzący, gdy się go zmiesza z acetonem lub metanolem. Zestalony CO2 często jest nazywany „suchym lodem”, ma zdolności do sublimacji (przejście z fazy stałej w gazową z pominięciem ciekłej)
CO2 + H2O → H2CO3
Kwas węglowy to kwas słaby w postaci rozcieńczonych roztworów. Rozkłada się z wydzieleniem CO2, to kwas dwuprotonowy. Sole kwasu węglowego są trwalsze niż sam kwas.
14Si (krzem)
- drugi po tlenie pierwiastek najbardziej rozpowszechniony w przyrodzie
- w stanie wolnym nie występuje
- występuje w postaci minerałów: glinokrzemiany, krzemionki- SiO2, krzemiany, kryształ górski- kwarc.
Otrzymujemy Si na drodze redukcji SiO2 (reduktorem jest węgiel lub magnez)
Zastosowanie: elektronika, do wyrobu elementów półprzewodnikowych, stali kwasoodpornych
Właściwości fizyczne i chemiczne:
ma właściwości półprzewodzące
właściwości są zbliżone do węgla
ciało stałe, ciemnoszare o połysku metalicznym
twardy (w skali twardości- 7)
bierny chemicznie
odporny na działanie kwasów
ulega tylko działaniu mieszaniny kwasu fluorowęglowodorowego i azotowego
nie jest odporny na działanie mocnych wodorotlenków:
Si + 2NaOH + H2O → Na2SiO3 + 2H2
stopień utlenienia +4
Związki z O2:
SiO2- krzemionka, główny składnik piasku, wykazuje zjawisko polimorfizmu (zjawisko analogiczne do alotropii pierwiastków, ale dotyczy związków chemicznych)
-Występuje w3 odmianach polimorficznych:
- kwarc (niskotemperaturowa)
- trydymitr (wyżejtemperaturowa)
- krystobalit (wysokotemperaturowa)
- Jeżeli kwarc jest chemicznie czysty, tworzy bezbarwne kryształy- kryształ górski, gdy jest zabarwiony metalami- opal, topaz, ametyst
- topi się w temperaturze wysokiej, ok.1700°C, gdy gwałtownie go ochłodzimy, zastyga w postaci bezbarwnej masy, dając tzw.szkło kwarcowe.
Szkło kwarcowe:
- jest odporne na szybkie zmiany temperatury
- ma mały współczynnik rozszerzalności cieplnej
- jest odporne chemicznie
- używa się go do wyrobu aparatów laboratoryjnych i naczyń laboratoryjnych
- bezwodnik grupy kwasów krzemowych.
Krzemiany- otrzymuje się w wyniku stopienia SiO2 z węglanami
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + 4NaOH → Na4SiO4 + 2H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
SiO2 + 2 Na2CO3 → Na4SiO4 + 2CO2
- krzemiany są nierozpuszczalne w wodzie, wyjątkiem jest krzemian sodu i potasu
- wodne roztwory krzemianu Na i K → szkło wodne
Zastosowanie: jako materiał impregnujący, bo ma właściwości bakteriobójcze, ognioodporne, chroni przed wilgocią, jest odporny na wysokie temperatury.
15 GRUPA - azotowce
- struktura powłoki walencyjnej ns2np3, gr.V
- najchętniej występują na -3 stopniu utlenienia
- występują w połączeniach z H2
Właściwości fizyczne:
N, P- niemetale
As, Sb- półmetale
Bi- metal
Podstawowy stopień utlenienia -3, +3, +5
AZOT odbiega właściwościami:
W zwykłej temperaturze jest gazem, pozostałe azotowce ciałami stałymi
W stanie wolnym- główny składnik powietrza, występuje w postaci cząsteczek dwuatomowych N2 (a fosfor P4)
W przyrodzie występuje w stanie wolnym, w postaci związków chemicznych- azotanów (tzw. saletry)
FOSFOR występuje w przyrodzie w postaci fosforanów:
- Ca3(PO4)2- ortofosforan wapnia
- apatyty 3Ca3(PO4)2CaF2
CaCl2- chloroapatyt
CaO- oksyapatyt
Ca(OH)2- hydroksyapatyt
ALOTROPIA:
N- nie posiada odmian alotropowych, reszta wykazuje zjawisko alotropii
P- występuje w postaci 4 odmian alotropowych:
- fosfor biały
- fosfor czerwony
- fosfor fioletowy
- fosfor czarny
- najbardziej popularny jest fosfor biały, pozostałe otrzymuje się z niego w odpowiednich warunkach (temperatura, ciśnienie)
Właściwości fosforu białego:
Ciało stałe, białe, miękkie
W postaci rozdrobnionej topi się w temp.40°C (większe kawałki w 60°C)
Odmiana toksyczna
Łatwo się utlenia dając: 2P2O3 ↔ P4O10 , utlenianiu towarzyszy proces wydzielania światła- proces chemicznej luminescencji
Jest nietrwały, po pewnym czasie przechodzi w inne odmiany alotropowe, przybierając barwę żółtą.
Właściwości fosforu czerwonego:
Odmiana trwała
Ciało stałe, czerwone
Znacznie mniej aktywny niż fosfor biały
Zapala się w wyniku podgrzania do temperatury powyżej 400°C
Jest nietoksyczny
Właściwości fosforu czarnego:
Ciało stałe
Szaroczarne
Ma metaliczny połysk
Tylko on przewodzi prąd elektryczny
7N (azot)
Związki azotu z H2
- wodorki
Azotowce występują na -3 stopniu utlenienia, ogólny wzór XH3 trójwodorki: NH3, PH3, szeroko stosowane w przemyśle
NH3
Właściwości:
- gaz bezbarwny, o ostrym nieprzyjemnym zapachu
- bardzo dobrze rozpuszcza się w wodzie, wodny roztwór gazowego amoniaku jest słabą zasadą
- NH3 + H2O → NH4+ + OH- (teoria Lowrego- Bronsteda, w roztworze nadmiar OH)
- w cząsteczce NH3 jest wolna para elektronowa, więc tworzy on związki on związki kompleksowe z pierwiastkami podgrup, np.: [Ag(NH3)2]+ ; [Cu(NH3)4]2+
Pochodzenie amoniaku
Związki, w których wzór można utworzyć zastępując 1,2 lub 3 atomy H w cząsteczce NH3, atomami innych pierwiastków lub jednowartościowymi grupami atomu:
- podstawniki - atomy metalu, niemetalu, rodnik nieorganiczny OH-, rodnik organiczny CH3-
-jeśli podstawimy metal:
za 1 atom H- AMIDKI np. NaNH2
za 2 atomy H- IMIDKI np. CaNH
za 3 atomy H- AZOTKI np. AlN
- jeśli podstawimy pozostałe podstawniki
związki AMINY np. NH2OH- hydroksyamina
NH2OH3- metyloamina
Azot i wodór tworzą też HN3 - kwas azotowodorowy
- słaby
- o właściwościach wybuchowych
Związki azotu z O2, tlenki, kwasy tlenowe
N2O- podtlenek azotu, tlenek diazotu
NO- tlenek azotu
N2O3- trójtlenek azotu
NO2- dwutlenek azotu
N2O5- pięciotlenek azotu
NO- tlenek azotu
Gaz bezbarwny o nieprzyjemnym zapachu
Słabo rozpuszcza się w wodzie
Można otrzymać przez:
Bezpośrednią syntezę azotu z tlenem
N2 + 2O → 2NO
Zachodzi jednak trudno, potrzebna temperatura ok.3000°C
4NH3 + 5O2 → 4NO + 6H2O
NO2- dwutlenek azotu
Powyżej temperatury ok.22°C jest gazem barwy czerwonobrunatnej
W temperaturze ok.22°C skrapla się- powstaje ciecz barwy żółtej
Dalsze oziębienia powoduje, że w temperaturze 10°C ciecz krzepnie dając bezbarwne kryształy
Wykazuje skłonność do polimeryzacji i występuje w postaci podwójnej: NO2 ↔ N2O4
N2O4
Im niższa jest temperatura tym więcej jest dinerów
Bezwodnik kwasowy mieszaniny- w reakcji z woda daje mieszaninę dwóch kwasów tlenowych
N2O4 + H2O → HNO2 + HNO3 reakcja dysproporcji
Dimer (N2O4) reaguje z ługami
N2O4 + KOH → KNO2 + KNO3 + H2O
Otrzymywanie NO2
Utlenianie NO tlenem zawartym w powietrzu (najprostsza)
NO + ½ O2 → NO2
Termiczny rozkład niektórych azotanów
Pb(NO3)2 → PbO + NO2 + O2
Kwasy tlenowe:
HNO2 - AZOTANY
Słaby
Istnieje tylko w postaci roztworów rozcieńczonych
W wyniku zagęszczenie (zatężenia) ulega rozkładowi
3HNO2 → HNO3 + 2NO + H2O
N+3 → N+5 + 2e-
N+5 + 3e- → N+2 /2
Jego sole, azotyny, to związki nietrwałe, w obecności silnych utleniaczy zachowują się jak reduktory i odwrotnie
HNO3
Stosowany popularnie w przemyśle chemicznym
Półprodukt w procesie otrzymywanie nawozów azotowych
Mocny, o silnych właściwościach utleniających
Roztwarza metale, nawet szlachetne (oprócz złota, które roztwarza się w wodzie królewskiej)
Niektóre metale dobrze roztwarzają się w rozcieńczonym HNO3, a nie w stężonym, w stężonym ulegają pasywacji- pokrywają się warstwą ochronną
Jego sole dobrze rozpuszczają się w wodzie, stosowane m.in. jako nawozy (azotan: amonowy, potasu, wapnia)
Otrzymywanie HNO3 (na skalę przemysłową- metoda Habera i Bosch)
ETAPY:
1. Synteza amoniaku:
N2 + 3H2 → 2NH3
-temp. 450-500°C
-ciśnienie 200-300 at
-katalizator mieszany (kat. żelazny)- mieszanina Fe3O4, Al2O3
2. Spalanie NH3 w tlenie metodą Oswalda
3. Utlenianie NO do NO2 w nadmiarze powietrza
NO + ½ O2 → NO2 → N2O4
4. Absorpcja mieszaniny monomeru i dimeru w H2O
N2O4 + H2O → HNO2 + HNO3
- Mieszaninę tych dwóch kwasów zagęszcza się i kwas azotawy rozkłada się do azotowego
3HNO2 → HNO3 + 2NO + H2O otrzymujemy ok. 60% HNO3
15P (fosfor)
- Najistotniejsze tlenki: P2O3, P2O5 - mają skłonność do występowanie w postaci dimerów (podwójnych cząsteczek np.P4O6 , P4O10), ciała stałe, bezbarwne
- P2O3 - bezwodnik tlenowych kwasów fosforu, w których P występuje na +1, +3 lub +4 stopniu utlenienia- kwasy fosforowe, są nietrwałe
- P2O5 - bezwodnik kwasów tlenowych gdzie P występuje na +5 stopniu utlenienia
- Kwasy fosforowe:
HPO3 - metafosforowy
H4P2O7 - pirofosforowy
H3PO4 - ortofosforowy
-Fosfor tworzy też IZOPOLIKWASY- tlenowe kwasy, w których jest więcej niż jeden atom P, np.H5P3O10, kwas ortotrójfosforowy.
- Najbardziej popularny jest kwas H3PO4, kwas średniej mocy. 100% czysty kwas ortofosforowy to ciało stałe, krystaliczne, topi się w 40°C i w efekcie otrzymujemy gęstą, bezbarwna ciecz.
- Większe znaczenie mają sole- FOSFORANY
Znaczenie soli:
Zastosowanie jako nawozy
Dobrze rozpuszczalne w wodzie
Główny składnik fosforytów Ca3(PO4)2, nie rozpuszcza się w wodzie, bardzo dobrze w wodzie rozpuszczają się związki z K, Na, NH4+, zatem: Ca rozpuszcza się w kwasach, a K, Na, NH4+ w wodzie.
Z fosforytów otrzymuje się SUPERFOSFORATY, które dzielą się na pojedyncze i podwójne.
Pojedyncze:
Ca3(PO4)2 + H2SO4 → Ca(H2PO4)2 + CaSO4 - balast, nie rozpuszcza się w glebie
Podwójne:
Ca(PO4)2 + H3PO4 → Ca(H2PO4)2
16 GRUPA- tlenowce
Niemetale- O, S
Półprzewodniki- Se, Te
Metal- Po
Struktura powłoki walencyjnej ns2np4
Podstawowy stopień utlenienia -2 (O2 w połączeniu z fluorem występuje na +1 stopniu utlenienia, pozostałe bez O2 na +4, +6)
Trwałość +6 stopnia utlenienia rośnie od Po do S
8O (tlen)
Występuje w powietrzu, wodzie, skorupie ziemskiej
Jeden z najbardziej rozpowszechnionych pierwiastków w przyrodzie
Może występować w postaci wolnej jak i w postaci związków chemicznych
Wykazuje zjawisko alotropii- może występować jako tlen cząsteczkowy O2 lub jako ozon O3
Występuje w przyrodzie w postaci mieszaniny trzech izotopów : 168O , 178O , 188O
Gaz bezbarwny, który dość dobrze rozpuszcza się w wodzie
Mało aktywny chemicznie
W temperaturze pokojowej bezpośrednio łączy się z litowcami i fosforem białym
OZON O3
Powstaje z tlenu cząsteczkowego w wyniku wyładowań atmosferycznych (elektrycznych)
Obecność tlenu atomowego jest niezbędna do powstania ozonu
Odmiana alotropowa nietrwała, ulega łatwo rozpadowi do tlenu cząsteczkowego i atomowego: O3 → O2 + O
Ma znacznie silniejsze właściwości utleniające niż tlen cząsteczkowy, jest od niego bardziej aktywny
Jego obecność w atmosferze ma bardzo istotne znaczenie:
Na wysokości 20- 40km jest warstwa zagęszczonego ozonu, pochłania nadmiar promieni ultrafioletowych, które są szkodliwe, powodują schorzenia wzroku i skóry
Dziura ozonowa- nastąpiło zmniejszenie ilości ozonu, zubożenie jego warstwy. Przypuszcza się, że to freony niszczą ozon.
Połączenia tlenu i wodoru:
H2O2 (nadtlenek wodoru):
- ciecz bezbarwna o konsystencji syropu
- w sprzedaży jest około 30% roztwór wodny- perhydrol, 2%-10%- woda utleniona
- związek nietrwały, łatwo ulega rozkładowi do wody i tlenu. Proces ten katalizują: srebro, platyna, dlatego przechowuje się go w butelkach plastikowych
- ma właściwości utleniające i redukujące
- w obecności silnych utleniaczy zachowuje się jak reduktor i odwrotnie
- właściwości redukujące- reakcja otrzymywania tlenu na skalę laboratoryjną (z nadmanganianem potasu)
Zastosowanie:
- w medycynie- jako środek antyseptyczny (odkażający, bielący)
- we fryzjerstwie
- w technice rakietowej- jako źródło właściwego paliwa rakietowego
Otrzymywanie:
Na skalę laboratoryjną:
- reakcja nadtlenków litowców lub berylowców z woda lub kwasami
Na2O2 + 2H2O → 2NaOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
Na skalę przemysłową H2O2 otrzymuje się przez anodowe utlenianie kwasu siarkowego do kwasu nadtlenodwusiarkowego.
Reakcja katodowa
2H+ + 2e → H2
Reakcja anodowa
2H2SO4 → H2S2O8 + 2H+ + 2e
Tworzący się w mieszaninie reagującej H2S2O8 w czasie ogrzewania przekształca się w kwas nadtlenojednosiarkowy, tzw. kwas caro
H2S2O8 + H2O → H2SO5 + H2SO4
Przy dalszym podwyższaniu temperatury H2SO5 reaguje z wodą wydzielając nadtlenek wodoru.
H2SO5 + H2 → H2O2 + H2SO4
H2O - woda
Twardość wody i jej usuwanie:
Skały wapienne, których główny składnik to CaCO3 i MgCO3 pod wpływem tlenu z powietrza ulegają wietrzeniu. Powyższe związki Ca i Mg przechodzą w wodorowęglany, które są dobrze rozpuszczalne w wodzie i ich obecność powoduje TWARDOŚĆ WODY PRZEMIJAJĄCĄ (WĘGLANOWĄ). Usuwa się ją przez gotowanie:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Mg(HCO3)2 → MgCO3 + H2O + CO2
CaCO3 i MgCO3 tworzą kamień kotłowy.
Lub chemicznie, przez dodanie mleka wapiennego (wodorotlenek wapnia)
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Chlorki i siarczany Ca i Mg powodują twardość trwałą. Usuwa się ją tylko chemicznie przez dodawanie detergentów (substancji powierzchniowo czynnych).
Kamień kotłowy:
Jego tworzenie się jest zjawiskiem niekorzystnym
Osadza się na ściankach różnego rodzaju rur (przez które płynie woda, powodując zmniejszenie się prześwitu rury, a w końcu jej zasklepienie)
Wydzielając się w dużych zbiornikach wodnych, gdzie woda jest grzana, powoduje niebezpieczeństwo wybuchu, gdyż bardzo łatwo się odpryskuje
Jest słabym przewodnikiem ciepła
Twardość wody można usunąć za pomocą tzw. JONITÓW, które ją też odmineralizowują
JONITY:
- to zazwyczaj sztuczne żywice organiczne o charakterze kwasów lub zasad- działają tak, że wychwytują z wody kationy lub aniony, dzielone są na dwie grupy:
Kationity wychwytują kationy:
2KtH + Ca+ → (Kt)2Ca + 2H+
Anionity wychwytują aniony
AnOH + Cl- → AnCl + OH-
Woda zawiera duże ilości żelaza, a zwłaszcza Fe(HCO3)2, który usuwany jest z niej przez silne dotlenienie wody.
Fe(HCO3)2 + O2 → Fe(OH)3
16S (siarka)
- w przyrodzie występuje w postaci
- rodzimej (złoża siarki)
- w postaci związków chemicznych- minerały
siarczki różnych metali:
PbS- galena
FeS2- piryt
ZnS- blenda cynkowa
- ciało stałe, żółte, kruche
- nie rozpuszcza się w wodzie, ale dobrze rozpuszcza się niektórych rozpuszczalnikach organicznych
Otrzymywanie:
Jeśli zalega niezbyt głęboko pod powierzchnią ziemi- metoda odkrywkowa
Jeśli zalega głęboko- metoda Frascha- (150-200m):
W głąb ziemi wprowadza się 3 koncentryczne rury
Rurą zewnętrzną wprowadzamy przegrzaną do temperatury ok.160°C parę wodną
Rurą środkową wprowadzamy sprężone powietrze, które wchodząc od dołu porywa stopioną siarkę i tłoczone jest na powierzchnię ziemi przez rurę pośrednią
Związki siarki z wodorem:
- siarkowodór:
Gaz bezbarwny o nieprzyjemnej woni
Dość dobrze rozpuszcza się w wodzie
Jego wodny roztwór ma odczyn słabo kwaśny i nosi nazwę kwasu siarkowodorowego
Dysocjuje dwustopniowo:
H2S → H+ + HS-
HS- → H+ + S2-
Wodorosiarczki: z HS-
Spalanie:
H2S + ½ O2 → S + H2O (niepełny dostęp tlenu)
H2S + 5/2 O2 → SO2 + H2O (nadmiar tlenu)
Posiada właściwości redukujące
Otrzymywanie:
Bezpośrednia synteza wodoru i siarki: H2 + S → H2S
Reakcje siarczków z kwasami: ZnS + 2HCl → H2S + ZnCl
- wielosiarczki wodoru H2Sx x: 2÷6
najbardziej popularne są sole → wielosiarczki sodu, potasu (litowców) i amonowe (NH4)2Sx
związki z metalami są nietrwałe, łatwo ulegają rozkładowi H2Sx → H2S + (x-1)S
otrzymywanie → rozpuszczanie wolnej siarki w wielosiarczkach S-2 + (x-1)S → Sx-2
wartościowość siarki w tych związkach wynika ze wzoru strukturalnego
Związki siarki z tlenem:
- tlenki siarki
Dwutlenek siarki SO2
Właściwości:
- gaz bezbarwny o nieprzyjemnym zapachu
- dobrze rozpuszcza się w wodzie
- bezwodnik kwasu siarkawego
Otrzymywanie:
- na skalę laboratoryjną: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- na skalę techniczną:
1. Utlenianie siarki S + O2 → SO2
2. Prażenie siarczków (otrzymujemy tlenek metalu i dwutlenek siarki)
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Trójtlenek siarki SO3
Właściwości:
- wykazuje zjawisko polimorfizmu (polega na występowaniu związku chemicznego w co najmniej 2 odmianach nazywanych odmianami polimorficznymi, różniącymi się budową sieci krystalicznej)
- występuje w trzech odmianach: α-SO3, β-SO3 i γ-SO3- w zwykłej temperaturze niskotopliwe (30-60°C temp. topnienia)
- zwykle mamy do czynienia z mieszanina odmian α i β
- γ otrzymujemy, gdy pary siarki ochłodzimy i skroplimy otrzymaną ciecz, która krzepnie w temp.18°C, dając odmianę γ-SO3, jest nietrwała, przechodzi w mieszaninę α i β
- bardzo łatwo ulega parowaniu- pary SO3 silnie chłoną parę wodną z powietrza, dając mgłę kwasu siarkowego
Otrzymywanie:
- utlenianie:
2SO2 + O2 → 2SO3
- odwodnienie kwasu siarkowego:
H2SO4 + P2O5 → 2HPO3 + SO3
- kwasy tlenowe:
jest ich bardzo wiele
część udało się wyodrębnić w postaci czystej, część rozcieńczonych roztworów, część soli
H2SO3 - kwas siarkawy
H2SO4 - kwas siarkowy
H2S2O3 - kwas tiosiarkowy
Kwas siarkowy H2SO4
Właściwości:
Jeden z najmocniejszych kwasów- wszystkie układy kwaśniejsze od kwasu siarkowego 100% (o większej mocy kwasowej) nazywamy superkwasami
Bezbarwna, klarowna, gęsta oleista ciecz
Czernieje zostawiony na powietrzu
Bez zapachu
Higroskopijny
Silnie żrący
Topnieje 15°C
Wrze 310°C
Rozpuszczalny bez ograniczeń w wodzie
Kwas siarkowy jest silnym środkiem pochłaniającym wodę. Ma szerokie zastosowanie w syntezie laboratoryjnej, produkcji papieru, jako elektrolit do akumulatorów samochodowych, zakwaszacz.
Otrzymywanie:
Współcześnie kwas siarkowy otrzymuje się w przemyśle głównie metodą kontaktową. Metoda ta składa się z trzech etapów:
1. Otrzymywanie SO2: S + O2 → SO2
2. Utlenianie SO2 do SO3 (stosowany jest katalizator- pięciotlenek wanadu V2O5, jako kontakt w metodzie kontaktowej)
3. Absorpcja SO3 w H2O
SO3 + H2O → H2S2O7 → H2SO4
- otrzymujemy 98% kwas
- najbardziej stężony kwas siarkowy, tzw. kwas dymiący
Tiosiarczan H2S2O3
Znany w postaci soli
Najbardziej popularne- sole litowców, np.Na2S2O3
Nietrwałe (szczególnie w środowisku kwaśnym)
S2O3-2 + 2H3O+ → S + SO2 + 3H2O
Wykazuje właściwości redukujące
S2O3-2 + I2 → 2I- + S4O6-2
Tiosiarczany litowców
Zastosowanie:
- w fotografice jako utrwalacz, rozpuszcza halogenki srebra
2Na2S2O3 + AgBr → Na3[Ag(S2O3)2] + NaBr
Otrzymywanie:
- gotowanie siarczynów z wolną siarką
Na2SO3 + S → Na2S2O3
2Na2S2 + 3O2 → 2Na2S2O3
Kwasy nadtlenosiarkowe:
Kwasy o silnych właściwościach utleniających
Nietrwałe
W zwykłej temperaturze ciała stałe
Rozkładają się lub topią w temp.40-60°C
Traktowane jako wywodzące się z SO3 i H2O
Na skalę przemysłową otrzymuje się przez elektrolizę 50% kwasu siarkowego
17 GRUPA - fluorowce
Fluor 9F; chlor 17Cl; brom 35Br; jod 53I; astat 85At
Właściwości:
nietrwałe
najbardziej aktywny- fluor, najmniej jod
struktura powłoki walencujnej ns2np5
bardzo chętnie przyjmują elektrony
stopień utlenienia -1 do +7
w zwykłych warunkach:
gazy żółtozielone- F, Cl
ciecz czerwonobrunatna- Br
ciało stałe, kryształy fioletowoczerwone, połyskliwe, bardzo łatwo ulegają sublimacji-I
Reakcje z wodą:
F2 + H2O → 2HF + ½ H2O
Cl2 + H2O → HClO + HCl
(HClO- kwas podchlorawy, nietrwały- HCl + ½ O2)
Połączenia z wodorem:
Wszystkie fluorowce tworzą związki o wzorze HX
W zwykłych warunkach te połączenia to gazy o nieprzyjemnej, ostrej woni
W większych stężeniach maja działanie toksyczne
Halogenowodory:
Dobrze rozpuszczalne w wodzie- są mocnymi kwasami
W roztworze wodnym cząsteczki ulegają asocjacji- łączenie w większe cząsteczki
Od kwasu HF wywodzą się 2 szeregi soli: wodorofluorki KHF i obojętne fluorki KF
Od pozostałych kwasów tylko sole obojętne
17Cl (chlor)
Tworzy tlenki i kwasy tlenowe- tlenki są bezwodnikami kwasów
Cl2O- tlenek dichloru, żółtobrązowy gaz, otrzymywany w wyniku przepuszczania chloru nad tlenkiem rtęci(II)
2Cl2 + 2HgO → HgCl2·HgO + Cl2O
W obecności reduktorów ten tlenek może eksplodować. Jego cząsteczka ma budowę trójkąta. Z zasadami tworzy podchloryny.
2. ClO2- dwutlenek chloru, żółty gaz, otrzymywany w warunkach laboratoryjnych działaniem stężonego kwasu siarkowego na KClO3 w temperaturze 0°C. Jest substancją o silnych właściwościach utleniających, nietrwałą, ulegająca rozpadowi nawet pod wpływem słabego ogrzania. Z roztworami zasad tworzy mieszaninę chlorynów i chloranów:
2ClO2 + 2NaOH → NaClO2 + NaClO3 + H2O
Cl2O6- powstaje w reakcji pomiędzy ozonem i ClO2 w temperaturze 0°C. Jest ciemnoczerwona cieczą, wykazującą silne właściwości utleniające. Z zasadami dysproporcjonuje dając chlorany i nadchlorany
Cl2O6 + 2NaOH → NaClO3 + NaClO4 + H2O
Cl2O7 - bezbarwna ciecz powstająca przy odwadnianiu kwasu nadchlorowego HClO4 pięciotlenkiem fosforu. Jest bezwodnikiem kwasu nadchlorowego.
Kwasy tlenowe:
Chlor tworzy 4 kwasy tlenowe, występując na stopniach utlenienia:
HClO (+1) - kwas podchlorowy
HClO2 (+3) - kwas chlorawy
HClO3 (+5) - kwas chlorowy
HClO4 (+7) - kwas nadchlorowy
HClO:
Nietrwały
Istnieje w postaci rozcieńczonego roztworu
Rozkłada się do: HClO → HCl + ½ H2O
Bardziej trwałe są jego sole- podchloryny
HClO3:
Mocny
O silnych właściwościach utleniających
Sole dość trwałe o właściwościach utleniających
HClO4:
Najsilniejszy, trwały
Otrzymywany w postaci czystej i roztworów
W postaci czystej tworzy bezbarwną ciecz oleistą
9F (fluor)
- zielonożółty gaz o drażniącym zapachu
- silnie trujący
- tworzy tylko tlenki (właściwie fluorki tlenu, bo występuje jako anion)
- w pastach do zębów
- przedawkowanie jest niebezpieczne
- kwas fluorowodorowy trawi nawet szkło
- w przyrodzie występuje wyłącznie w stanie związanym w minerałach:
CaF2 - fluoryt
Na3AlF6 - kriolit
3Ca3(PO4)2·CaF2 - apatyt
- stosowany do produkcji teflonu i freonów
HELOWCE
- pierwiastki zerowej grupy układu okresowego
- gazy o bardzo małej aktywności chemicznej- spowodowane jest to zapełnieniem podpowłok s i p
- struktura powłoki walencyjnej:
He → 1s2
Pozostałe → ns2np2
2He (hel)
gaz bezbarwny, bez smaku, bez zapachu
temperatura topnienia -272,2°C (najniższa ze znanych)
skrapla się najtrudniej ze wszystkich gazów
w pobliżu temperatury zera bezwzględnego wykazuje zjawisko nadciekłości
naturalny pierwiastek zawiera trwały izotop 4He z domieszką 3He
występowanie → śladowe ilości w powietrzu, więcej w niektórych gazach ziemnych i minerałach uranu
w wysokiej temperaturze tworzy nietrwałe związki z metalami
zastosowanie:
w technice do uzyskania najniższych temperatur
mieszaninę He i O2 podaje się nurkom na dużych głębokościach
10Ne (neon)
gaz bez smaku i zapachu
niska temperatura topnienia i wrzenia (poniżej -240°C)
naturalny pierwiastek jest mieszaniną 3 izotopów trwałych 20Ne; 21Ne; 22Ne
występuje w powietrzu
nie tworzy związków
zastosowanie → do żarówek, lamp jarzeniowych dając czerwone światło
18Ar (argon)
gaz bezbarwny, bez smaku i zapachu
niskie temperatury wrzenia i topnienia (poniżej -180°C)
naturalny pierwiastek jest mieszaniną 3 izotopów
występuje w powietrzu
tworzy tylko bardzo nietrwały hydrat Ar·6H2O
zastosowanie
w przemyśle do wytwarzania atmosfery obojętnej
do napełniania żarówek i lamp jarzeniowych (niebieski)
w elektronice do napełniania liczników promieniowania jonizującego
36Kr (krypton)
gaz bezbarwny, bez smaku, zapachu
tworzy nietrwały hydrat Kr·6H2O
znane związki:
fluorki: KrF2, KrF4
kwas kryptonowy: H2KrO4
zastosowanie:
izotop 85Kr w medycynie do badania płuc
do napełniania żarówek i lamp jarzeniowych (światło białe)
54Xe (ksenon)
gaz bezbarwny, bez smaku i zapachu
zawarty w powietrzu jest mieszaniną 9 izotopów trwałych
znane związki:
hydrat: Xe·6H2O
fluorki: XeF2; XeF4; XeF6; XeF8
tlenki: XeO2; XeO3; XeO4
tlenofluorek: XeOF6
wodorotlenek: XE(OH)4, XE(OH)6 i inne
zastosowanie:
medycyna: do prześwietlania zębów i kończyn
żarówki i lampy jarzeniowe(niebieskie)
86Rn (radon)
pierwiastek promieniotwórczy
gaz bezbarwny, bez smaku i zapachu
związki:
niezbyt trwały fluorek: RnF4
zastosowanie: głównie w medycynie
DODATKOWO:
Zestawienie niektórych związków (na egzaminie wzory strukturalne):
MgCO3 - magnezyt
FeCO3 - syderyt
PbS - galena
ZnS - sfaleryt (blenda cynkowa)
Ag2S - argentyt
Cu2S - chalkozyn
PbSO4 - anglezyt
CaSO4 - anhydryt
Cu2O - kupryt
SiO2 - kwarc
Al2O3 - korund
Na3AlF6 - kriolit
Mn3O4 - hausmanit
Wodorowęglany:
Od kwasu H2CO3 (zabieramy jeden H i wstawiamy pierwiastek/ związek)
NaHCO3- sodu; Ca(HCO3)2- wapnia; Mg(HCO3)2- magnezu etc.
Energia jonizacji, energia potrzebna do jednostkowej jonizacji atomu, tzn. oderwania jednego elektronu z atomu. Energia jonizacji maleje ze wzrostem numeru okresu (większa odległość od jądra i słabsze siły przyciągania elektronu z powłoki walencyjnej) a generalnie (z licznymi wyjątkami, biorąc pod uwagę kolejne wartości) rośnie wraz ze wzrostem numeru grupy
Pytania z testów z ostatnich lat:
1. Aby rozróżnić roztwory wodne Al2(SO4)3 i MgSO4 wystarczy dysponować roztworem:
a) kwasu solnego b) kwasu azotowego (V)
c) wodorotlenku sodu d) chlorku baru
2. Dodając węglanu sodu (Na2CO3) do wody twardej można usunąć jony Ca2+ i Mg2+ stanowiące składniki:
a) wyłącznie wodorowęglanów
b) wodorowęglanów i siarczanów
c) wyłącznie siarczanów i chlorków
d) wszystkich soli
3. Wskaż prawdziwe zdania dotyczące litowców:
I) Łatwość przechodzenia atomów w kationy wynika z egzoenergetyczności tego procesu
II) Ze wzrostem liczby atomowej maleje elektroujemność atomów
III) Ze wzrostem liczby atomowej rośnie ich reaktywność
IV) Ze wzrostem liczby atomowej maleje ich temperatura topnienia
V) Ze wzrostem liczby atomowej rośnie ich gęstość
a) wszystkie b) wyłącznie I i II
c) wyłącznie II i III d) II, III, IV, V
4. Wskaż fałszywe zdanie dotyczące wodoru:
a) może występować na +1 i -1 stopniu utlenienia
b) ma najniższą temperaturę wrzenia
c) jest najbardziej rozpowszechniony we wszechświecie
d) ma trzy izotopy trwałe, w tym dwa naturalne
5. W których reakcjach nadtlenek wodoru jest reduktorem?
I) 3H2O2 + 2Cr(OH)3 + 4OH- → 2CrO42- + 8H2O
II) 5H2O2 + 2MnO4- + 6H+ → 5O2 + 2Mn2+ + 8H2O
III) 3H2O2 + Cr2O72+ + 8H+ → 3O2 + 2Cr3+ + 7H2O
IV) H2O2 + 2I- + 2H+ → 2H2O + I2
a) żadnej b) I i III c) II, III d) wszystkich
6. W czterech niezależnych doświadczeniach wrzucono do wody:
a) metaliczną miedź b) tlenek magnezu
c) nadtlenek baru d) metaliczny sód
w którym przypadku otrzymano produkt gazowy?
7. Tlenkiem (bezwodnikiem) kwasu azotowego (V) jest:
a) NO b) N2O3 c) NO2 d) N2O5
8. W wyniku rozkładu termicznego chlorku amonu powstają:
a) azot, chlor, wodór
b) azot, wodór i chlorowodór
c) chlor, wodór i amoniak
d) chlorowodór i amoniak
NH4Cl → NH3 + HCl
9. Które równanie reakcji wyjaśnia silna toksyczność gazowego siarkowodoru?
a) 2H2S + 3O2 → 2SO2 + 2H2O
b) H2S + Fe2+ → FeS + 2H+
c) H2S + H2O → HS- + H3O+
d) 2H2S + O2 → 2S + 2H2O
10. Wskaż fałszywe zdanie dotyczące kwasu azotowego:
a) w roztworze stężonym jest nietrwały i ulega rozkładowi fotochemicznemu
b) jest mocnym kwasem
c) jest silnym utleniaczem
d) dostatecznie stężony rozpuszcza wszystkie metale
11. Odporność metalicznego glinu na działanie stężonego kwasu azotowego (V) wynika z:
a) powstania na powierzchni glinu ochronnej warstewki nierozpuszczalnego Al(NO3)3
b) powstania na powierzchni glinu ochronnej warstewki nierozpuszczalnego Al2O3
c) dużej wartości nadpotencjału wydzielania wodoru na powierzchni glinu
d) położenia glinu w szeregu napięciowym
12. Twardość trwałą wody powodują:
a) CaCO3 i MgCO3 b) Fe(OH)3
c) Ca(HCO3)2 i Mg(HCO3)2 d) CaCl2 i MgCl2
13. Wskaż ciąg reakcji możliwych do bezpośredniego zrealizowania:
a) Na → Na2O2 → NaOH → NaHCO3 → Na2CO3 → NaCl
b) Na → NaOH → Na2O2 → NaCl → NaHCO3 → Na2SO4
c) Na → Na2SO4 → NaCl → Na2O2 → Na2O → NaOH
d) Na → NaHCO3 → Na2CO3 → Na2O2 → NaOH
14. Wskaż zdania fałszywe:
I) Aniony proste są zawsze reduktorami
II) Kationy proste są zawsze utleniaczami
III) Wodór cząsteczkowy jest zawsze reduktorem
IV) Atomy metali mają w związkach wyłącznie dodatnie stopnie utlenienia
V) Helowce występują wyłącznie na zerowym stopniu utlenienia
a) I, II b) wyłącznie II c) II, III, V d) wszystkie zdania są prawdziwe
15. Pierwiastek, którego atomy mają w związkach stopnie utlenienia od -2 do +6 należy do:
a) bloku energetycznego d b) okresu IV
c) grupy 16 d) pierwiastek taki nie istnieje
16. Wskaż prawdziwe dokończenie zdania: Tlenek węgla i dwutlenek węgla różnią się istotnie:
I) palnością II) toksycznością III) zapachem IV) barwą
V) właściwościami utleniająco- redukującymi
VI) właściwościami kwasowo- zasadowymi
a) wszystkie b) wyłącznie I, II, V, VI
c) wyłącznie I, II, III, V d) I, II, III, V, VI
17. Metan jest głównym składnikiem gazu:
a) koksowniczego b) ziemnego
c) syntezowanego d) do napełniania butli turystycznych
18. Wskaż prawdziwe zdania dotyczące ozonu:
I) stanowi główny składnik powietrza w stratosferze
II) tworzy się pod wpływem promieniowania nadfioletowego
III) jest rozkładany przez promieniowanie nadfioletowe
IV) pochłania promieniowanie nadfioletowe
V) jest niszczony głównie przez fluor zawarty we freonach
VI) jest niszczony głównie przez chlor i brom zawarty we freonach
a) I, II, IV, V b) I, II, IV, VI c) II, III, IV, V d) II, III, IV, VI
19. Które równania przedstawiają reakcje dysproporcjonowania?
I) 2H2O2 → 2H2O + O2
II) 4NH3 + 5O2 → 4NO + H2O
III) 6KClO → 5KCl + KClO3
IV) P + 5HNO3 → H3PO4 + 5NO2 + H2O
V) 3HNO2 → HNO3 + 2NO + H2O
a) I, II, III b) I, III, V c) II, IV, V d) I, II
20. Wskaż zdanie fałszywe: CaCO3 jest jedynym lub głównym składnikiem:
a) marmuru b) kredy c) gipsu d) wapieni
21. Glin na skale przemysłową otrzymuje się przez elektrolizę stopionego:
a) glinokrzemianu b) boksytu
c) chlorku glinu d) tlenku glinu
22. Wskaż fałszywe dokończenie zdania: diament i grafit różnią się:
a) przewodnością elektryczną b) produktami spalania w tlenie
c) twardością d) struktura krystaliczną
23. Wskaż fałszywe zdanie dotyczące fluorowców (z pominięciem astatu):
a) są niemetalami
b) w przyrodzie występują wyłącznie w postaci związanej
c) ich najtrwalszym stopniem utlenienia jest -1
d) wszystkie występują również na dodatnich stopniach utlenienia
24. Zielona patyna pokrywająca dachy zabytkowych budowli to:
a) uwodnione tlenki żelaza (III)
b) tlenek miedzi (II)
c) węglan wodorotlenek żelaza (III)
d) węglan wodorotlenek miedzi (II)
25. Wskaż zdanie fałszywe dotyczące cynku:
a) rozpuszcza się zarówno w roztworze NaOH jak i HCl
b) jest silnym reduktorem
c) wypiera energicznie gazowy wodór z wody
d) występuje wyłącznie na stopniu utlenienia +2
26. Rzeczywistymi substratami w procesie produkcji sody metoda Solvay'a są:
a) NaCl, NH3 i CaCO3 b) NaCl i CaCO3
c) NH4Cl, CO2 i H2O d) NH4HCO3 i NaCl
27. Chrom na +3 stopniu utlenienia:
a) tworzy wyłącznie kationy proste
b) tworzy wyłącznie aniony złożone
c) tworzy zarówno kationy proste jak i aniony złożone
d) jest wyłącznie reduktorem
28. Wskaż grupę związków wykazujących właściwości amfoteryczne:
a) Zn(OH)2 , Cr2O3 b) Al(OH)3 , CuO
c) KOH, Cr(OH)3 d) Cr2O3 , NaOH
29. Którą z wymienionych właściwości wykazuje stężony kwas siarkowy (VI):
a) ulega sublimacji b) jest higroskopijny
c) ma właściwości redukcyjne d) ma właściwości amfoteryczne
30. Z położenia azotu w układzie okresowym wynika, że jego atom w związkach nie może mieć stopnia utlenienia równego:
a) -3 b) +3 c) 4 d) +5
31. Wskaż zbiór pierwiastków o wzrastającej elektroujemności:
a) N, O, F b) Cl, S, P c) F, O, N d) Na, K, Rb
32. Podczas rozpuszczania w wodzie NaCl zachodzi proces:
a) dysocjacji elektrolitycznej b) solwatacji
c) hydrolizy d) dysocjacji elektrolitycznej i hydratacji
33. Rozpuszczono w wodzie następujące substancje:
I) BaO II) SO2 III) Na2CO3 IV) NH4Cl V) P2O5
Odczyn kwasowy mają roztwory substancji:
a) I, II, V b) II, IV, V c) III, IV d) wszystkich
34. Tlenki pierwiastków należących do bloku energetycznego d maja charakter:
a) wyłącznie zasadowy
b) zasadowy lub amfoteryczny
c) wyłącznie kwasowy
d) zasadowy, amfoteryczny lub kwasowy
35. Na schemacie produkcji HNO3 na skalę przemysłową wskaż wzory produktów pośrednich:
N2 → I → II → III → HNO3
a) NH3 (q) NH3 (aq) NH4Cl
b) NH3 (q) NO NO2
c) NO NO2 N2O3
d) NO NO2 N2O5
36. Które z niżej wymienionych właściwości są wspólne dla miedzi i cynku?
a) w reakcji z kwasami utleniającymi (HNO3 , stęż. H2SO4) oprócz soli i wody wydziela się SO2, NO lub NO2
b) w szeregu aktywności metali leżą na lewo od wodoru
c) w reakcji z kwasem solnym oprócz soli wydziela się wodór
d) wszystkie w/w właściwości są charakterystyczne dla miedzi i cynku
37. Gaz wodny jest to:
a) mieszanina CO2 i H2
b) mieszanina CH4 i H2O
c) mieszanina CO i H2
d) mieszanina H2 i O2
38. Wskaż zbiór reduktorów:
a) Fe, NO2 b) Fe3+ , MnO4-
c) Fe2+ , MnO4- d) O2- , Na+
39. Substancją stosowana w fotografice- w procesie utrwalania jest:
a) Na2SO4 b) Na2SO3 c) (NH4)2SO3 d) Na2S2O3
40. Kwasu solnego można użyć do otrzymywania:
a) chloru- w reakcji z K2Cr2O7
b) kwasu siarkowego- w reakcji z Na2SO4
c) siarkowodoru- w reakcji z FeS
d) chlorku srebra w reakcji z AgNO3
41. Wskaż, które zdanie dotyczące diamentu i grafitu nie jest prawidłowe:
a) grafit jest dobrym przewodnikiem prądu, a diament jest izolatorem
b) są względem siebie odmianami alotropowymi
c) są względem siebie izotopami
d) grafit jest miękki a diament twardy
42. Cecha charakterystyczna fluorowców to:
a) rosnąca aktywność chemiczna ze wzrostem liczby atomowej fluorowca
b) bardzo silne właściwości redukujące
c) najwyższa elektroujemność w poszczególnych okresach układu okresowego
d) ich jony proste mogą być tylko utleniaczami
43. Konfigurację elektronową 1s22s22p63s23p63d14s2 ma atom:
a) potasu b) wapnia c) skandu d) tytanu
44. Która z podanych niżej właściwości nie odnosi się do wodoru?
a) z azotem tworzy związek, którego wodny roztwór ma odczyn zasadowy
b) w związkach może występować tylko na +1 stopniu utlenienia
c) z chlorem i siarka tworzy związki, których wodne roztwory mają odczyn kwaśny
d) z tlenem tworzy związek, który może być utleniaczem i reduktorem
45. Kriolit w procesie otrzymywania glinu:
a) reaguje z produktami wydzielającymi się na anodzie
b) reaguje z tlenkiem glinu ułatwiając proces elektrolizy
c) spełnia rolę katody
d) spełnia rolę topnika obniżając temperaturę topnienia tlenku glinu
46. Wskaż zbiór tlenków będących wyłącznie tlenkami zasadowymi:
a) K2O, CO2, MgO b) Na2O, CaO, CO
c) Na2O, CaO, MgO d) Na2O, SiO2, CuO
47. Woda królewska to mieszanina stężonych kwasów:
a) H2SO4 i HCl w stosunku molowym 3:1
b) HNO3 i HCl w stosunku molowym 3:1
c) HNO3 i HCl w stosunku molowym 1:3
d) H2SO4 i HCl w stosunku molowym 1:3
48. Proces destylacji frakcyjnej wykorzystuje się do otrzymywania tlenu z:
a) wody b) nadtlenku wodoru c) powietrza d) nadmanganianu potasu
49. Chrom i mangan tworzą między innymi następujące tlenki: CrO3 i Mn2O7. Tlenki te maja następujące właściwości:
a) oba są tlenkami zasadowymi
b) oba są tlenkami amfoterycznymi
c) oba są tlenkami kwasowymi
d) CrO3 to tlenek zasadowy, a Mn2O7 to tlenek kwasowy
50. Jeżeli do wodnego roztworu azotanu cynku lub azotanu miedzi dodamy wodny roztwór NaOH, to:
a) powstanie bały osad (w przypadku azotanu cynku) i osad bladoniebieski (w przypadku azotanu miedzi)
b) przy dodaniu roztworu NaOH w nadmiarze osady o których mowa w punkcie „a” ulegną całkowitemu rozpuszczeniu
c) nie stwierdzimy żadnych objawów reakcji
d) powstanie biały osad zarówno w przypadku azotanu cynku jak i azotanu miedzi
51. Energia jonizacji:
a) w obrębie okresu na ogół wzrasta ze wzrostem liczby atomowej pierwiastka
b) w obrębie okresu maleje ze wzrostem liczby atomowej pierwiastka
c) w obrębie grupy rosnie wraz ze wzrostem liczby atomowej
d) jest to energia, która zostaje wydzielona w wyniku oderwania elektronu od atomu
52. W poniższym szeregu metali:
K, Ca,…Zn, Fe,… Sn, Pb, ...H, ...Cu, Hg, Ag, Au → w kierunku oznaczonym strzałką następuje:
a) wzrost charakteru zasadowego tlenków
b) wzrost reaktywności metali
c) zmniejszenie zdolności przyłączania elektronów
d) zmniejszenie mocy wodorotlenków
53. Wybierz zdanie prawdziwe:
a) po zakwaszeniu jony CrO42- przekształcają się w jony Cr2O72-
b) związki Cr (II) maja charakter kwaśny
c) chromiany i dwuchromiany wykazują właściwości redukujące
d) wodne roztwory związków Cr (VI) maja barwę zieloną
54. W metodzie kontaktowej produkcji kwasu siarkowego stosuje się jako katalizator:
a) żelazo z dodatkiem tlenku glinu
b) tlenek azotu
c) pięciotlenek wanadu
d) dwutlenek azotu
55. Wskaż równanie reakcji przedstawiające proces usuwania twardości przemijającej na drodze gotowania:
a) Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
b) MgCO3 + H2O + CO2 → Mg(HCO3)2
c) CaCO3 + H2O + CO2 → Ca(HCO3)2
d) Ca(HCO3)2 → CaCO3 + H2O + CO2
56. Chcąc uzyskać maksymalną wydajność procesu syntezy amoniaku należy proces prowadzić:
a) pod zwiększonym ciśnieniem i w temperaturze 400- 500°C
b) pod ciśnieniem 1013 hPa i w możliwie niskiej temperaturze
c) pod ciśnieniem 1013 hPa i w możliwie wysokiej temperaturze
d) pod zwiększonym ciśnieniem i w temperaturze 2000°C
57. Bezbarwny gaz o nieprzyjemnym, przenikliwym zapachu powstanie w wyniku reakcji:
a) Mg + HCl b) FeS + HCl
c) Ca + H2O d) Na + H2O
58. Utleniaczami nie mogą być:
a) atomy niemetali występujące w związkach na dodatnich stopniach utlenienia
b) atomy metali w stanie wolnym
c) atomy niemetali występujące w stanie wolnym
d) jony metali, które przyłączają elektrony przejdą w atomy
59. Liczba powłok elektronowych, (tj. główna liczba kwantowa) decyduje o przynależności pierwiastka do:
a) określonej grupy głównej
b) bloku s, p lub d
c) określonego okresu
d) żadne z powyższych stwierdzeń nie jest słuszne
60. Proces otaczania się jonów cząsteczkami wody nazywamy:
a) dysocjacja b) hydratacją
c) solwatacją d) hydrolizą
61. Spośród pierwiastków drugiego okresu należących do bloku p hybrydyzacji ulegają:
a) wszystkie za wyjątkiem neonu
b) tylko azot, tlen i fluor
c) tylko beryl, bor i węgiel
d) tylko bor i węgiel
62. Produktami spalania amoniaku metodą Ostwalda są:
a) azot i woda
b) tlenek azotu i woda
c) dwutlenek azotu i woda
d) tlenek azotu i wodór
63. Która z podanych poniżej reakcji jest (praktycznie) nieodwracalna?
a) N2 + 3H2 → 2NH3
b) CH3COOH → CH3COO- + H+
c) Ag+ + Cl- → AgCl (↓)
d) H2 → 2H
64. Z nadmanganianu potasu można otrzymać tlen:
a) podczas termicznego rozkładu
b) w reakcji z nadtlenkiem wodoru w środowisku kwaśnym
c) w reakcji z nadtlenkiem wodoru w środowisku zasadowym
d) w reakcji ze stężonym kwasem solnym
65. Ilości jednostek wagowych tlenu przypadające na taką samą liczbę jednostek wagowych manganu w tlenkach manganu: MnO, Mn2O3, MnO2, Mn2O mają się do siebie jak następujące liczby całkowite:
a) 2: 3: 4: 7 b) 1: 3: 2: 7 c) 2: 3: 4: 7 d) 1: 2: 3: 5
66. Który zbiór atomów i jonów posiada jednakową konfigurację elektronową?
a) Ca-2 , S-2 b) K- , Na c) Br-- , Kr d) Mg-2 , Na-
67. Stwierdzenie: „Roztwór nasycony pozostaje w równowadze z osadem” oznacza, że:
a) stężenia anionów i kationów w roztworze są równe
b) ilości substancji w roztworze i osadzie są sobie równe
c) szybkość wydzielania się osadu i szybkość jego rozpuszczania są sobie równe
d) żadna z powyższych odpowiedzi nie jest prawidłowa
68. Wodorotlenek miedzi otrzymuje się działaniem:
a) wodą na miedź
b) wodą na Cu2O
c) wodą na CuO
d) dowolnej, rozpuszczalnej w wodzie soli miedzi (II) na wodny roztwór zasady
69. W którym z poniżej podanych przykładów oba wodorotlenki mają charakter amfoteryczny?
a) Ca(OH)2 i Pb(OH)2 b)Al(OH)3 i Bi(OH)3
c) Ca(OH)3 i Zn(OH)2 d) Sn(OH)2 i Sb(OH)3
70. Osmoza jest to:
a) dyfuzja cząsteczek rozpuszczalnika poprzez błonę półprzepuszczalną
b) dializa
c) dyfuzja w fazie gazowej
d) dyfuzja cząsteczek substancji rozpuszczonej poprzez błonę półprzepuszczalna
71. Jeżeli związek chemiczny po rozpuszczeniu w wodzie przewodzi prąd elektryczny to znaczy, że posiada:
a) wyłącznie wiązanie jonowe
b) wyłącznie wiązanie atomowe niespolaryzowane
c) wyłącznie wiązanie atomowe spolaryzowane
d) wiązanie jonowe lub atomowe spolaryzowane
72. Chlor można otrzymać:
a) w wyniku elektrolizy chlorków
b) w wyniku utlenienia kwasu solnego np. nadmanganianem potasu
c) w wyniku rozpuszczania NaCl w wodzie
d) wszystkimi sposobami wymienionymi wyżej
73. Dwutlenek manganu wykazuje słabe właściwości amfoteryczne i reagując:
a) z kwasem solnym ulega redukcji do Mn-2
b) z ługami utlenia się do jonu MnO4-
c) z ługami utlenia się do jonu MnO4-2
d) z H2SO4 nie zmienia wartościowości
74. Dwutlenek siarki tworzy się:
a) podczas spalania siarki
b) w wyniku prażenia w powietrzu pirytu FeS2
c) w reakcji stężonego H2SO4 z metaliczna miedzią
d) wszystkie podane wyżej zdania są prawdziwe
75. Jeżeli roztwór pozostaje w równowadze z osadem AgCl to dodanie do niego NH3∙H2O spowoduje:
a) wzrost stężenia jonów Ag+ w roztworze
b) że stężenie jonów Cl- w roztworze nie ulegnie zmianie
c) że stężenie jonów Ag+ w roztworze zmniejszy się
d) zmianę wartości iloczynu rozpuszczalności AgCl
76. W której z niżej podanych reakcji tlen spełnia rolę utleniacza i reduktora?:
a) Na2O2 + H2O → NaOH + H2O2
b) CrO2- + H2O2 + OH- → CrO42- + H2O
c) H2O2 → H2O + O2
d) w żadnej reakcji
77. W którym z poniższych przypadków zajdzie reakcja chemiczna?
a) Cl2 + KBr b) Br2 + NaCl c) I2 + KCl d) Br2 + NaF
78. Tlenek węgla i dwutlenek węgla można odróżnić:
a) po zapachu b) próbując go zapalić
c) po barwie d) wprowadzając go do wody wapiennej (Ca(OH)2)
79. Które z niżej wymienionych właściwości są wspólne dla miedzi i cynku?
a) ich wodorotlenki roztwarzają się w amoniaku dając związki kompleksowe
b) w szeregu aktywności metali leżą na prawo od wodoru
c) każdy z tych metali wykazuje w związkach chemicznych stałą wartościowość
d) należą do bloku d
80. Które zdanie dotyczące litowców jest nieprawdziwe?:
a) przejście litowców w stan jonowy wymaga nakładu energii
b) elektrony walencyjne znajdują się tylko na podpoziomie s
c) ze wzrostem liczby atomowej wzrasta charakter elektrododatni pierwiastka
d) litowce w związkach chemicznych występują na różnych stopniach utlenienia
81. Dysocjacja elektrolityczna w wodnym roztworze zachodzi pod wpływem:
a) hydrolizy b) cząsteczek wody
c) prądu elektrycznego d) innych elektrolitów
82. Które z wymienionych reakcji są reakcjami homogenicznymi?
a) SO2 + ½ O2 → SO3
b) C + O2 → CO2
c) H2 + Cl2 → 2HCl
d) Ba+2 + SO42- → BaSO4
83. Katalizatory to substancje, które:
a) zmniejszają energię aktywacji
b) zwiększają szybkość reakcji
c) wpływają na stan równowagi reakcji
d) zwiększają energię aktywacji
84. Cynk otrzymuje się:
a) przez elektrolizę stopionego ZnO
b) przez elektrolizę wodnego roztworu ZnSO4
c) przez redukcję ZnO za pomocą węgla lub CO
d) metodami wymienionymi punktach b i c
85. Który z poniżej wymienionych tlenków chloru jest mieszanym bezwodnikiem kwasowym?
a) Cl2O b) ClO2 c) ClO3 d) Cl2O7
86. Roztwory manganianów nie są trwałe w środowisku:
a) kwaśnym i rozkładają się do MnO4- oraz MnO2
b) obojętnym i rozkładają się do MnO4- i Mn2+
c) zasadowym
d) odpowiedzi a i b nie są prawidłowe
87. W 5 grupie układu okresowego występują pierwiastki:
a) N, P, Sn, Sb, Bi
b) N, P, As, Sb, Bi
c) N, P, As, Pb, Bi
d) N, P, As, Se, Te
88. Reakcja hydrolizy jest:
a) wynikiem dysocjacji mocnego kwasu lub zasady w roztworze wodnym
b) reakcją nieodwracalną
c) reakcją między anionami mocnego kwasu lub kationami mocnej zasady pochodzącymi z dysocjacji soli a cząsteczkami wody
d) przykładem procesu kwasowo-zasadowego zachodzącego pomiędzy cząsteczkami wody a jonami stanowiącymi kwas lub zasadę w świetle teorii Lowry'ego i Bronsteda
89. Który z poniższych pierwiastków wykazuje stałą (tj, taką samą) wartościowość, zarówno w związkach z metalami jak i niemetalami?
a) azot b) siarka c) chlor d) fluor
90. Który z wymienionych pierwiastków nie tworzy prostych jonów dodatnich ani ujemnych, a może wchodzić tylko w skład anionów złożonych?
a) Mg b) Al c) C d) S
91. Które z wymienionych kationów Mg+2 , Al+3 , Ba+2 , Cr+3 , Fe+2 tworzą się wyłącznie w wyniku utraty elektronów z podpowłoki s oraz p?
a) wszystkie wymienione jony trójdodatnie
b) tylko kation glinu
c) kation magnezu i kation baru
d) wszystkie wymienione wyżej kationy
92. W procesie elektrolitycznego otrzymywanie glinu (ze stopionego Al2O3) anodę stanowi:
a) stopiony glin b) płyty grafitowe
c) żelazo (wanna żelazna) d) cynk
93. Które z niżej podanych właściwości są charakterystyczne dla berylowców?
W miarę wzrostu liczby atomowej:
a) maleje aktywność metalu b) wzrasta moc zasady
c) rośnie szybkość reakcji z wodą d) maleje charakter elektrododatni
94. Wskaż parę soli ulegających hydrolizie:
a) KCl, (NH4)2SO4 b) NH4NO3 , Na2SO4
c) AlCl3 , CH3COONH4 d) Na2CO3 , KNO3
95. Wybierz poprawne zdanie:
a) w roztworach zasadowych jony CrO42- przekształcają się w jony Cr2O72-
b) po zakwaszeniu jony CrO42- przekształcają się w jony Cr2O72-
c) chromiany i dwuchromiany wykazują właściwości utleniające
d) związek chromu ulega utlenieniu jeżeli zmienia barwę z żółtej na pomarańczową
96. Które zdanie jest prawdziwe?
a) dysocjacja kwasu siarkowodorowego jest dwustopniowa
b) siarkowodór łatwo rozpuszcza się w wodzie dając słaby kwas
c) utleniając siarkowodór można otrzymać SO2 lub S
d) wszystkie podane wyżej zdania są prawdziwe
97. Podczas prażenia NaHCO3 w temperaturze około 180°C związek ten ulega rozkładowi wydzielając między innymi dwutlenek węgla. Proces ten ma miejsce przy produkcji sody metoda Solvay'a i nazywa się:
a) absorpcja b) karbonizacja
c) kalcynacja d) destylacja
98. Która z poniższych właściwości chemicznych nie odnosi się do kwasu azotowego?
a) jest kwasem mocnym b) ma silne właściwości utleniające
c) ma silne właściwości redukujące d) stężony kwas ulega rozkładowi na świetle
99. Superfosforat podwójny otrzymuje się na skalę przemysłową w reakcji:
a) fosforytów ( Ca3(PO4)2 ) z kwasem siarkowym
b) fosforytów w reakcji z kwasem ortofosforowym
c) kwasu ortofosforowego z mlekiem wapiennym
d) pięciotlenku fosforu z wodą
100. Wskaż fałszywe zdanie dotyczące litowców:
a) w związkach występują wyłącznie na +1 stopniu utlenienia
b) wypierają wodór z wody
c) reagują z tlenem zawartym w powietrzu w temperaturze pokojowej
d) wszystkie ich sole są bezbarwne
101. Wskaż prawdziwe dokończenie zdania: w grupie berylowców w miarę wzrostu liczby atomowej:
a) maleje aktywność chemiczna metali
b) wzrasta szybkość wypierania wodoru z wody
c) maleje moc wodorotlenków
d) maleje charakter zasadowy tlenków
102. Wskaż minerał zawierający magnez:
a) dolomit b) gips c) kreda d)anhydryt
103. Głównymi składnikami kamienia kotłowego są:
a) Ca(HCO3)2 i Mg(HCO3)2 b) Fe(OH)3 i Fe2O3
c) CaCO3 i MgCO3 d) CaO i MgO
104. W elektrolizerze do otrzymywania glinu anodę stanowi:
a) stały glin b) stopiony glin
c) masa węglowa d) blacha żelazna
105. Kriolit w procesie otrzymywania glinu:
a) reaguje z tlenkiem glinu tworząc nietrwały związek, z którego wydziela się glin
b) chroni wydzielony glin przed utlenieniem
c) obniża temperaturę topnienia elektrolitu
d) podwyższa temperaturę topnienia elektrolitu
106. Wskaż zdanie fałszywe:
a) węglowce wykazują skłonność do tworzenia hybrydyzowanych wiązań typu sp3
b) węgiel występuje w związkach na stopniach utlenienia od -4 do +4
c) najtrwalszym stopniem utlenienia ołowiu jest +2
d) węgiel występuje w dwóch odmianach alotropowych
107. Surowcami do otrzymywania szkła „okiennego” (zwykłego) jest piasek kwarcowy oraz:
a) soda i wapień b) tlenek sodu i wapno palone
c) tlenek glinu d) soda i tlenek glinu
108. Reakcja ditlenku azotu z wodą, w wyniku której tworzy się kwas azotowy (V), to:
a) hydroliza b) zobojętnienie
c) dysproporcjonowanie d) utlenianie
109. Wskaż fałszywe zdanie dotyczące fosforu czerwonego:
a) nie fosforyzuje w atmosferze powietrza
b) ulega samozapłonowi na powietrzu
c) jest nietoksyczny
d) nie rozpuszcza się w wodzie
110. Superfosforat pojedynczy otrzymuje się działając:
a) kwasem fosforowym (V) na wapień
b) pięciotlenkiem dwufosforu na wapno palone
c) kwasem siarkowym (VI) na fosforyty
d) kwasem fosforowym (VI) na fosforyty
111. Tlen na skalę techniczną otrzymuje się przez:
a) elektrolizę wodnych roztworów wodorotlenków litowców
b) rozkład termiczny nadtlenku baru
c) rozkład termiczny chloranu (V) potasu
d) destylację frakcyjna skroplonego powietrza
112. Wskaż fałszywe zdanie dotyczące siarkowodoru
a) jest gazem średnio rozpuszczalnym w wodzie
b) w roztworze wodnym tworzy słaby kwas dwuzasadowy
c) jest toksyczny
d) anion HS- jest utleniaczem, natomiast S2- reduktorem
113. Wskaż fałszywe zakończenie zdania: Kwas siarkowy (VI) otrzymuje się na skalę przemysłową z:
a) rodzimej siarki b) siarczanu (VI) żelaza
c) siarczanu (VI) cynku d) siarczanu (VI) sodu
Analiza jakościowa (wykrywanie kationów i anionów) - przepis :)
KATIONY:
Gr.I. Ag+ , Pb2+
Gr.II. Ba2+
Gr.III. Cu2+ , Cd2+ , Sb3+
Gr.IV. Al3+ , Cr3+ , Fe3+ , Mn2+ , Zn2+
Gr.V. Mg2+ , K+
Kolejne czynności:
1. Zobaczyć czy badana próbka ma kolor. Jeśli jest niebieska to jest to Cu2+
2. Jeśli nie było koloru: odlewamy z próbówki głównej część a i dodajemy HCl:
- jeśli jest biały osad i:
- rozpuszcza się w ciepłej H2O to jest to Pb2+
- rozpuszcza się w NH4OH to jest to Ag+
- jeśli nie ma osadu lecimy dalej :)
3. Odlewamy b i dodajemy H2SO4. Jeśli jest biały osad to jest to Ba2+.
Jak nie ma osadu- lecimy dalej.
4. Trzy próbówki - odlewamy c1, c2, c3, dodajemy do każdej NaOH.
- niebieski osad oznacza Cu, szaro-fioletowy oznacza Cr.
- jeśli osad jest biały i:
- po chwili ciemnieje, to jest to Mn
- jak nie ciemnieje dodajemy do c2 NH4Cl- jeśli osad się rozpuści- jest to Mg.
- jeśli dwie pierwsze opcje zawiodły- dodajemy jeszcze więcej NaOH do próbówki c3. Jeśli osad nie rozpuszcza się w nadmiarze NaOH to jest to Cd. Jeśli się rozpuszcza- Sb, Al albo Zn. Aby sprawdzić który to kation z tych trzech…
5. Pobieramy d i dolewamy NH4OH. Powstaje biały osad. Jeśli rozpuści się w nadmiarze amoniaku- jest to Zn. Jeśli nie- jest to Al lub Sb. Sb hydrolizuje, więc pobierz jeszcze trochę z próbówki głównej i sprawdź czy zachodzi hydroliza. Jeśli nie- jest to glin :)
ANIONY:
CO32- , NO3- , S2O32- , Cl- , CO32- , SO42- , C2O42-
Pobieramy do każdej próby po trochę badanego r-ru.
1.Dodajemy H2SO4:
- jeżeli są pęcherzyki jak w wodzie gazowanej- jest jon CO32-
- jeżeli ulatnia się czerwonobrunatny gaz- NO3- (słabo go widać, ten gaz!)
- jeżeli r-r zmętnieje - S2O32-
2. Dodajemy H2SO4 (zakwaszamy) + KMnO4 ( w ten sposób badamy na obecność anionów redukujących).
- odbarwia się od razu- S2O32. Jeśli odbarwia się dopiero na ciepło- dość szybko, to jest to Cl-, jeżeli na ciepło, ale powoli- C2O42-
3. Dodajemy dwufenyloaminę (z stęż. H2SO4)- jeśli powstaje niebieska obrączka na granicy faz- NO3- (jon utleniający).
4. Negatywny wynik w pkt.2 i 3 wskazuje na obecność anionów obojętnych: CO32- , SO42-
7
NaHCO3- wodorowęglan sodu
NH4Cl- chlorek amonu
CrO- = [Cr(OH)6]3-
NaCrO2 - chromian (III) sodu
Wyszukiwarka
Podobne podstrony:
Ogniwa - skrot, Nauka, Chemia, Chemia nieorganiczna
zelazo chrom mangan, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
reakcje w roztworach maturalne, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
miedź, Nauka, CHEMIA, Szkoła, Chemia Nieorganiczna
CHEMIA NIEORGANICZNA 2
Chemia nieorganiczna zadania 4 Nieznany
Chemia nieorganiczna zadania 7 Nieznany
KationyV, Farmacja, I rok, Chemia nieorganiczna
kinetyka, studia, ochrona środowiska UJ, chemia ogólna i nieorganiczna, wyrównawcze
KARBOKSYLOWE KWASY, Nieorganiczna, chemia, chemia - liceum, chemia - liceum, lekcja
egz 2010-pytania spisane(1), Chemia nieorganiczna- egzmain
Tlenowce(1), Chemia, Chemia nieorganiczna
chemia10, NAUKA, chemia, lab
Opis(11), Nauka, Chemia
testy chemia2, Biotechnologia PŁ, chemia nieorganiczna
Szkoło labolatoryjne i jego przeznaczenie nieorganiczne, CHEMIA
Zadania egzaminacyjne 2003, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1, studia 1.2,
więcej podobnych podstron