Olsztyn, dnia 14.12.2006
Sprawozdanie z ćwiczenia nr 57
Pomiar widma absorpcji i stężenia ryboflawiny w roztworach wodnych
za pomocą spektrofotometru.
Światło (promienie optyczne) w spektroskopii jest to przedział długości fal elektromagnetycznych widzialnych (Vis) oraz podczerwień (IR) i ultrafiolet (UV).
Zmiana natężenia światła (-dl) podczas przejścia przez warstwę o dowolnie małej grubości dl w roztworze, w którym stężenie molowe substancji pochłaniającej wynosi c, wyraża się wzorem:
![]()
~![]()
![]()
gdzie:
![]()
- współczynnik absorpcji
Względne osłabienie światła wyraża się wzorem:
![]()
Natężenie I światła po przejściu przez kuwetę:
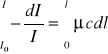
![]()
Jest to prawo Lamberta Beera, które mówi, że natężenie światła przechodzącego przez roztwór substancji absorbującej zależy od natężenia światła padającego (I0), stężenia roztworu (c) i grubości warstwy (l) oraz od współczynnika absorpcji (μ). Współczynnik absorpcji jest wielkością charakteryzującą właściwości absorpcyjne substancji. μ jest funkcją długości fali światła pochłoniętego.
Prostszy zapis prawa absorpcji otrzymuje się po logarytmowaniu wzoru:
![]()
czyli:
![]()
Wprowadzając oznaczenia:
![]()
(absorbancja)
oraz ![]()
(molowy współczynnik absorbancji)
Należy zapisać:
![]()
Absorbancja - inaczej ekstynkcja (E) lub gęstość optyczna (D). Oznaczana symbolem A lub E. Stosunek natężeń wiązek świetlnych można łatwo zmierzyć, dlatego A jest podstawową wielkością optyczną.
Molowy współczynnik absorpcji (ε) - inaczej współczynnik absorpcji (μ) - jest równy absorbancji warstwy roztworu o jednostkowej grubości i jednostkowym stężeniu.
Transmitancja T - wyrażona w %
![]()
Związek między T a A jest następujący:
![]()
Substancje w różny sposób absorbują światło o różnej częstotliwości, dlatego ε jest funkcją częstotliwości ν lub inaczej długości fali λ
ε(ν); ε(λ)
gdzie: ![]()
c - prędkość światła
Widmo absorpcji - zależność ε od długości fali lub częstotliwości; jest charakterystyczne dla danej substancji w danych warunkach fizykochemicznych.
Podany związek między absorbancją (A) i molowym współczynnikiem absorpcji ε
![]()
jest znany jako prawa Bouguera-Lamberta-Beera.
Za pochłanianie fal optycznych w zakresie widzialnym i ultrafioletowym są odpowiedzialne głównie elektrony walencyjne, czyli tzw. elektrony π i σ. Są to widma elektronowe.
W spektroskopii molekularnej oprócz czterech liczb kwantowych (n, l, m, s), wprowadza się nową liczbę kwantową λ opisującą elektron w cząsteczce. Jeżeli stan elektronu jest opisany liczbą kwantową λ=0 nazywa się go elektronem σ, dla λ=1 mamy elektron π.
Pod wpływem kwantów świetlnych ulega zmianie energia elektronów π i σ cząstki (Ee), energia oscylacji (Eosc) atomów w cząsteczce i energia rotacji cząsteczki bądź grup atomów w cząsteczce (Erot). Energie te są skwantowane, czyli mogą przyjmować tylko ściśle określone wartości.
Podczas pochłaniania światła przez cząsteczki zachodzą zmiany energii elektronów, energii oscylacji i rotacji.
![]()
Podczas absorpcji światła cząsteczki mogą przejść do wyższych stanów oscylacyjnych i rotacyjnych elektronowego stanu wzbudzonego, dlatego absorpcji ulega nie jeden rodzaj kwantów (linia absorpcji) lecz zbiór różnych kwantów pochłanianych w różnej ilości przez substancję, czyli pasmo absorpcji.
Widma absorpcji związków organicznych w roztworach składa się zazwyczaj z kilku pasm w zakresie fal widzialnych i ultrafioletowych
![]()
I pasmo absorpcji
![]()
II pasmo absorpcji
![]()
III pasmo absorpcji
Wielkością charakteryzującą pasmo absorpcji jest długość fali ![]()
odpowiadająca max wartości współczynnika absorpcji danego pasma. Wartość ![]()
określa położenie pasm absorpcji w skali długości fal, charakterystyczne dla danej substancji.
Spektrometry - przyrządy do pomiaru absorpcji, za ich pomocą można zmierzyć absorbancję badanej substancji w zależności od długości fali światła absorbowanego.
Absorpcję światła widzialnego i ultrafioletu przez cząsteczki wykorzystuje się w badaniach biologicznych i technologicznych do:
analizy substancji - na podstawowe położenie max pasm absorpcji można identyfikować substancję absorbującą oraz wnioskować o tych parametrach określających strukturę substancji, które są związane z elektronami π i σ.
analizy ilościowej - (spektrofotometria absorpcyjna lub metoda kalorymetryczna) - z wartości A wyznacza się stężenie substancji
Dualizm korpuskularno-falowy - zjawisko polegające na tym, że światło ma dwojaki charakter w pewnych zjawiskach występuje jako fala, a w innych jako strumień fotonów.
Teoria kwantowa:
- kwant to inaczej porcja
- w przyrodzie wielkością występującą w postaci porcji jest energia, wyróżniamy kwanty energii mechanicznej, elektrycznej, jądrowej
- foton jest to kwant energii świetlnej (porcja światła)
- symboliczne przedstawienie fotonu
Lp. |
λ (nm) |
E (A) |
T |
|
|
|
|
2
Wyszukiwarka
Podobne podstrony:
sprawozdanie 36, Biotechnologia, Fizyka i biofizyka
Fizyka - sprawozdanie 49, Biotechnologia, Fizyka, Labolatorium
2, Biotechnologia, Fizyka i biofizyka
40 Wpływ oporu, Biotechnologia, Fizyka i biofizyka
Fizyka - sprawozdanie 50, Biotechnologia, Fizyka, Labolatorium
cechowanie termoogniwa i wyznaczanie za jego pomocÄ… temp, Biotechnologia, Fizyka i biofizyka
Elektronika - Sprawozdanie z prostowników 2, Biotechnologia, Fizyka, Labolatorium
Fizyka - sprawozdanie 49, Biotechnologia, Fizyka, Labolatorium
2, Biotechnologia, Fizyka i biofizyka
Sprawozdanko, Biotechnologia i, Rok I, Fizyka i biofizyka, fiza
Gęstość sprawozdanie 2.4, Biotechnologia i, Rok I, Fizyka i biofizyka
Sprawozdanie22, Biotechnologia i, Rok I, Fizyka i biofizyka
fiza tematy cw, Biotechnologia i, Rok I, Fizyka i biofizyka
fiza2;4, Biotechnologia i, Rok I, Fizyka i biofizyka
fiz36, Biotechnologia i, Rok I, Fizyka i biofizyka
Informacje Ogolne - fizlab biotechnologia 2008, biofizyka, Fizyka i Biofizyka
pytania z fizyki, Biotechnologia i, Rok I, Fizyka i biofizyka, pytania z fizyki
FIZYKA-sprawozdania, 57,74
więcej podobnych podstron