GRUPA NR: 22 ZESPÓŁ: 3 |
ĆWICZENIE NR: 7
Współczynnik podziału słabego kwasu pomiędzy fazą wodną a organiczną
|
DATA WYKONANIA ĆWICZENIA: 21.04.2008 r.
|
ZESPÓŁ: 1. Katarzyna Góral 2. Joanna Grzywacz 3. Karolina Paśko 4. Kinga Poźniak
|
|
OCENA
|
Część teoretyczna
Prawo podziału sformułowane przez Waltera H. Ernsta opisuje układ trójskładnikowy, z czego dwa składniki to rozpuszczalniki i ograniczonej rozpuszczalności wzajemnej (nie mieszające się ze sobą), a trzeci to substancja stała, ciekła lub gazowa dobrze rozpuszczająca się w obydwóch poprzednich. W warunkach równowagi termodynamicznej, w stałej temperaturze i przy stałym ciśnieniu, stosunek aktywności (stężeń) rozpuszczonej substancji w obydwóch rozpuszczalnikach jest wielkością stałą zwaną współczynnikiem podziału.
Zależność powyższą można wyprowadzić z warunku równowagi termodynamicznej, to jest z równości potencjałów chemicznych 
substancji rozpuszczonej C w obydwóch fazach ciekłych, Jeśli oznaczymy je literami α i β, to warunek równowagi można przedstawić w postaci zapisu:
![]()
Rozwijając powyższe równanie o zależność potencjału chemicznego od aktywności substancji rozpuszczonej otrzymujemy:
![]()
gdzie:
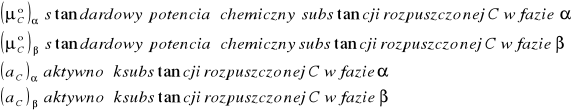
Stąd można wyliczyć stosunek aktywności substancji C w obydwóch fazach:
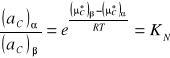
Współczynnik podziału KN jest wartością stałą w danej temperaturze pod warunkiem, gdy stan cząsteczkowy substancji rozpuszczonej jest w obydwóch fazach jednakowy.
Wartość współczynnika podziału nie zależy od aktywności substancji rozpuszczonej, jest natomiast cechą charakterystyczną dla danego układu trójskładnikowego zależną od temperatury i ciśnienia. Zjawiska dysocjacji i asocjacji wpływają na wartość współczynnika podziału substancji rozpuszczonej i należy uwzględnić ich przebieg w układzie.
Ekstrakcja
Metoda rozdziału substancji składników roztworu, w której wykorzystuje się różnicę w rozpuszczalności związków chemicznych w dwóch nie mieszających się cieczach. Zastosowany rozpuszczalnik do wydzielenia pożądanego składnika to ekstrahent, a otrzymany roztwór tego rozpuszczalnika to ekstrakt. Pozostałe składniki to rafinaty. Wyodrębnianie z ciał stałych lub mieszanin związków chemicznych polega na płukaniu uch rozpuszczalnikiem. W trakcie ekstrakcji zachodzi fizyczny proces absorpcji i desorbcji, powodujący przenikanie cząstek rozdzielonego związku do rozpuszczalnika.
Wyszukuje się także rozpuszczalniki, które selektywnie absorbują jeden związek, a nie absorbują innych.
Cel ćwiczenia
Na podstawie miareczkowania kwasu w fazie ksylenowej wyznaczyć graficznie współczynnik podziału kwasu między fazą wodną a ksylenową oraz stałą równowagi asocjacji kwasu w fazie ksylenowej.
Wykonanie ćwiczenia
Na wadze analitycznej odważono trzy naważki kwasu benzoesowego o masach m1=0,0209, m2=0,1879, m3=0,4982.
Napełniono każdy z 3 rozdzielaczy 25 cm3 ksylenu. Naważki kwasu benzoesowego przeniesiono ilościowo do rozdzielaczy. Ostrożnie mieszając rozpuszczono kwas w ksylenie.
Do każdego rozdzielacza dodano po 35 cm3 wody destylowanej.
Wytrząsano zawartość rozdzielaczy przez ok. 10 min. doprowadzając do rozdziału kwasu benzoesowego między wodę, a ksylen.
Odstawiono rozdzielacze do statywu i po kilku minutach, gdy obydwie warstwy cieczy stały się klarowne, oddzielono fazę wodną od ksylenu wypuszczając ją z rozdzielacza do zlewki.
Oznaczono stężenie kwasu benzoesowego w fazach wodnych przez miareczkowanie 0,01 M roztworem NaOH wobec fenoloftaleiny. Do miareczkowania pobrano po dwie próbki fazy wodnej w ilości 5cm3 i dodano do nich po 25 cm3 wody.
Oznaczanie warwy ksylenowej wykonywano w ten sam sposób z tą różnicą, że pobrano 2 cm3 roztworu.
Opracowanie wyników
Naważki kwasu |
cI [mol/l] |
cII [mol/l] |
cI(1-α) |
cII / cI |
cII / (cI (1-α)) |
0,0209 |
3,43·10-4 |
9,60·10-4 |
2,23·10-4 |
2,80 |
4,30 |
0,1879 |
1,10·10-3 |
4,76·10-3 |
8,65·10-4 |
4,33 |
5,50 |
0,4982 |
1,97·10-3 |
1,05·10-2 |
1,65·10-3 |
5,33 |
6,36 |
Stała dysocjacji kwasu benzoesowego w temp. 20°C wynosi: Kdys = 6,40 ·10-5
Współczynnik podziału Nernsta KN kwasu benzoesowego pomiędzy wodę i ksylen oraz wartość stałej asocjacji Kdim wyznaczyć graficznie z wykresu
Na podstawie współczynników a i b funkcji ![]()
możemy wyznaczyć KN i Kdim
![]()
![]()
![]()
y = a x + b
Z załączonego wykresu odczytujemy:
KNernsta= 0,245
KDimeryzacji=43,99
Wnioski
W wyniku doświadczenia otrzymaliśmy współczynnik podziału Ernsta KN=0,245. Wnioskujemy z tego, że kwas benzoesowy lepiej rozpuszcza się w warstwie ksylenowej niż w warstwie wodnej. Błąd w przeprowadzonym ćwiczeniu może być spowodowany m.in. złym odczytem podczas miareczkowania. Błąd mógł być spowodowany również trudnością uchwycenia punktu końcowego miareczkowania. Błąd może być również spowodowany zbyt intensywnym wytrząsaniem roztworów i powstaniem emulsji w jednym z nich.

Wyszukiwarka
Podobne podstrony:
sprawozdanie nr 2 (2), II rok, chemia fizyczna
Ćw7.2 treść raportu, z góry, II rok, CHEMIA FIZYCZNA, CHEMIA FIZYCZNA
spr z jodu(2), II rok, chemia fizyczna
Wymagania egz.Chemia Fizyczna, biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, CHEMIA FIZYCZ
Kolo z seminarek, Płyta farmacja Poznań, II rok, chemia fizyczna
tr+gibbsa, II rok, chemia fizyczna
sprawozdanie nr 1, II rok, chemia fizyczna
napięcie nasze, II rok, chemia fizyczna
SPRAWOZDANIE Z CHEMII FIZYCZNEJ, II rok, chemia fizyczna
chemia fizyczna - zestawy pytan, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, r
Zagadnienia - ogólnie, I ROK, II SEMESTR, Chemia Fizyczna
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
zagadnienia chemia wody, Politechnika Wrocławska, Inżynieria Środowiska, II rok, Chemia wody
Chemia fizyczna - wykad 5, OŚ, sem II 1 SOWiG, Chemia Fizyczna
test II, TiR UAM II ROK, Geografia fizyczna Polski
test I, TiR UAM II ROK, Geografia fizyczna Polski
więcej podobnych podstron