GRUPA NR: 22 ZESPÓŁ: 3 |
ĆWICZENIE NR: 3
Prężność pary (sprawozdanie końcowe) |
DATA WYKONANIA ĆWICZENIA: 02.06.2008 r.
|
ZESPÓŁ: 1. Katarzyna Góral 2. Joanna Grzywacz 3. Karolina Paśko 4. Kinga Poźniak
|
|
OCENA
|
1. Wstęp teoretyczny
Prężność pary jest to ciśnienie, pod którym ciecz i para współistnieją w stanie równowagi dynamicznej stanowiąc wówczas układ jednoskładnikowy dwufazowy, który zgodnie z regułą faz Gibbsa posiada 1 stopień swobody (F=C-P Oznacza to, że spośród ekstensywnych parametrów stanu jakimi są np. T,P tylko jeden stanowi zmienną niezależną drugi pozostaje jej funkcją.
Zależność funkcyjna T(P) lub P(T) nazywana jest krzywą równowagi fazowej, a jej opis przedstawia równanie Clapeyrona, które dla omawianego układu równowagowego ciecz-para przybiera postać:
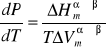
Gdzie:
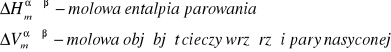
Wymienione wyżej wielkości są, indywidualnymi dla każdej substancji, funkcjami ciśnienia i temperatury, co praktycznie wyklucza scałkowanie równania Clapeyrona w sposób ogólny. Z tego powodu całkuje się, przyjmując następujące założenia upraszczające:
zakłada się, że objętość molowa cieczy jest znacznie mniejsza od objętości molowej pary nasyconej
przyjmuje się ze para nasycona jest gazem doskonałym
pomija się wpływ temperatury i ciśnienia na entalpię parowania i zastępuje ją wartością średnią
![]()
Przy takich założeniach równanie Clapeyrona przybiera postać:
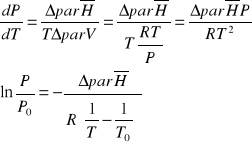
Powyższe równanie można przekształcić do postaci opisującej wpływ ciśnienia na temperaturę wrzenia cieczy
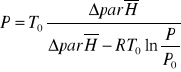
Jak również podać jego ogólną postać
![]()
Analiza powyższych zależności wskazuje na istnienie dwóch prawidłowości:
prężność pary nasyconej cieczy jest monotonicznie rosnącą funkcją temperatury (temperatura wrzenia jest monotonicznie rosnącą funkcją ciśnienia)
![]()
jest praktycznie funkcją liniową o współczynniku nachylenia równym - ![]()
.
2. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie zależności prężności pary nad wrzącą cieczą w funkcji temperatury, dla n-oktanu, oraz określenie molowej entalpii parowania n-oktanu.
3. Zadane parametry
Dany jest n-oktan o czystości cz.d.a. Należy wyznaczyć prężność pary nad wrzącą cieczą metodą izoteniskopową, dla przedziału temperatur od 30 do 62 stopni Celsjusza, z odstępami 8-stopniowymi. Na podstawie tych danych należy sporządzić wykres zależności prężności pary od temperatury i wykres zależności logarytmu naturalnego prężności pary od odwrotności temperatury. Następnie należy obliczyć molową entalpię parowania (w oparciu o wykres) i porównać wynik z wartością tabelaryczną.
4. Sposób wykonania ćwiczenia
Przygotowanie aparatury - zabezpieczenie kranów, uruchomienie pompy próżniowej i ustabilizowanie temperatury w termostacie.
Przygotowanie cieczy poddawanej destylacji, uszczelnienie szkła, uruchomienie aparatury.
Doprowadzenie cieczy do wrzenia, zamknięcie dostępu powietrza.
Otworzenie dwóch kranów w celu wyciągnięcia cieczy wrzącej ponad izoteniskop.
Zmiana otwarcia kranów w celu ustabilizowania poziomu cieczy.
Wyrównanie poziomu cieczy w izoteniskopie i utrzymywanie go przez pewien okres czasu.
Odczytanie różnicy temperatur na manometrze rtęciowym.
Odgazowanie układu badawczego i przygotowanie go do kolejnego pomiaru, powtórzenie pomiaru.
Takiego zestawu pomiarów dokonuje się następnie dla wyższych temperatur. Należy uważać przy tym, aby względna różnica pomiędzy dwoma kolejnymi pomiarami (w identycznej temperaturze) nie przekroczyła 5 %.
5. Wyniki pomiarów
|
Numer pomiaru |
Temperatura, w której dokonano pomiaru |
Prężność pary (po 3 pomiary w każdej temperaturze), [mm Hg] |
Średnia prężność pary w danej temperaturze |
||||
|
|
[°C] |
[K] |
|
[mm Hg] |
[Pa] |
||
Zespół nr 1 |
1 |
|
293 |
27 |
23 |
26 i 22 |
22,50 |
3263,6 |
|
2 |
|
313 |
43 |
45 |
41 i 42 |
42,75 |
5694,7 |
|
3 |
|
327 |
73 |
76 |
74 i 75 |
74,5 |
9924,1 |
|
4 |
|
334 |
98 |
102 |
100 i 101 |
100,25 |
13354,1 |
Zespół nr 2 |
1 |
|
306 |
21 |
20 |
21 |
20,67 |
2755,27 |
|
2 |
|
313 |
29 |
27 |
28 |
28 |
3733,03 |
|
3 |
|
320 |
40 |
42 |
42 |
41,3 |
5506,21 |
|
4 |
|
327 |
52 |
52 |
53 |
52,3 |
6972,76 |
Zespół nr 3 |
1 |
30 |
303 |
1 |
1 |
1 |
1 |
133,3 |
|
2 |
38 |
311 |
1 |
1 |
1,5 |
1,2 |
160 |
|
3 |
46 |
319 |
2 |
1,5 |
2,5 |
2 |
266,7 |
|
4 |
54 |
327 |
3 |
3 |
2 |
2,7 |
360 |
Zespół nr 4 |
1 |
|
302 |
16 |
8 |
8 |
10,6 |
2480 |
|
2 |
|
309 |
14,5 |
14 |
13,5 |
14,2 |
3413,33 |
|
3 |
|
318 |
26 |
28 |
26 |
26,6 |
4533,33 |
|
4 |
|
328 |
45 |
44 |
45 |
44,7 |
5280 |
Zespół nr 5 |
1 |
|
304 |
16 |
18 |
|
17 |
2266,47 |
|
2 |
|
311 |
24 |
22 |
|
23 |
3066,41 |
|
3 |
|
318 |
39 |
45 |
37 |
40,34 |
5378,21 |
|
4 |
|
325 |
59 |
54 |
48 |
53,67 |
7155,5 |
Zespół nr 6 |
1 |
|
303 |
8 |
9 |
|
8,5 |
|
|
2 |
|
313 |
12 |
12 |
|
12 |
|
|
3 |
|
323 |
15 |
14 |
|
14,5 |
|
|
4 |
|
333 |
20 |
21 |
|
20,5 |
|
|
5 |
|
343 |
23 |
23 |
|
23 |
|
Nr zespołu |
Wartość ΔH |
1 |
27,44 |
2 |
26,4 |
3 |
35,75 |
4 |
43,624 |
5 |
47,096 |
6 |
21,889 |
6.Przykładowe opracowanie danych doświadczalnych
![]()
Obliczamy entalpię parowania oktanu.
Wiemy, że:
![]()
Co możemy również zapisać:
![]()
Iloraz znajdujący się po lewej stronie równania jest tangensem kąta nachylenia prostej dopasowania (naszego wykresu) do osi x, czyli zarazem współczynnikiem kierunkowym tej prostej:
Zatem lewa strona równania jest równa:
![]()
Mając zależność:
a=-ΔH/R
przekształcamy ją, tak aby wyliczyć ΔH:
ΔH=-a*R
Współczynnik kierunkowy a określony na podstawie drugiego wykresu wynosi:
a=(-4,3+-0,7)*10^3
czyli a=-4300
Wiemy że R=8,314
Podstawiając do wzoru:
ΔH=-(-4300)*8,314
Mamy, że:
ΔH=35750,2[J]=35,75[kJ]
Tabelaryczna wartość molowej entalpii parowania n-oktanu w temperaturze wrzenia wynosi:
ΔHt=34,4[kJ/mol]
Błąd naszego pomiaru wynosi:
Δx=( ΔH- ΔHt)*100%/ ΔHt
Δx=(35,75-34,4)*100%/34.4=3,9%
7. Dyskusja wyników
Obliczanie przedziału ufności
Stosując rozkład Studenta-Fischera przedział ufności zakładamy na poziomie p=0,95 i obliczamy ze wzoru:
![]()
τ- wartość współczynnika rozkładu t-Studenta zależną od liczby oznaczeń n i poziomu ufności p
![]()
S - odchylenie standardowe
![]()
- odchylenie standardowe średniej
n - liczba pomiarów
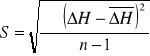
ΔH - pomiar entalpii
![]()
- średnia entalpia
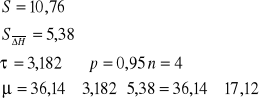
Regresja prostoliniowa

8.Wnioski końcowe
Na podstawie wyników doświadczeń wszystkich zespołów otrzymano entalpie parowania
n-oktanu o wartości ΔHpar=31,6 [kJ], zbliżona do wartości tablicowej. Przy rysowaniu wykresu nie uwzględniłyśmy wyników 2 zespołów 3 i 6 ponieważ były obarczone znacznym błędem. W celu zbadania błędów naszych pomiarów wykreśliłyśmy wykres dla funkcji ![]()
, która umożliwiła nam odrzucenie wyników najbardziej odbiegających od tablicowych wartości.
Źródłami błędów mogły być:
Nieszczelność aparatury
Zanieczyszczenie układu
Błędy podczas odczytywania ciśnienia na manometrze rtęciowym
Wahania ciśnienia zewnętrznego
Inne błędy przypadkowe popełniane przez różne osoby przeprowadzające doświadczenie
Wyszukiwarka
Podobne podstrony:
sprawozdanie nr 2 (2), II rok, chemia fizyczna
SPRAWOZDANIE NR 3, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, redo
SPRAWOZDANIE Z CHEMII FIZYCZNEJ, II rok, chemia fizyczna
Nernst, II rok, chemia fizyczna
Ćw7.2 treść raportu, z góry, II rok, CHEMIA FIZYCZNA, CHEMIA FIZYCZNA
spr z jodu(2), II rok, chemia fizyczna
Wymagania egz.Chemia Fizyczna, biotechnologia 2 sem rok2, pobrane z góry DS 7, II rok, CHEMIA FIZYCZ
Kolo z seminarek, Płyta farmacja Poznań, II rok, chemia fizyczna
tr+gibbsa, II rok, chemia fizyczna
napięcie nasze, II rok, chemia fizyczna
Nernst, II rok, chemia fizyczna
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
chemia fizyczna - zestawy pytan, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, r
Geodezja sprawozdanie nr 6, Studia, 1 rok, od Magdy, geodezja 1, Geodezja II, Geodezja (Kuba)
Sprawozdanie ćw. 11 Marty, Studia, I rok, Chemia fizyczna
Zagadnienia - ogólnie, I ROK, II SEMESTR, Chemia Fizyczna
Sprawozdanie 5 GIG B, II Rok WIMiC inżynieria materiałowa AGH, Chemia, Chemia -, Chemia - Laborki, S
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
więcej podobnych podstron