CHEMIA FIZYCZNA
Kinetyka
Zajmuje się badaniem przebiegu reakcji w czasie i pod wpływem różnych czynników wpływających na szybkość reakcji.
![]()
Szybkość reakcji
Reakcje mogą zachodzić w ciągu sekundy, kilku minut, godzin, kilka dni a nawet tys. Lat.
Reakcje I-rzędu - szybkość wprost proporcjonalna do stężenia roztworu
V= K*[A] N2O5->N2O3+O2
Reakcje II-rzędu - szybkość wprost proporcjonalna do kwadratu stężenia substratu A lub do stężenia substratu A i B.
V= K*[A]2 lub V=K*[A][B] 2HI->H2+I2
Reakcje III-rzędu - szybkość wprost proporcjonalna do skł A w 3 potędze, lub do kwadratu substratu A i stężenia B, lub stężenia A, B, C.
V= K[A]3= k*[A]2*[B]= K*[A][B][C] 2Na+Cl2->2NaCl
Reakcje n-tego rzędu nazywamy reakcję, której szybkość jest proporcjonalna do n-tej potęgi stężenia 1go z reagentów lub iloczynu stężeń n-reagentów
Okazuje się, że często rząd reakcji jest liczbą niecałkowitą, co oznacza, że reakcja biegnie przez etapy pośrednie, a w rezultacie o całym biegu procesu, decyduje 1 lub 2 etapy najważniejsze.
2N2O5->N2O4+O2
Reakcja zachodzi wieloetapowo:
N2O5->N2O3+O2 r. powolna
N2O3->NO+NO2 r. szybka
NO+N2O5->3NO2 r. szybka
4NO2->2N2O4 r. szybka
2N2O5->N2O4+O2
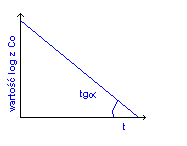
Matematyczne wyznaczanie - Reakcje I rzędu:
![]()
![]()
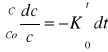
![]()
K to tgα na wykresie
![]()
![]()
![]()
Okres połowicznego rozpadu
Okres półtrwania, stężenie substancji zmniejsza się o połowę
![]()
![]()
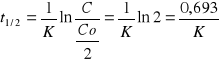
Matematyczne wyznaczanie - Reakcje II rzędu:
![]()
![]()
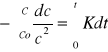
![]()
![]()
![]()
![]()
Czynniki wpływające na szybkość reakcji:
Rodzaj i stężenie reagentów
Temperatura -wzrost przyspiesza przebieg
Ciśnienie- o ile temp. We wszystkich r. tak ciśnienie tylko ze zmianą objętości
Promieniowanie elektromagnetyczne- czynnik podnoszący Ek cząsteczki a także przyspiesza
pH roztworu- czynnik selektywny dotyczy tylko niektórych reakcji, czasami przyspiesza
Stopień rozdrobnienia- reakcje pomiędzy ciałami stałymi (większe powierzchnie)
Mieszanie - powoduje wzrost pow., na której zachodzi reakcja
Katalizator- wchodzi w reakcje z substratami a po zakończeniu reakcji odtwarza się
Reakcja z katalizatorem
Dodanie przyspiesza reakcje chemiczną
Inhibitory opóźniają szybkość reakcji
A+B->AB Reakcja chem. Bez katalizatora zachodzi powoli
A+K->AK Reakcja chem. Z katalizatorem zachodzi szybko
AK+B->AB+K Reakcja chem. Z katalizatorem zachodzi szybko
Reakcja syntezy chlorku nitrozynu bez katalizatora:
2NO+Cl2->2NOCl
Reakcja syntezy chlorku nitrozynu z katalizatorem
2NO+Br2->2NOBR
2NOBr+Cl2->2NOCl+Br2
Kataliza homogeniczna
Katalizator występuje w tej samej fazie, co reagenty
Utlenianie SO2 do SO3, CO do CO2
Kataliza heterogeniczna
Katalizator występuje w innej fazie niż reagenty (najczęściej w fazie stałej)
Polimeryzacja acetylenu do benzenu wobec platyny, katalizatory spalin w samochodzie
Autokataliza
Katalizatorem reakcji jest 1 z produktów reakcji
Utlenianie kwasu szczawiowego
Holoenzym= Apoenzym+koenzym
Aktywność enzymów zależy od:
Temperatury, pH, stężenia enzymu, obecności inhibitorów lub aktywatorów.
1
Wyszukiwarka
Podobne podstrony:
CHEMIA FIZYCZNA-Proces analityczny sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA-Proces analityczny sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- koloidy sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA-zanieczyszczenia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- Elektrochemia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- srodowisko sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
CHEMIA FIZYCZNA, Ochrona Środowiska pliki uczelniane, Chemia
alkalodiy, Ochrona Środowiska pliki uczelniane, Chemia
Alkaloidy cz, Ochrona Środowiska pliki uczelniane, Chemia
Alkaloidy c1, Ochrona Środowiska pliki uczelniane, Chemia
genetyka21, Ochrona Środowiska pliki uczelniane, Chemia
Natura 2000 a autostrada A1, Ochrona Środowiska pliki uczelniane, Natura 2000
113MOJA, Ochrona Środowiska pliki uczelniane, Fizyka
Niszczenie drobnoustrojów, Ochrona Środowiska pliki uczelniane, Mikrobiologia
więcej podobnych podstron