Robert Maniura
Sprawozdanie z ćwiczenia nr 24: Kinetyka reakcji elektroutleniania 1 - propanolu.
Wstęp teoretyczny:
Zdolność przewodzenia prądu elektrycznego nazywa się przewodnictwem, a ciała które tę zdolność posiadają - przewodnikami. Rozróżnia się dwa typy przewodników: przewodzące prąd elektronowo (I rodzaju) i przewodzące prąd za pośrednictwem jonów (II rodzaju).
Gdy do roztworu elektrolitu zanurzy się elektrody połączone ze źródłem prądu stałego wówczas na poruszające się chaotycznie jony oddziałuje pole elektryczne. Chaotyczny ruch jonów zmienia się w ruch uporządkowany. Jeżeli pomiędzy elektrodami występuje wystarczająca różnica potencjałów do rozładowania jonów, wtedy następuje przekazywanie elektronów. Na katodzie następuje proces redukcji, na anodzie proces utleniania. Przepływ prądu przez roztwory elektrolitów nazywa się elektrolizą.
Kinetyka procesów elektrodowych różni się w istotny sposób od kinetyki reakcji przebiegających w głębi roztworu. Wynika to stąd, że proces elektrodowy jest procesem heterogenicznym, biegnącym na granicy faz: elektroda - roztwór.
Na cząsteczki chemiczne i jony biorące udział w reakcji elektrodowej działają w warstwie przyelektrodowej dodatkowo siły powierzchniowe oraz pole elektryczne elektrody. Reakcje elektrodowe biegną często w kilku etapach, z których niektóre mogą być reakcjami chemicznymi, inne procesami desorpcji-adsorpcji. Zwykle szybkość procesu heterogenicznego można formalnie podzielić na kilka etapów:
- transport substratów z głębi roztworu do warstwy przyelektrodowej
- adsorpcja substratów na powierzchni elektrody
- reakcja elektrodowa
- desorpcja produktów
- transport produktu w głąb roztworu.
Najważniejszym etapem procesu elektrodowego jest etap przeniesienia ładunku pomiędzy substratem a elektrodą metaliczną. Proces ten jest także najwolniejszym etapem reakcji.
Badając zjawiska elektrolizy Faraday odkrył zależność pomiędzy ładunkiem jaki przepłynął przez elektrolit w danym czasie, a ilością substancji wydzielonej na elektrodzie co przedstawił w postaci praw:
I prawo Faradaya:
Masa wydzielonej substancji na elektrodzie podczas elektrolizy jest proporcjonalna do natężenia prądu i czasu trwania elektrolizy: m= k i t gdzie: m- masa wydzielonej substancji; i- natężenie prądu; t- czas trwania elektrolizy; k- równoważnik elektrochemiczny;
II prawo Faradaya:
Do wydzielenia na elektrodach jednego gramorównoważnika chemicznego dowolnej substancji podczas elektrolizy potrzebne jest niezależnie od warunków prowadzenia procesu
zawsze ta sama ilość elektryczności wynosząca w przybliżeniu 96500 C. Tę ilość elektryczności nazywa się stałą Faradaya i oznacza F:
![]()
gdzie: M- masa molowa jonu; w- ładunek jonu; F- stała Faradaya;
W sytuacji gdy proces ze względu na procesy uboczne odbiega od prawa Faradaya mówi się o wydajności prądowej danej reakcji zachodzącej w całym procesie. Wydajność prądową definiuje się jako stosunek masy substancji uzyskanej przy danym sposobie prowadzenia elektrolizy do jej masy wynikającej z prawa Faradaya:
![]()
Opracowanie wyników:
W ćwiczeniu wykorzystuje się proces elektroutleniania propanolu w środowisku KOH. Oparty jest on bezpośrednio na elektrolizie wodnego roztworu zasady, podczas której wydziela się tlen, który utlenia propanol do kwasu propionowego. Powstający kwas propionowy częściowo zobojętnia zasadę. Stężenie KOH oznacza się miareczkując 0,1 M roztworem kwasu solnego wobec fenoloftaleiny próbki o objętości 4 cm3 pobierane z roztworu w elektrolizerze w odstępach 20 minutowych. Oznacza się w ten sposób zmiany stężenia KOH wywołane powstającym kwasem propionowym. Początkowy skład roztworu w elektrolizerze jest następujący: 40 cm3 1 M KOH i 20 cm3 1- propanolu. W czasie elektrolizy zachodzi reakcja:
C3H7OH + [O] C2H5COOH
Właściwie kwas propionowy powstaje w wyniku reakcji następczej: alkohol aldehyd kwas. Obliczam stężenie początkowe zasady w mieszaninie w elektrolizerze - na zmiareczkowanie próbki o objętości 4 cm3 zużyłem12,3 cm3 0,1 M HCl (średnia z 3 próbek o objętości 4 cm3 każda):
1000 cm3 r- ru - 0,1 M HCl
12,3 cm3 r- ru - x mola HCl ⇒ x = 0,00123 mola HCl = KOH w 4 cm3 próbki
Objętość roztworu w elektrolizerze wynosi 48 cm3 (objętość początkowa 60 cm3 - 3 * 4 cm3 na próbki do miareczkowania).
4 cm3 próbki - 0,00123 mola KOH
48 cm3 w elektrolizerze - x mola KOH ⇒ x = 0,01476 mola KOH w elektrolizerze.
Stężenie początkowe KOH w elektrolizerze wynosi: C0, KOH = 0,01476 mola / 0,048 dm3 = 0,3075 mol/ dm3.
Stężenie początkowe alkoholu n - propylowego: 60 cm3 początkowej mieszaniny w elektrolizerze zawiera 20 cm3 n- propanolu. Próbka o objętości 4 cm3 będzie zawierała:
60 cm3 r- ru - 20 cm3 n - propanolu
4 cm3 r- ru - x cm3 n- propanolu ⇒ x= 1,33 cm3 n- propanolu w 4 cm3 próbki
Obliczam masę oraz liczbę moli n - propanolu w 4 cm3 próbki. Gęstość alkoholu propylowego wynosi: d n- propanolu = 0,804 g/cm3.
m= V * d = 1,33 cm3 * 0,804 g/cm3 = 1,06932 g n - propanolu w 4 cm3 próbki
M n- propanolu= 60,09 g/mol
1 mol n- propanolu - 60,09 g
x mol n- propanolu - 1,06932 g ⇒ x= 0,01779 mola n- propanolu w 4 cm3 próbki.
Objętość roztworu w elektrolizerze wynosi 48 cm3.
4 cm3 - 0,01779 mola n- propanolu
48 cm3 - x mola n- propanolu ⇒ x= 0,21348 mola n- propanolu w elektrolizerze.
Stężenie początkowe n- propanolu w elektrolizerze wynosi:
Calkoholu = 0,21348 mola / 0,048 dm3 = 4,4475 mol/dm3
W miarę czasu trwania elektrolizy w roztworze przybywa kwasu propionowego i ubywa n - propanolu. Liczba moli powstającego kwasu propionowego jest równa ubytkowi liczby moli KOH (następuje częściowe zobojętnienie zasady powstającym kwasem propionowym):
n kwasu= n 0, KOH - n KOH gdzie: n kwasu - liczba moli kwasu propionowego w rozważanym momencie; n o, KOH - początkowa liczba moli zasady; n KOH - liczba moli zasady w rozważanym momencie;
Ubytek liczby moli n- propanolu jest równy liczbie moli powstającego kwasu propionowego:
n alkoholu = n o, alkoholu - n kwasu gdzie: n alkoholu - liczba moli alkoholu propylowego w rozważanym momencie; n o, alkoholu - początkowa liczba moli alkoholu propylowego; n kwasu - liczba moli kwasu propionowego w rozważanym momencie;
Liczbę moli zasady w poszczególnych próbkach o objętości 4 cm3 pobieranych z elektrolizera w odstępach 20 minutowych obliczam ze wzoru:
n KOH = c HCl * V HCl gdzie: c HCl - stężenie HCl równe 0,1 M; V HCl - objętość HCl do miareczkowania próbki 4 cm3.
W każdym punkcie pomiarowym objętość roztworu w elektrolizerze zmniejsza się o 4 cm3 - o pobieraną próbkę mieszaniny do miareczkowania.
Obliczenia dla poszczególnych punktów pomiarowych (z uwzględnieniem pobierania próbek do miareczkowania) roztworu z elektrolizera:
w czasie t = 0 minut - początkowa liczba moli i stężenie początkowe KOH i alkoholu n- propylowego:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,00123 mola |
0 mola |
0,01779 mola |
W elektrolizerze pozostaje 48 cm3 mieszaniny, która zawiera: |
0,01476 mola |
0 mola |
0,21348 mola |
Stężenie: |
0,3075 mol/dm3 |
0 mol/dm3 |
4,4475 mol/dm3 |
w czasie t= 20 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,00122 mola |
0,00001 mola |
0,01778 mola |
W elektrolizerze pozostaje 44 cm3 mieszaniny, która zawiera: |
0,01342 mola |
0,00011 mola |
0,19558 mola |
Stężenie: |
0,3050 mol/dm3 |
0,0025 mol/dm3 |
4,4450 mol/dm3 |
w czasie t= 40 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,00119 mola |
0,00003 mola |
0,01775 mola |
W elektrolizerze pozostaje 40 cm3 mieszaniny, która zawiera: |
0,0119 mola |
0,00041 mola |
0,1775 mola |
Stężenie: |
0,2975 mol/dm3 |
0,01025 mol/dm3 |
4,4375 mol/dm3 |
w czasie t= 60 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,001175 mola |
0,000015 mola |
0,017735 mola |
W elektrolizerze pozostaje 36 cm3 mieszaniny, która zawiera: |
0,010575 mola |
0,000545 mola |
0,159615 mola |
Stężenie: |
0,29375 mol/dm3 |
0,01514 mol/dm3 |
4,43375 mol/dm3 |
w czasie t= 80 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,001155 mola |
0,00002 mola |
0,017715 mola |
W elektrolizerze pozostaje 32 cm3 mieszaniny, która zawiera: |
0,00924 mola |
0,000705 mola |
0,14172 mola |
Stężenie: |
0,28875 mol/dm3 |
0,02203 mol/dm3 |
4,42875 mol/dm3 |
w czasie t= 100 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,001195 mola |
0,00004 mola |
0,017675 mola |
W elektrolizerze pozostaje 28 cm3 mieszaniny, która zawiera: |
0,008365 mola |
0,000985 mola |
0,123725 mola |
Stężenie: |
0,29875 mol/dm3 |
0,03518 mol/dm3 |
4,41875 mol/dm3 |
- w czasie t= 120 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,00117 mola |
0,000025 mola |
0,01765 mola |
W elektrolizerze pozostaje 24 cm3 mieszaniny, która zawiera: |
0,00702 mola |
0,001135 mola |
0,1059 mola |
Stężenie: |
0,2925 mol/dm3 |
0,04729 mol/dm3 |
4,4125 mol/dm3 |
- w czasie t= 180 minut:
|
KOH |
C2H5COOH |
C3H7OH |
4 cm3 próbki pobranej z elektrolizera zawiera: |
0,001215 mola |
0,000045 mola |
0,017605 mola |
W elektrolizerze pozostaje 20 cm3 mieszaniny, która zawiera: |
0,006075 mola |
0,00136 mola |
0,088025 mola |
Stężenie: |
0,30375 mol/dm3 |
0,068 mol/dm3 |
4,40125 mol/dm3 |
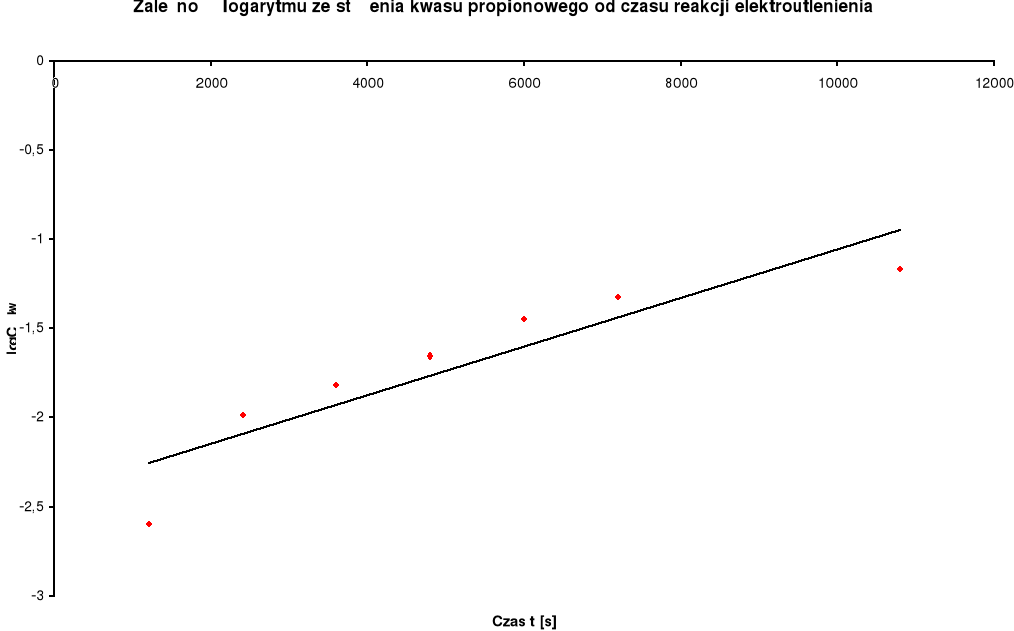
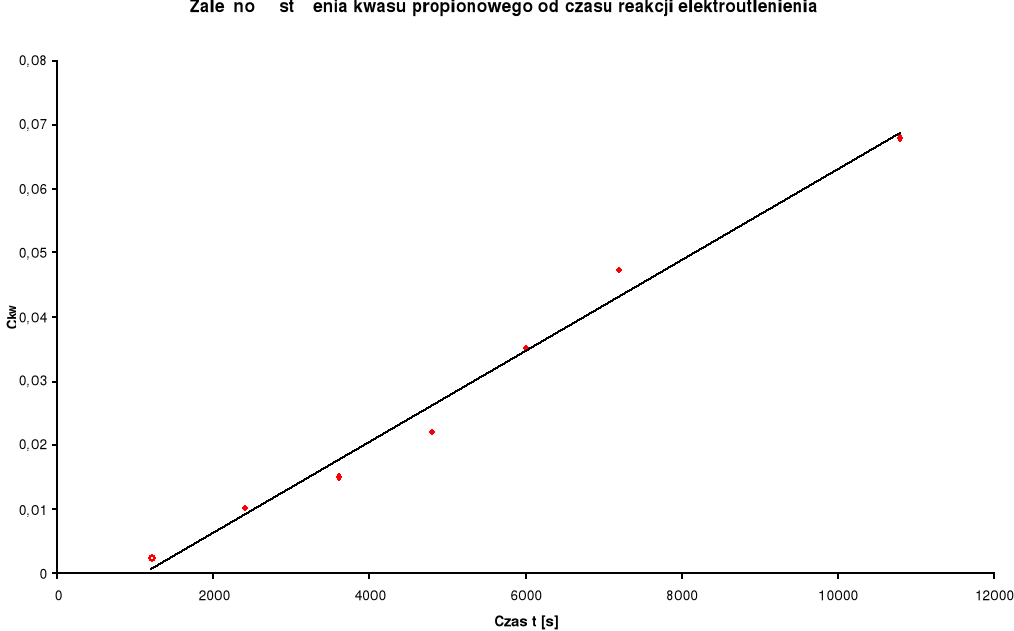
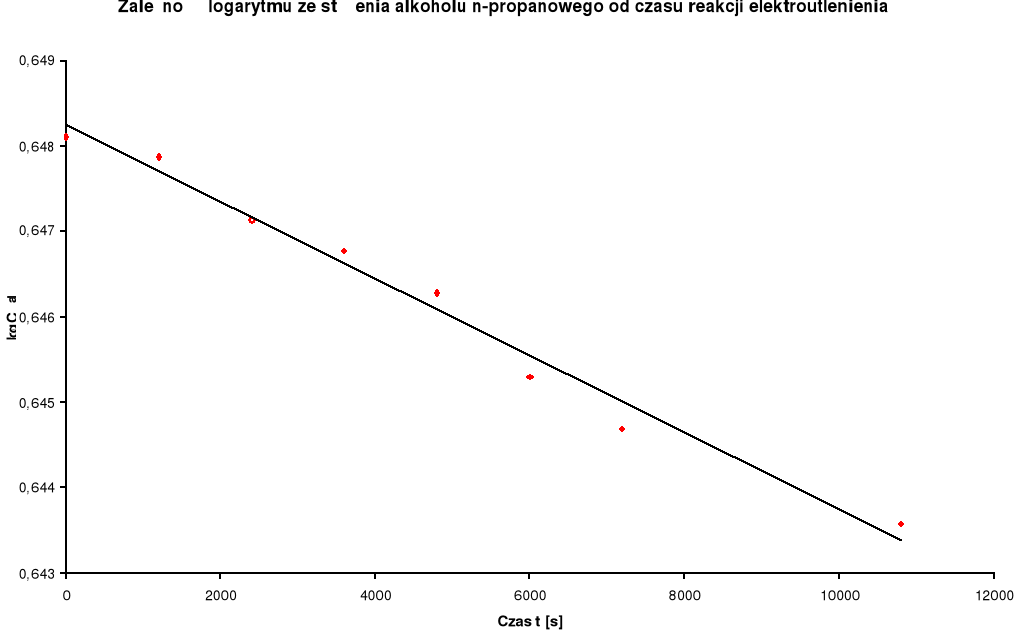
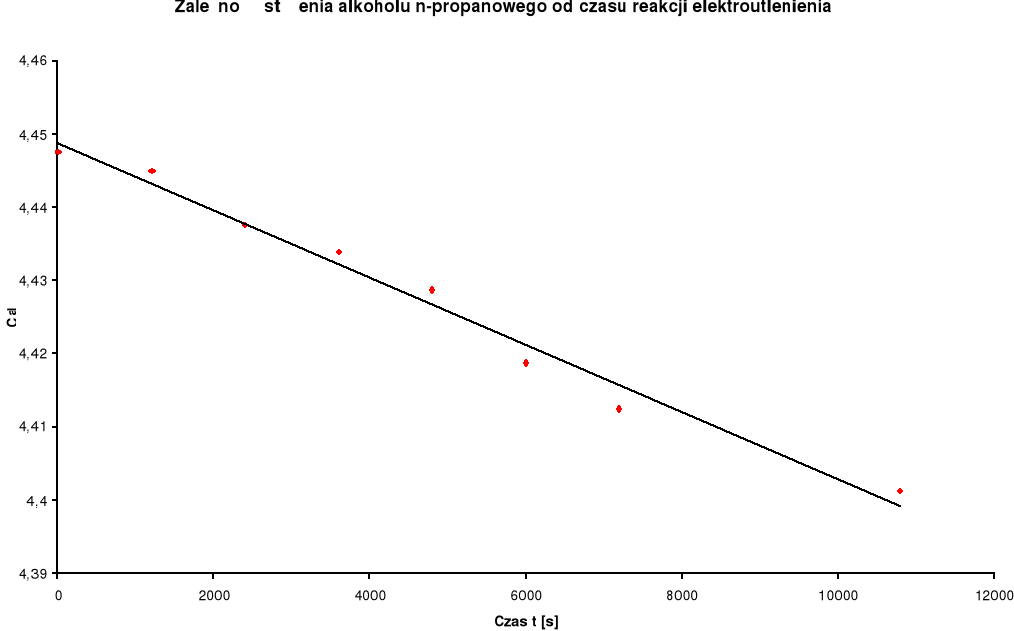
Zestawienie wyników:
L.p. |
Czas, t [min] |
Czas, t [s] |
Stężenie kwasu propionowego c kwasu [mol / dm3] |
Log c kwasu |
Stężenie n- propanolu c alkoholu [mol / dm3] |
Log c alkoholu |
1 |
0 |
0 |
0 |
|
4,4475 |
0,648116 |
2 |
20 |
1200 |
0,0025 |
-2,60206 |
4,4450 |
0,647872 |
3 |
40 |
2400 |
0,01025 |
-1,989276 |
4,4375 |
0,647138 |
4 |
60 |
3600 |
0,01514 |
-1,819874 |
4,43375 |
0,646771 |
5 |
80 |
4800 |
0,02203 |
-1,656986 |
4,42875 |
0,646281 |
6 |
100 |
6000 |
0,03518 |
-1,453704 |
4,41875 |
0,645299 |
7 |
120 |
7200 |
0,04729 |
-1,325231 |
4,4125 |
0,644685 |
8 |
180 |
10800 |
0,068 |
-1,167491 |
4,40125 |
0,643576 |
Przez elektrolit w czasie t= 7200 s przepływał prąd o natężeniu I= 1 A. Zatem przez roztwór przepłynął ładunek: Q= I * t = 1 A * 7200 s = 7200 C
Wydajność prądowa procesu elektroutleniania 1- propanolu- reakcja jest 4 elektronowa:
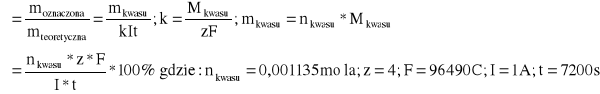
![]()
Wnioski.
W wyniku elektroutleniania alkoholu n - propylowego w środowisku zasady potasowej otrzymuje się kwas propionowy, który natychmiast reaguje z obecną w elektrolizerze zasadą tworząc sól - propionian potasu. Objawia się to stopniowym ubytkiem stężenia zasady - następuje jej częściowe zobojętnienie w miarę jak tworzy się kwas propionowy. Obliczona wydajność prądowa danej reakcji elektroutleniania propanolu wynosi 6,08 %. Świadczy to o tym, że proces przebiega z reakcjami ubocznymi. Etapem przejściowym w utlenianiu alkoholu do kwasu jest tworzenie się aldehydu. Cząsteczki aldehydu w środowisku zasadowym mogą ze sobą kondensować, co objawiało się powstaniem w roztworze żółtych, smolistych substancji. Masa substancji- kwasu propionowego - uzyskanej przy danym sposobie prowadzenia elektrolizy jest o około połowę mniejsza niż jej masa obliczona teoretycznie - wynikająca z prawa Faradaya.
Wykresy.
1
Wyszukiwarka
Podobne podstrony:
Stała szybkości reakcji jodowania acetonu, studia, chemia, chemia fizyczna, sprawozdania, sprawka
ćw9 - Elektrody jonoselektywne, studia, chemia fizyczna
Elektronowe widma absorpcyjne, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Elektrody jonoselektywne, Studia, Chemia fizyczna
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
HCOOH, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Diagram fazowy Gibbsa, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Entropia mieszania, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Badanie lepkości cieczy metodą Hopplera, studia, chemia, chemia fizyczna, sprawozdania, sprawka
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Energia aktywacji przepływu lepkiego, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Ciepło rozpuszczania soli jonowej, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Dyspersja współczynnika załamania światła, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl i HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Jonity1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
Izoterma adsorpcji 1, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HCl, studia, chemia, chemia fizyczna, sprawozdania, sprawka
HJ, studia, chemia, chemia fizyczna, sprawozdania, sprawka
więcej podobnych podstron