Uwagi do zadań 2. terminu zaliczenia Obliczeń chemicznych (17-02-2011). Notacja równań zgodna z MathCAD
1A. Oblicz udział masowy tlenu atomowego w wodnym roztworze H3PO4 o stęż. 2,020 mol/dm3 i gęstości 1,100 g/cm3. (oznaczenia: kf - H3PO4, w - H2O)
Rozwiązanie
![]()
![]()
![]()
![]()
![]()
Rozwiązanie dyskwalifikuje pominięcie faktu, że tlen w roztworze znajduje się w dwóch związkach, lub źle został zdefiniowany związek liczności O w kf z licznością kf
1B. Oblicz udział masowy wodoru atomowego w wodnym roztworze H3AsO4 o stęż. 2,191 mol/dm3 i gęstości 1,196 g/cm3. (oznaczenia: ka - H3AO4, w - H2O)
Rozwiązanie:
![]()
![]()
![]()
![]()
![]()
Rozwiązanie dyskwalifikuje pominięcie faktu, że wodór w roztworze znajduje się w dwóch związkach, lub źle został zdefiniowany związek liczności H w ka z licznością ka, albo źle zdefiniowano związek liczności H w wodzie z licznością wody
2A. Stop Fe-Ni o masie 15,00 g i ułamku molowym Fe= ¼ roztworzono w kwasie solnym uzyskując sole kationów dwudodatnich. Wydzielony gaz zebrany w pustym zbiorniku zamkniętym wykazuje w temp. 20°C ciśnienie 1, 051 kPa. Oblicz objętość tego zbiornika. (oznaczenia: g- gaz, st - stop)
![]()
![]()
![]()
alternatywa układu: ![]()
![]()
Rozwiązanie dyskwalifikuje błąd w definicji związku ilości gazu z licznością metali, błąd w układzie: bilans masy |ułamek molowy lub błąd w równaniu alternatywnym do układu
2B. Stop Sn-Zn o masie 15,00 g i ułamku molowym Sn= ¼ roztworzono w kwasie solnym uzyskując sole kationów dwudodatnich. Wydzielony gaz zebrany w pustym zbiorniku zamkniętym wykazuje w temp. 20°C ciśnienie 0,929 kPa. Oblicz objętość tego zbiornika. (oznaczenia: g- gaz, st - stop)
![]()
układ: ![]()
![]()
alternatywa układu: ![]()
![]()
Rozwiązanie dyskwalifikuje błąd w definicji związku ilości gazu z licznością metali, błąd w układzie: bilans masy |ułamek molowy lub błąd w równaniu alternatywnym do układu
3A. W wyniku rozkładu termicznego KClO3 otrzymuje się chlorek potasu i tlen cząsteczkowy. Oblicz masę KClO3 niezbędną do otrzymania 50,0 kmoli O2, jeżeli rozkładana sól zawiera 7,00 % zanieczyszczeń, a wydajność procesu wynosi 84,5%. (oznaczenia: techchpot- zanieczyszczony KClO3,chpot - KClO3)
![]()
![]()
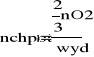
![]()
![]()
3B. W wyniku rozkładu termicznegoKClO3 otrzymuje się chlorek potasu i tlen cząsteczkowy. Oblicz ile kmol O2 otrzymano w wyniku rozkładu 200 kg KClO3, jeżeli rozkładana sól zawierała 7,00 % zanieczyszczeń, a wydajność procesu wynosiła 87,9%.
![]()
![]()
![]()
![]()
Do uznania każdego z powyższych zadań za dobrze rozwiązane nie było konieczne uzyskanie prawidłowego wyniku liczbowego. W zad 2A możliwe było uzyskanie wyniku b. zbliżonego do prawidłowego, w wyniku błędnego postępowania. Wtedy rozwiązanie uznawano za błędne. Każdą drogę rozwiązania uważano za właściwą, chyba, że w rozwiązaniu pojawiały się liczby nie będące danymi w zadaniu lub wprost z nich nie wynikające
Wyszukiwarka
Podobne podstrony:
OblChemTermin1, Inżynieria chemiczna i procesowa WIiTCh
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
zadanie1 3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, tran
pytania operacje, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 4
Stechiometria, Inżynieria chemiczna i procesowa
D III rokBiopreparatywykłady 1-3fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i pro
Staliwa węglowe i konstrukcyjne stopowe, Inżynieria chemiczna i procesowa, Materiało- i maszynoznaws
Przykładowa analiza AWZ, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, bez
mikro3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikrobio
biotechnologia2, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III semestr 6
allbiochemia, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I semestr 2, bio
mikrokapsułkowanie aromatów, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I
egz mikro, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikro
Tabelka do zadania, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr
2012 - Pytania do kol wyk, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 2, d
Strona 1 cw2 tytulowa, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, dynam
zagadnienia fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III seme
więcej podobnych podstron