Nazwisko Nowak |
WYŻSZA SZKOŁA PEDAGOGICZNA w Rzeszowie |
||||
Imię Tomasz |
Wykonano |
Oddano |
|||
Kierunek Fizyka z informatyką II |
6-12-2000 |
Podpis |
13-12-2000 |
Podpis |
|
Grupa laboratoryjna: XI |
|
|
|
|
|
Nr ćwiczenia
34a |
Temat ćwiczenia Wyznaczanie równoważnika elektrochemicznego wodoru i tlenu przy pomocy aparatu Hoffmana. |
||||
WSTĘP TEORETYCZNY
Wodne roztwory kwasów, zasad i soli ulegają dysocjacji elektrolitycznej polegającej na rozpadzie drobin na jony: dodatnie zwane kationami oraz ujemne aniony. Dodatnimi jonami są metale i wodór, a ujemnymi reszta kwasowa i grupa wodorotlenowa. Dysocjacja nie jest całkowita; stąd wprowadzamy pojęcie stopnia dysocjacji a będącego stosunkiem liczby drobin zdysocjowanych Nd do ogólnej liczby drobin zawartych w roztworze N:
Stopień dysocjacji zależy od wielu czynników (temperatury, stężenia itp.), z których najważniejszą rolę odgrywa względna przenikalność dielektryczna εr rozpuszczalnika. Części drobin dysocjujących są jonami i są związane siłami coulombowskimi:
![]()
a więc proporcjonalnymi do odwrotności względnej stałej dielektrycznej εr rozpuszczalnika. Im większe εr, Tym wyższy stopień dysocjacji. W roztworze następuje również rekombinacja drobin a stopień dysocjacji jest wynikiem równowagi dynamicznej między dysocjacją a rekombinacją.
Jony pochodzące ze zdysocjowanych drobin mogą przewodzić prąd elektryczny. Prąd taki różni się od prądu przewodzonego w metalach, ponieważ nie jest to przepływ elektronów, lecz przepływ dużych jonów, czyli prąd konwekcyjny. Stad też opór elektrolitu jest duży. Poza tym elektrolity zachowują się jak przewodniki, tzn. stosują się do prawa Ohma i ich opór zależy od temperatury w taki sam sposób jak dla metali. Całość zjawisk zachodzących przy przepływie prądu elektrycznego przez elektrolit nazywamy elektrolizą. Ponieważ w elektrolitach występują prądy konwekcyjne towarzyszy im transport masy. Jony oddają swój ładunek elektrodzie, ulegają zobojętnieniu i wydzielają się na elektrodzie lub reagują natychmiast z elektrodą bądź roztworem. Ilość wydzielonej masy jest proporcjonalna do ładunku Q, który przepływa przez elektrolit:
(1) ![]()
Współczynnik proporcjonalności k nazywamy równoważnikiem elektrochemicznym, powyższe równanie nazywamy I prawem Faradaya. Oznaczając masę pojedynczego jonu przez m', jego ładunek przez e', a ilość wydzielonych jonów przez N' otrzymamy:
m=N'ּm' oraz N'=Q/e'
skąd
![]()
i porównując ten wzór ze wzorem (1) otrzymujemy prostą interpretację równoważnika elektrochemicznego:
![]()
Ładunek jonu e'=Wּe jest równy iloczynowi wartościowości i ładunku elementarnego, a masa m' jonu jest równa stosunkowi masy atomowej do liczby Avogarda NA, czyli
![]()
Podstawiając tę wielkość do wzoru
![]()
otrzymamy:
![]()
gdzie wielkość
![]()
nazywamy równoważnikiem chemicznym, a iloczyn F= NAּe stałą Faradaya. Tak więc ostatni wzór przyjmuje postać:
(2) ![]()
Wynika stąd, że ładunek Q=F równy stałej Faradaya wydziela masę równą jednemu równoważnikowi chemicznemu m=R dowolnej substancji. Stwierdzenie to jest treścią II prawa Faradaya. Stała Faradaya F=96519,2 Cּrównoważnik-1. Podstawiając równanie (1) do równania (2) otrzymamy:
R=kּF
Stosując wzór (2) do dwóch substancji otrzymamy:
![]()
oraz ![]()
Jeżeli przez obydwa woltametry przepuścimy taki sam ładunek Q=Q1=Q2, to dzieląc obydwa równania stronami otrzymamy:
![]()
W doświadczeniu przepuszczamy prąd przez szeregowo połączone woltametry, z których jeden jest przystosowany do elektrolizy substancji nie wydzielającej gazów np. CuSO4, ZnSO4, a drugi do elektrolitu wydzielającego gazy np. KOH, NaCl, itp. Dysocjacja tych substancji przebiega według schematu:
CuSO4 → Cu++ + SO4- -,
ZnSO4 → Zn++ + SO4- -,
NaCl → Na+ + Cl-,
KOH → K+ + OH-.
Na katodzie zachodzą wtórne reakcje chemiczne w ostatnich dwóch przypadkach
K + H2O → 2KOH + H2,
2Na + 2H2O → 2NaOH + H2.
Na anodzie w każdym przypadku zachodzą reakcje wtórne z materiałem elektrody
SO4 + Cu → CuSO4 lub z wodą 4Cl + 2H2O → 4HCl + O2
SO4 + Zn → ZnSO4 lub z wodą 4OH + 2H2O → 4H2O + O2.
Tak więc na elektrodach wydziela się wodór i tlen.
Masę wydzielonego gazu obliczyć możemy ze wzoru:
m=ρoּVo
gdzie Vo oznacza objętość w temperaturze τ = 0oC i przy po - ciśnieniu normalnym. Objętość Vo obliczamy z równania stanu gazu doskonałego (Clapeyrona):
![]()
(4) ![]()
,
gdzie V jest objętością w temperaturze τ, a p ciśnieniem w tej temperaturze. Do elektrolizy substancji wydzielającej gazy stosujemy woltametr. W rurkach A i B gromadzić się mogą gazy wydzielające się na elektrodach. Zmiany objętości elektrolitu kompensuje jego zapas w zbiorniku. Elektrody „+” i „-” wykonane są z drutu platynowego lub żelaznego. W woltometrze znajduje się mieszanina gazu (wodoru lub tlenu) oraz pary wodnej. Ciśnienie całkowite jest wtedy zgodnie z prawem Daltona równe sumie ciśnień cząstkowych obydwu gazów pary wodnej p[H2O] oraz wodoru lub tlenu p. Suma ciśnień p[H2O]+p jest zrównoważona ciśnieniem barometrycznym b oraz ciśnieniem h słupa wody:
![]()
gdzie bo - zredukowana wartość ciśnienia, a współczynnik h/13,6 pochodzi z zamiany ciśnienia słupka wody o wysokości h na ciśnienie słupka rtęci o gęstości 13,6 razy większej. Stąd ostatecznie:
![]()
Podstawiając to do równania (4) otrzymuję:
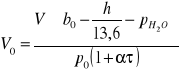
a następnie podstawiając je do równania (3) otrzymuję wzór na masę m wydzielonego gazu:
(5) 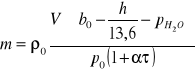
W ćwiczeniu należy wyznaczyć równoważniki elektrochemiczne wodoru i tlenu. Korzystając z zależności:
m=kּIּt
po obliczeniu m z równania (5) mogę wyznaczyć je z następującego wzoru:
(6)![]()
WŁASNOŚCI DIELEKTRYCZNE CIAŁ
Dielektrykami są ciała, które w swojej strukturze - przy braku zewnętrznych bodźców jonizujących - nie zawierają ładunków swobodnych, tj. elektronów poruszających się swobodnie w przestrzeniach międzyatomowych; w związku z tym dielektryki są złymi izolatorami prądu.
Ładunki elektryczne przeciwnych znaków występujące w równych ilościach w poszczególnych atomach i cząsteczkach dielektryków są ze sobą bardzo silnie związane siłami wzajemnego przyciągania.
Gdy na powyższe ładunki działają siły pola elektrycznego, więź między nimi nie zostaje zerwana, a jedynie doznają one nieznacznych, sprężystych przesunięć względem siebie. Wszystkie ładunki dodatnie przesuwają się w kierunku zgodnym z kierunkiem natężenia pola elektrycznego, a ładunki ujemne w kierunku przeciwnym.
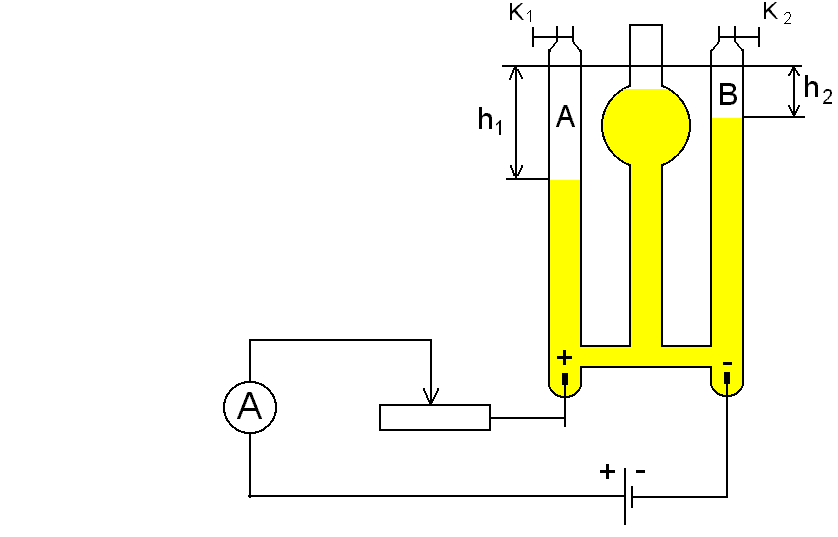
SCHEMAT POMIARU
PRZEBIEG DOŚWIADCZENIA
Mierzymy gęstość elektrolitu przy pomocy aerometru.
Ostrożnie wlewamy elektrolit do woltametru.
Łączymy układ pomiarowy według schematu.
Włączamy prąd i przy pomocy opornicy suwakowej ustalamy jego natężenie w granicach 0,4-0,5 A tak, aby pęcherzyki gazów wydzielały się szybko, ale nie gwałtownie. Wyłączamy prąd i otwierając zawory K1 i K2 usuwamy gaz wydzielony w czasie próby.
Zamykamy zawory K1 K2 . Włączamy prąd uruchamiając jednocześnie stoper. Notujemy natężenie prądu w czasie elektrolizy „I”. Gdy gaz wydzielający się na katodzie wypełni 2/3-3/4 części rurki prąd wyłączamy. Notujemy czas przebiegu elektrolizy „t” i objętość gazów wydzielonych w rurkach „A” i „B”.
Przy pomocy katetometru mierzymy różnice poziomów słupów elektrolitu h1 i h2. Mierzymy temperaturę elektrolitu, uznając, że jest to temperatura wydzielonego gazu. Odczytujemy stan ciśnienia atmosferyczngo (barometr rtęciowy, pokój nr 14).
Obliczamy masy wydzielonych gazów korzystając ze wzoru:
![]()
gdzie: ρ0 jest gęstością, a V0 objętością gazu w warunkach normalnych.
Gęstość gazu ρ0 odczytujemy z tablic fizycznych. Natomiast V0 obliczamy z równania Clapeyrona wykorzystując dane eksperymentalne i mając na uwadze to, że w rurce woltametru znajduje się mieszanina wydzielonego gazu i pary wodnej nasyconej w danej temperaturze. Ciśnienie pary wodnej nasyconej w danej temperaturze można odczytać z tablic .
Mając dane masy wydzielonych gazów, „I” i „t” obliczamy równoważniki elektrochemiczne wodoru i tlenu. Oceniamy błąd pomiaru. Uzyskane wyniki porównujemy z danymi tablicowymi.
APARATURA
Aparat Hoffmana + dwie elektrody, zasilacz prądu stałego, opornica suwakowa 50 Ω, katetometr, amperomierz 0,75-3 A, roztwór wodny H2SO4 (elektrolit), barometr.
6
Wyszukiwarka
Podobne podstrony:
Ćwiczenie nr 34a, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwic
50B, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr50b
Ćwiczenie nr 35, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
Siatka dyfrakcyjna, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćw
F-71, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr71
Kopia 46, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, 46
Lorentza-Lorenza2, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwi
Badanie widma par rtęci za pomocą spektroskopu, studia, Budownctwo, Semestr II, fizyka, Fizyka labor
92-fotokomórka, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Gotowe
Ćwiczenie nr 44, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicz
Ćwiczenie nr 50a, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwic
Ćwiczenie nr 9, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwicze
LAWA-2, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwiczenie nr72
Ćwiczenie nr 33a, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria, Ćwi
Pierścienie Newtona1-teoria, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labola
Goniometr - przebieg ćwiczenia, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Lab
67-siatka dyfrakcyjna3, studia, Budownctwo, Semestr II, fizyka, Fizyka laborki, Fizyka - Labolatoria
więcej podobnych podstron