Ćw.: ION |
Data: 30,10,2006 |
Prowadzący: dr inż. J. Zembrzuska |
Wydział TCh |
Zespół 8 |
Wykonał: Marek Wąsowski
|
Ocena: |
|||
ELEKTRODY JONOSELEKTYWNE
Podział elektrod:
ze względu na role pełniącą w miareczkowaniu potencjometrycznym:
elektroda wskaźnikowa
elektroda odniesienia
ze względu na zachowanie:
obojętne
aktywne
ze względu na mechanizm reakcji elektrodowej:
elektrody pierwszego rodzaju
elektrody odwracalne względem kationu lub względem anionu
elektrody odwracalne względem wpółnago anionu
elektrody odwracalne względem wpółnago kationu
elektrody redoks
elektroda antymonowa i inne działające podobnie do niej
elektrody drugiego rodzaju
elektrody jonoselektywne stało- i ciekłomembranowe
elektrody selektywne gazowe
elektrody enzymatyczne
Potencjał elektrody.
![]()
E0- potencjał normalny elektrody
R- stała gazowa T- temperatura
n- liczba elektronów biorąca udział w reakcji
F - stała Faradaya
Równanie (Nernsta) wyraża potencjał dowolnej elektrody. Jest to wielkość, której absolutnej wartości nie potrafimy ani zmierzyć, ani obliczyć teoretycznie. Można tylko natomiast wyrazić liczbowo wielkość potencjału danej elektrody w odniesieniu do potencjału innej elektrody, mierząc siłę elektromotoryczna (SEM) ogniwa utworzonego z badanej elektrody i elektrody porównawczej. Za równy zeru został przyjęty potencjał elektrody wodorowej i w stosunku do niego przyjmuje się potencjały innych elektrod.
Budowa i działanie elektrody jonoselektywnej.
Elektroda jonoselektywne zwieraja w sobie specjalnie preparowaną membranę. Wewnętrzna powierzchnia połączona jest bez pośrednio z przewodnikiem elektronowym, bądź styka się z roztworem wewnętrznym w którym umieszczona jest elektroda wprowadzająca np. II rodzaju. Roztwór wewnętrzny musi zawierać jony na które czuła jest membrana i jony pozostające w równowadze z elektrodą wprowadzającą:
Ag, AgCl | roztwór wew.CuCl2 | membrana czuła na Cu2+| roztwór badany zawierający Cu2+
Na potencjał elektrody membranowej składa się poleciał międzyfazowy, tj. potencjał na granicy faz, powstający wskutek wymiany jonowej miedzy roztworem i faza membrany oraz potencjał dyfuzyjny odpowiadający procesom zachodzącym wewnątrz membrany. Dzięki temu dal elektrod membranowych jest słuszne równie wprowadzone prze Nikolskiego:
A(r) + B(m) = B(r) + A(m)
Indeks r oznacza roztwór, a m- membranę.
Stała równowagi reakcji wymiany jonowej jest opisana wzorem:
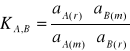
Stała KA,B nazywa się współczynnikiem selektywności elektrody. Jest ona miarą selektywności elektrody względem jonów A w porównaniu z jonami B.
Pomiary i obliczenia:
Próbka |
SEM [mV] |
Stężenie c [ppm] |
-log c [kg/l] |
Roz. 1 |
62 |
200 |
3,7 |
Roz. 2 |
102 |
40 |
4,4 |
Roz. 3 |
137 |
8 |
5,1 |
Roz. 4 |
171 |
1,6 |
5,8 |
Roz. 5 |
190 |
0,32 |
6,5 |
Roz. 6 |
208 |
0,064 |
7,2 |
Woda |
190 |
|
|
Pasta |
155 |
|
|
Z wykresu krzywej wzorcowej odczytuje zawartość fluorków.
Dla wody 0,31 ppm, natomiast dla pasty 2 ppm.
Woda.
0,31- |
1000 |
x- |
25 |
x = 0,00775 mg fluorków w badanym roztworze
0,00775- |
10 |
x- |
1000 |
x = 0,775 ppm fluorków w wodzie wodąciogowej.
Pasta.
2- |
1000 |
x- |
25 |
x = 0,05 mg fluorków w badanym roztworze
0,05- |
10 |
x- |
200 |
x = 1 mg fluorków w roztworze podstawowym.
1- |
23 |
x- |
1000 |
x = 43,5 ppm fluorków w paście do zębów.
Pobraliśmy 10 ml zawiesiny pasty która powstała przez rozpuszczenie 23 g pasty w 200 ml wody, wiec teoretycznie w naszej analizie powinno się znajdować 1,15 g czystej pasty.
Wnioski:
Zawiesina znacznie odbiega od definicji roztworu idealnego, dlatego też w naszej analizie znalazło się znacznie mniej pasty niż można by się spodziewać po obliczeniach. Wnioskuje, że w naszej analizie znalazło się znacznie mniej niż 1g pasty. Przy tak małych stężeniach najmilsza ilość niepożądanych substancji np. substancji wiążących fluorki w silne kompleksy, powoduje znaczne zaniżenie uzyskanych wyników. Porównując uzyskane wyniki - w wodzie wodociągowej jest o około 60 raz mniej jonów fluorków niż w 1 g pasty do zębów.
![]()
Wyszukiwarka
Podobne podstrony:
Sprawozdania z analizy instrumentalnej, ION (2), cwiczenie na ochr. srod.
Sprawozdania z analizy instrumentalnej, ASA spr, Ćw
Sprawozdania z analizy instrumentalnej, POL spr, Ćw
Sprawozdania z analizy instrumentalnej, POL, Polarografia
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
Sprawozdania z analizy instrumentalnej, AAS I, Atomowa Spektrometria Absorpcyjna
Sprawozdania z analizy instrumentalnej, MP, Miareczkowanie potencjometryczne
Sprawozdania z analizy instrumentalnej, SPF II (2), LABORATORIUM z CHEMII ANALITYCZNEJ
HPLC sprawozdanie, Analiza instrumentalna
Sprawozdania z analizy instrumentalnej, GC II, Chromatografia gazowa 1
Sprawozdania z analizy instrumentalnej, spf, Laboratorium Analizy Instrumentalnej
Sprawozdania z analizy instrumentalnej, Sprawozdanie SPF-max, Wydział Technologii Chemicznej
sprawozdanie1 cw.4, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
ćw 5, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 2(1), Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
cw 1, Technologia chemiczna, 5 semestr, analiza instrumentalna, sprawozdania
więcej podobnych podstron