PRYSZCZYCA
(aphtae epizooticae, foot and mouth disease)
Zaraza pyska i racic
Zakaźna, zaraźliwa i gorączkowa choroba parzystokopytnych bardzo szybko szerząca się
Uważana za najgroźniejszą chorobę zwierzęcą
Obrót zwierzętami, produktami zwierzęcego pochodzenia, nasieniem, zarodkami z krajów, w których występuje pryszczyca lub prowadzone są szczepienia przeciwko pryszczycy jest znacznie utrudniony lub wstrzymany
Występowanie:
Na całym świecie
Występuje cyklicznie: musi być duża zaraźliwość zarazka i duża wrażliwość zwierzęcia
Enzootycznie w Afryce, Ameryce Pd. Azji
Epizootycznie w Europie
Etiologia:
Rodzaj: Aphtowirus rodzina Picornaviridae (RNA)
Znanych jest 61 podtypów
Serotypy: A (Alemagnie) - 23 podtypy
O (Oise) - 11 podtypów
C - wyst. jednolicie
SAT 1 - 6 podtypów
SAT 2 - 3 podtypy
SAT 3 - 3 podtypy
Asia 1
Stabilny w pH 7 - 9, poniżej pH7 i powyżej pH 9 ulega inaktywacji
Duża oporność na czynniki fizyczne: 37oC po 12-24 godzinach; 60 - 65oC po 30 minutach, 80-100oC ginie natychmiast; -20oC zliofilizowany przeżywa wiele lat
W glebie, sierści - 1 miesiąc, w paszy 4-5 m-cy, w kale ii gnojowicy 45 dni, promieniowanie słoneczne 5 minut
Peklowanie, wędzenie i solenie skór nie inaktywuje zarazka. Zakaźność szpiku kostnego jeszcze po 45 dniach
Wrażliwy na działanie wysokiej temp., światła, niskiego pH
Niska temperatura przedłuża jego żywotność
Wrażliwy na 1-2% NaOH, roztwór octu i 0,5-1% kw. cytrynowy
Epizootiologia:
Atakuje zwierzęta parzystokopytne: bydło domowe, owce, kozy, świnie
Wolno żyjące: bizony, bawoły, żubry, jelenie, impala, kudu. Dzikie świnie w buszu stanowią naturalny rezerwuar zarazka.
Wrażliwy jest także człowiek
Wirus może zakażać słonie, wielbłądy i jeże.
Epizootie występują cyklicznie: musi być duża zaraźliwość zarazka i duża wrażliwość zwierzęcia
Przebycie infekcji jednym z podtypów, nie powoduje odporności na pozostałe
Zarazki wydalane już w okresie inkubacji
Szybko szerzy się w stadzie drogą łańcuchowo-pokarmowa
Endemicznie w większości krajów Afryki, Azji, Europy wschodniej, Ameryki Południowej.
Typy A, O i C występują w Ameryce Pd i okresowo w Europie łącznie z Turcją
Typy A, O, C i Asia 1- na Bliskim Wschodzie
Typy O, A, C i Asia 1- w centralnej i południowo-wschodniej Azji, Typy O, A i C - w Ameryce Pł
Typy O, A, C, SAT1, SAT2 - w Afryce zachodniej i centralnej
Typy O, A, C, SAT1, SAT2, SAT3 - w Afryce wsch i południowej
Źródła zakażenia:
Pierwotne - zwierzęta chore, ozdrowieńcy, bezobjawowi nosiciele
Wtórne - pasza, woda, sprzęt, środki transportu, ludzie, odpady poubojowe
Ślina, mocz, kał, mleko, wydzielina nosowo-gardłowa
Wydzielanie wirusa na początki obfite, spada zwłaszcza po kilku dniach po pęknięciu ostatnich pęcherzy
Zakażone zwierzęta wydalają wirus z wydychanym powietrzem oraz z wydzielinami i wydalinami
Rekonwalescenci są nosicielami nawet przez 3 lata (bydło domowe) i 5 lat (bawoły afrykańskie)
Wirus utrzymuje się w gardle i w każdej chwili może stać się przyczyną nowego ogniska choroby
Wykazano obecność wirusa w nasieniu buhajów na 4 dni przed pojawieniem się objawów klinicznych choroby. Występował 37 dni w nasieniu po ustąpieniu choroby.
Wirus pryszczycy występuje w dużych ilościach w mleku przed wystąpieniem objawów klinicznych i w trakcie ich trwania
Wrota:
Donosowo
Per os
Transplacentarnie (świnka)
Przez uszkodzoną skórę
Patogeneza:
Okres inkubacji 2 − 7 dni, max. 10
Wrażliwe są zwierzęta w każdym wieku,
Wirus wnika przez błony śluzowe górnych odcinków przewodu pokarmowego i układu oddechowego
Miejscem pierwotnego namnażania jest jama gębowa i jamo nosowo-gardłowa
Drogą limfy i krwi dociera do wszystkich narządów wewnętrznych
Wniknięcie i namnażanie (kom. nabłonkowe jamy ustnej) → pęcherze pierwotne (szybko zanikają) → krew i limfa → posocznica (towarzyszy temu gorączka i nasilające się objawy ogólne) → inne tkanki → po 2 - 4 dniach p. i. pęcherze wtórne (bł. śluzowa jamy ustnej, język, śluzawica, żwacz, szpara m-raciczna, korona, piętka, podstawy rogów, wymiona, pachwiny)
Pęcherze - nagromadzenie się limfy i wysięku zapalnego w warstwie kolczystej nabłonka, przy braku uszkodzenia jego warstwy rozrodczej → szybkie gojenie owrzodzeń powstających po pęknięciu pęcherzy
Przeciwciała w zakażeniach naturalnych już 4 dnia po zakażeniu, szczyt 7-14 dzień i zanikają w okresie 30 dni. Przeciwciała wczesne należące do IgM. Neutralizują szczepy homologiczne i heterologiczne wirusa.
Przeciwciałą IgG pojawiają się po 10-14 dniach i szczyt w okresie 28 dni, neutralizują wirusa i biorą udział w OWD.. Znacznie bardziej specyficzne w stosunku do poszczególnych typów i podtypów wirusa niż IgM
Odporność na zakażenie tym samym podtypem utrzymuje się około roku, czasami trwa nawet 4,5 roku.
Objawy:
gorączka 40,5 - 42°C, przyśpieszenie tętna, leukopenia, spadek apetytu, zanik perystaltyki
Gorączka, osowienie, brak apetytu
Pęcherze różnej wielkości na błonie śluzowej jamy gębowej, na koronce racic i w szparze międzyracicznej
Pęcherze na błonie śluzowej języka, podniebienia, dziąseł, policzków wypełnione słomkowożółtym płynem. Mogą być na śluzawicy, skórze otworów nosowych, strzyków i niekiedy na skórze wymienia.
Obfite ślinie, ślina jest gęsta i ciągliwa
Produkcja mleka gwałtownie maleje
Zachorowalność bydła wrażliwego 100 %
Zejścia śmiertelne u bydła dorosłego rzadko
U cieląt zejścia nagłe bez uprzednich objawów klinicznych
Charakterystyczna kulawizna, przestępowanie z nogi na nogę
Częste oblizywanie nozdrzy
Po kilku godzinach pęcherze na języku pękają tworząc owrzodzenia jasnoczerwonym dnie, mogące krwawić
Błona śluzowa szybko ulega regeneracji i po 5 - 8 dniach zwierzęta przyjmują pokarm normalnie
Pozostaje płytkie zagłębienie i pozbawione barwnika, białawe, utrzymujące się do pół roku miejsce
Zdarzają się wtórne pęcherze i nadżerki, prowadzące do włóknikowo-ropnych, rzekomobłoniczych zmian, opóźniających proces gojenia
Pęcherze w okolicy racic po pęknięciu z reguły zakażone wtórnie - kulawizny i uszkodzenia racic
Trwałe obniżenie wydajności mlecznej i niekiedy niepłodność
AP:
Pęcherze i nadżerki na błonie śluzowej jamy gębowej, skórze, koronce racic i w szparze międzyracicznej
Przy ciężkim przebiegu nagłe zejścia wtedy w sekcji prawi żadnych zmian
Ostre uszkodzenia mięśnia sercowego = zastój żylny i skrzepy w lewej komorze
Niekiedy w ścianie lewej komory i przegrodzie zmiany w postaci cor tigrinum, wtedy w worku osierdziowym duża ilość płynu
W pozostałych narządach brak zmian
Rozpoznanie:
W każdym przypadku ślinienia się zwierząt należy podejrzewać pryszczycę
Objawy kliniczne
Występowanie zachorowań u różnych gatunków zwierząt parzystokopytnych - prawie pewna diagnoza
Ostateczne rozpoznanie opiera się na laboratoryjnym wykazaniu wirusa pryszczycy w podejrzanym materiale. Najlepszym materiałem do badań jest nabłonek pęcherzy lub płyn z nich.
Płyn pobiera się jałowo za pomocą strzykawki z igłą, a nabłonek pękniętych pęcherzy w ilości 1 g, z miejsc jak najmniej zanieczyszczonych
Próbki nabłonka powinny zostać umieszczone w płynie transportowym: glicerol + 0,04 M bufor fosforanowy, pH 7,2 - 7,6, w równych objętościach
Próbki niezwłocznie umieścić w chłodzie lub zamrozić i w takim stanie dostarczyć do laboratorium
Alternatywnym źródłem wirusa może być krew lub wymazy z gardła
Przy złośliwym przebiegu - wycinki mięśnia sercowego lub krew padłego zwierzęcia
Antygeny wirusa pryszczycy wykrywa się w odczynie wiązania dopełniacza (OWD) lub testem ELISA z zastosowaniem surowic specyficznych dla 7 serotypów wirusa
Również techniki wykrywające wirusowy kwas nukleinowy, np. reakcja polimeryzacji łańcuchowej (PCR) lub hybrydyzacja in situ
Wynik badania w dużej mierze zależy od jakości próbek
Jeśli bezpośrednie badanie w OWD nie jest możliwe, wykonuje się pasaż w hodowli komórek tarczycy lub nerki cielęcia względnie wrażliwych linii ciągłych i bada płyn z hodowli w OWD lub ELISA na obecność wirusa pryszczycy
Można wykonać pasaż na 5-7 dniowych myszkach
Wyjątkowo stosuje się próba biologiczną z użyciem zwierząt gospodarskich
Może być pomocne badanie serologiczne, o ograniczonej jednak wartości diagnostycznej u zwierząt szczepionych, jak również na rejonach endemicznego występowania- efekt przebycia infekcji
Postępowanie:
Pryszczyca jest chorobą zwalczaną z urzędu i podlegającą obowiązkowi zgłaszania
Podstawa - przerwanie szerzenia się wirusa poprzez unieszkodliwienie źródeł zakażenia
Wokół ogniska choroby okręg zapowietrzony o promieniu co najmniej 3 km, a wokół niego okręg zagrożony - w nim ścisła obserwacja stanu zdrowia i kontrolę ruchu zwierząt lub podejmuje szczepienia pierścieniowe szczepionką odpowiadającą kompozycją antygenową izolowanym szczepom. Głębokość okręgu zagrożonego co najmniej 7 km
Wstrzymanie ruchu zwierząt, ograniczenie ruchu ludzi
W ognisku choroby ubojowi poddaje się wszystkie zwierzęta parzystokopytne, aby ograniczyć ilość wirusa wydalanego do środowiska przez zakażone lub chore zwierzęta
Ubojowi poddaje się również wszystkie zwierzęta, które miały bezpośredni kontakt ze zwierzętami chorymi lub zakażonymi.
Zwierzęta z ognisk pryszczycy mogą zostać usunięte jedynie przy pomocy zamkniętych, szczelnych samochodów do wyznaczonej rzeźni zlokalizowanej w okręgu zagrożonym w celu niezwłocznego uboju.
Zakwaszenie przy dojrzewaniu tuszy po uboju skutecznie inaktywuje wirusa
Groźne sa odpady rzeźniane i kości (szpik), gdzie zmiana pH nie następuje. Muszą być poddane obróbce termicznej.
Mleko również musi być poddawana obróbce termicznej
Prowadzi się dezynfekcje odzieży i rąk osób bezpośrednio obsługujących zwierzęta, a także pomieszczeń dla zwierząt i środków transportu.
Takie postępowanie skuteczne jest w rejonach gdzie pryszczyca występuje sporadycznie
Na obszarach, gdzie pryszczyca występuje endemicznie - izolowanie zwierząt w ogniskach zakażenia przy równoczesnym szczepieniu osobników zagrożonych i ograniczeniu ruchu zwierząt i ludzi.
Szczepionki zawierają inaktywowany wirus i mogą być mono-, dwu-, trój- i wieloważne
Pierwsze szczepienie zapewnia odporność u przeżuwaczy na okres 3-6 m-cy
Kolejne dawki uodparniają na okres około 12 m-cy, u owiec odporność trwa 6 m-cy
W przypadku dużego zagrożenia szczepionkę podaje się trzykrotnie ( 3 x ) w ciągu roku
W rejonach o małym zagrożeniu w pierwszym roku szczepi się bydło 2 x, a następnie doszczepia 1 x w roku.
Przeciwciała matczyne u cieląt 3 - 6 m-cy i mogą interferować ze szczepionką, stąd pierwsze (I) szczepienie w wieku 2-6 m-cy.
W wielu krajach rezerwa antygenów (inaktywowanych i zagęszczonych wirusów pryszczycy różnych serotypów) na wypadek wybuchu choroby - rezerwa epizootyczna
Szczepionki nie chronią w pełni przed poryszczycą jeżeli nie poda się trzech (III) dawek
Poważną wadą szczepień jest niemożność uodpornienia świń, a także częste wybuchy choroby wskutek niedostatecznej inaktywacji wirusa szczepionkowego
Jeśli choroba wystąpiła w rejonie dotąd wolnym od pryszczycy, w którym nie prowadzono szczepień i zastosowano omówione wcześniej środki administracyjne, taki region można uznać ponownie za wolny w sześć (6) miesięcy po zabiciu ostatniego zwierzęcia chorego lub podejrzanego o zakażenie, przy czym powinien być stosowany monitoring serologiczny pryszczycy
Jeśli choroba wystąpiła w rejonie dotąd wolnym, w którym prowadzone były szczepienia profilaktyczne i zastosowano środki administracyjne, taki teren może uzyskać status regionu wolnego od pryszczycy po 12 miesiącach od zabicia ostatniego zwierzęcia chorego, podejrzanego o zakażenie, ale dopiero po 24 miesiącach jeżeli nie wybito zwierząt parzystokopytnych w okręgu zapowietrzonym.
Wytyczne OIE zobowiązują do oceny ryzyka związanego z wprowadzeniem na teren UE (lub/i krajów członkowskich) z krajów trzecich:
Domowych i wolno żyjących przeżuwaczy
Nasienia bydła i świń
Zarodków bydła i świń
Mięsa świeżego od przeżuwaczy domowych i wolno żyjących
Produktów pochodzących od przeżuwaczy domowych i wolno żyjących przeznaczonych do spożycia dla człowieka, żywienia zwierząt, przetwórstwa przemysłowego
Produktów pochodzących od przeżuwaczy domowych i wolno żyjących przeznaczonych do przetworzenia w przemyśle farmaceutycznym
Niejałowych produktów biologicznych
Zagrożenie dla człowieka
Zachorowania sporadyczne ale bywają endemiczne podczas trwania epizootii u bydła
Szerzy się przez spożywanie surowego mleka, bezpośredni kontakt ze zmianami skórnymi chorych zwierząt np. podczas dojenia
Okres inkubacji kilka dni
Bolesne pęcherze na wargach, policzkach i brzegach języka, rzadziej na dłoniach, stopach, twarzy, spojówkach
Przy wtórnych zakażeniach trudno gojące się owrzodzenia
Objawy ogólne - gorączka, bóle głowy, osłabienia, trudności w połykaniu, ślinotok
Samowyleczenie, a powrót do zdrowia po 1-2 tygodniach
Diagnostyka różnicowa :
stomatitis vesicularis - chorują Eq i Su
choroba pęcherzykowa - tylko Su
głowica, MD/BVD, IBR - brak charakterystycznych zmian na kończynach
księgosusz
choroba niebieskiego języka
ospa - zmiany rozpoczynają się od małych pęcherzyków, brak dużych
Leczenie: ZABRONIONE, CHOROBA ZWALCZANA Z URZĘDU
KSIĘGOSUSZ
Pomór bydła
Pestis bovum, cattle plaque
Ostra, wirusowa, o dużej śmiertelności choroba bydła domowego i bawołów. Na zakażenie wrażliwe są również owce, kozy i wolno żyjące przeżuwacze
Charakteryzuje się gorączką, płytkimi owrzodzeniami na błonie śluzowej dziąseł, języka, policzków i podniebienia twardego.
Surowiczy lub śluzowo-ropny wyciek z nozdrzy i worków spojówkowych oraz silna biegunka
Etiologia:
Wirus księgosuszu należy do rzędu Mononegavirales, rodziny Paramyxoviridae, podrodziny Paramyxovirinae, rodzaju Morbillivirus.
Morbillivirus: obejmuje obecnie wirusy: odry, księgosuszu, nosówki psów, pomoru małych przeżuwaczy, nosówki fok oraz morbiliwirusy delfinów i morświnów (wirus nosówki delfinowatych)
Szczepy wirusa księgosuszu różnią się między sobą zjadliwością, inwazyjnością i tropizmem tkankowym
Wiriony pleomorficzne o kształcie sferoidalnym, średnicy 100-150 nm lub kształtu długiej nici z wypustkami
Wrażliwy na temperaturę i światło
Wrażliwy na czynniki fizyko-chemiczne
Gnicie powoduje szybką inaktywację
W nawozie, na ścianach, podłodze nie dłużej niż 24 godziny
W mięsie dojrzewającym krótko, w mięsie solonym i zamrożonym kilka miesięcy
Skóry suszone nie są zakaźne
Epizootiologia:
Endemicznie w Afryce oraz w południowej Azji
Wygasł w Polsce w 1920 roku
Wrażliwe bydło domowe i bawoły odpowiedzialne za utrzymanie epizootii
W rejonach endemicznych zachorowania dotyczą określonej grupy wiekowej
Bydło dorosłe - odporne po przechorowaniu lub szczepieniu, cielęta - chronione przez p.ciała siarowe
Najbardziej wrażliwe na zakażenie jest młode bydło w wieku około 12 m-cy
Małe przeżuwacze, jako alternatywny rezerwuar zarazka
Chorować mogą wielbłądy a w Azji chorują świnie (europejskie nie chorują pomimo wrażliwości na zakażenie)
Od 1942 roku znane jest na terenie zachodnie Afryki pojęcie pomoru małych przeżuwaczy, jest to choroba powodowana przez szczepy wirusa księgosuszu, które utraciły zdolność zakażania bydła drogą naturalną
Przenoszenie drogą aerogenną, rzadko przez karmę lub wodę do picia
Najgroźniejsze nowo wprowadzone do stada zwierzę
Wirus nie przenika przez nieuszkodzoną skórę i błonę śluzową p.pokarmowego
Skuteczne sztuczne zakażenie przez spojówki i drogi oddechowe
Wydalanie wirusa 3 tygodnie, wyjątkowo 12 tygodni, po tym okresie organizm całkowicie uwalnia się od wirusa i jest odporny do końca życia. Brak długotrwałego nosicielstwa i siewstwa
Patogeneza:
Wirus wnika przez błony śluzowe górnych dróg oddechowych
Miejscem pierwotnego namnażania migdałki oraz zagardłowe węzły chłonne
Krwioobieg, zakaża głównie limfocyty i monocyty
Wiremia 1-2 dni przed pojawieniem się objawów klinicznych
Namnażanie w bł.śl. przewodu pokarmowego i oddechowego oraz płucach
Powstają nadżerki, na ich obrzeżach włóknik tworzący złogi
Biegunka, szybkie odwodnienie , ciężkie zaburzenia w krążeniu i zejście śmiertelne
W momencie pojawienia przeciwciał miano wirusa gwałtownie spada
Długość okresu wiremii zależy od szczepu wirusa i odporności zwierzęcia
Wydalanie wirusa ze wszystkimi wydzielinami i wydalinami, głownie z worka spojówkowego, nosa i z kałem
Wydalanie w okresie gorączkowym i przez kilka dni po ustąpieniu gorączki
Objawy kliniczne:
Okres inkubacji 4-7 do 15 dni i zależny od zjadliwości szczepu
Przebieg:
Ostry
Poronny
Bezobjawowy
Klasyczny przebieg: ostra gorączka, nadżerki w jamie gębowej, zapalenie żołądków i jelit, biegunka, odwodnienie, zejście śmiertelne
Napad gorączki nagły, bez zmian na błonach śluzowych, w 2 dniu 41,5 -42°C; najpierw niepokój później apatia
Śluzawica sucha, włos nastroszony, oddechy przyspieszone, spadek wydajności mlecznej, bł.śl. zaczerwienione
Nadżerki na bł.śl. jamy gębowej, dróg oddechowych i układu moczowo-płciowego po 2-5 dniach od wystąpienia gorączki
Nadżerki powiększają się i pokrywają grubym żółtawym nalotem obumarłych komórek
W jamie nosowej śluzowo-ropna, cuchnąca, wydzielina
Zwiększone pragnienie, rzadki kał, biegunka, odwodnienie
Kał cuchnący z domieszką mas nekrotycznych, śluzu i krwi
Oddech ciężki i bolesny, opuszczona głowa, oczy zapadnięte, grzbiet łukowato wygięty
Śmierć większości chorych zwierząt w okresie 6-12 dni od wystąpienia choroby
U krów ciężarnych - ronienia
W formie poronnej - łagodna biegunka
Brak nadżerek w jamie gębowej
Bezobjawowo - tylko badanie serologiczne wskazują na trwające lub przebyte zakażenie
U bydła w pełni wrażliwego - rokowanie niepomyślne. W przypadku wystąpienia biegunki z reguły zejście śmiertelne.
Współczynnik śmiertelnośći u bydła wysokomlecznego od 95 do 99 %, u ras prymitywnych 50-66 %
Sekcja:
Zmiany podobne jak przy BVD-MD
Zwłoki wychudzone i odwodnione
Okolica odbytu ze śladami kału
Błona śluzowa jamy gębowej - ogniska martwicy i powierzchowne nadżerki z nalotami włóknika
Bł.śl. żołądka zapalnie zmieniona z silnym nacieczeniem
Jelita cienkie silnie przekrwione z punkcikowatymi wybroczynami
Podobnie jelita grube
Pęcherzyk żółciowy silnie powiększony, wypełniony żółcią
Histopatologia mózgowia - rozsiane okołonaczyniowe nacieki limfocytarne
Pod wsierdziem w lewej komorze serca, pod nasierdziem podstawy serca i wzdłuż naczyń wieńcowych liczne wybroczyny
Rozpoznawanie
Wywiad, w rejonach występowania enzootycznego
Objawy kliniczne
Zmiany anatomopatologiczne
Badania laboratoryjne - obejmujące wykazanie obecności antygenów wirusa księgosuszu
Rzadziej izolacja i identyfikacja wirusa
Zwłoki nie są dobrym materiałem do badań, mało wirusa.
Wybrać 6-10 osobników z gorączką i nadżerkami
Pobrać krew na surowice i do badań hematologicznych, wymazy z worka spojówkowego oraz nekrotyczną masę z nadżerek
Ubój 2 zwierząt z tej grupy w celu pobrania węzłów chłonnych, śledziony i migdałków
Podstawowym odczynnkiem diagnostycznym jest surowica antywirusowa, uzyskana po uodpornieniu królika szczepem Yamanouchi/Nakamura III
Antygen wykrywa się w tkankach techniką przeciwwsobnej immunoelektroforezy lub odczynem precypitacji w żelu agarowym - jeżeli ujemne to
Ekstrakt z węzłów chłonnych bada się OWD - jeżeli ujemne to
10 % zawiesiną śledziony i migdałków zakaża się wrażliwe bydło lub kozy. Okres obserwacji 3 tygodnie
Rozpoznanie różnicowe:
Wirusowa biegunka bydła i choroba błon śluzowych (BVD-MD)
Pomór małych przeżuwaczy
Pryszczycę
Głowicę
Postępowanie:
Choroba zwalczana z urzędu i podlegająca obowiązkowi zgłaszania
Na terenach wolnych bydła podejrzanego o zakażenie nie leczy się, podlegają eutanazji, a zwłoki utylizacji
Kraje wolne - zakaż importu bydła z regionów enzootycznego występowania choroby
Możliwe zawleczenie ze zwierzętami egzotycznymi do ogrodów zoologicznych (Rzym 1951)
Ścisłe rygory zoosanitarne
Program GREP (Global Rinderpest Eradication Programme)
ZARAZA PŁUCNA BYDŁA
pleuropneumonia contagiosa bovum, contagious bovine pleuropneumonia
Ostra, podostra lub przewlekła choroba bydła przebiegająca z włóknikowym zapaleniem płuc, surowiczo-włóknikowym zapaleniem opłucnej oraz obrzękiem przegród międzypęcherzykowych
Etiologia:
Chorobę powoduje Mycoplasma mycoides subspecies mycoides S.C. type Freundt, 1955
SC (small colonies) - biotyp wystepujący u bydła.
Antygenowo podobne szczepy LC (large colonies0 stwierdza się u kóz w krajach, w których zaraza płucna nie występuje
Formę S.C. Można odróżnić od formy LC na podstawie właściwości biochemicznych i z tym związanej morfologii kolonii.
Wykazuje pleomorfizm, w młodych hodowlach nitkowata, rozgałęziająca sier, w starych - ziarniakowata
Mycoplasma mycoides jest bardzo wrażliwa na czynniki środowiska zewnętrznego, szybko ulega inaktywacji poza organizmem.
Epizootiologia:
Choroba znana od XVII wieku
Główny gospodarz bydło
Niektóre gatunki przeżuwaczy żyjące w Afryce odporne na MmmSC
Z dziko żyjących przeżuwaczy tylko bizony amerykańskie są wrażliwe
Wystepuje w Afryce, z wyjątkiem południowej, na Bliskim Wschodzie, w Indiach, Nepalu i zachodniej części Chin
W Europie endemicznie w określonych rejonach Hiszpanii, Portugalii i Włoch
Patogeneza:
Droga aerogenna
Szerzenie w stadzie powolne poprzez kontakt bezpośredni
Ważna rola nosicieli, majacych w płucach otorbione włóknikiem ognisko. MmmSC trwa tam wiele mieisęcy. Z czasem torebka wł. Pęka i następuje siewstwo z wydychanym powietrzem
Objawy kliniczne:
Okres inkubacji 3 do 6 tygodni, z możliwością wydłużenia do 4 m-cy
Postać ostra - gorączka trwająca 3-10 dni, brak apetytu, przyspieszone oddechy, depresja
Suchy, bolesny kaszel, nasilający się, postawa z wyciągniętą głową, łukowato wygiętym grzbietem i odstawionymi od tułowia łokciami
Wydajność mleczna obniżona
Przy postępie choroby objawy coraz silniejsze, zwierzęta chudną, obrzęki, temperatura 41 -42°C, tętno i oddechy przyspieszone
Współczynnik śmiertelności przy ostrej CBPP może dochodzić do 50%
Śmierć następuje zwykle w okresie 3 tygoni od pojawienia się objawów
Zwierzęta, które przechorowały ostrą postać CBPP, słabe i wyniszczone pozostają nosicielami MmmSC
Częściej postać podostra i przewlekła
Objawy łagodne, często nie zauważalne
U cieląt w wieku do 6 miesięcy CBPP występuje jako zapalenie stawów z kulawizną.
Sekcja:
W ostrej postaci w płucach cechy ciężkiego zapalenia włóknikowego
Płuca na przekroju charakter marmurkowaty, obrzęknięte i zabarwione ciemnoczerwone
Przegrody międzyzrazikowe pogrubione
W jamie opłucnowej wysięk, opłucna pkryta włóknikiem
Otorbione ogniska o średnicy od 1 do 20 cm, mogące otwierać się do oskrzeli, wydalanie mykoplazm
Rozpoznanie:
Badania kliniczne i sekcyjne nie dają podstaw do rozpoznania CBPP, sugerują podejrzenie
Decydujące jest badanie laboratoryjne
Przyżyciowo pobiera się wymazy z nosa, wydzielinę oskrzelowa, płyn z jamy opłucnowej po nakłuciu ściany klatki piersiowej w najniższym punkcie pomiędzy siódmym a ósmym żebrem,; maź stawową
Pośmiertnie zmienioną tkankę płucną, węzły chłonne śródpiersiowe, płyn opłucnowy i maź stawową
Brak izolacji nie zawsze oznacza brak zarazka w badanym materiale
Izolacja przy pomocy specyficznych dla mykoplazm podłoży
Test immunofluorescencji
Test precypitacji w żelu agarowym
Odczyn OWD wykrywający przeciwciała MmmSC u przewlekle zakażonych
Test ELISA
Postępowanie:
Choroba zwalczana z urzędu
Przy zawleczeniu postępowanie radykalne likwidujące ognisko choroby
Zakaz importu z krajów, w których występuje CBPP
W krajach z chorobą uodparnianie czynne
GUZOWATA CHOROBA SKÓRY BYDŁA
(lumpy skin disease, LSD)
Choroba wirusowa przebiegająca z gorączką, powstaniem twardych ograniczonych guzów w skórze, wyniszczenie, powiększenie węzłów chłonnych i obrzęk skóry. Zmiany także w mięśniachszkieletowych oraz w błonach śluzowych przewodu pokarmowego i układu oddechowego. Niska śmiertelność
Etiologia:
Wirus należący do rodziny Poxviridae, rodzaj Capripoxvirus (określany jako neethling)
Antygenowo identyczny z wirusem ospy owiec i kóz, nie zakaża jednak owiec i kóz i nie przenosi się między nimi
Tylko jeden serotyp
Oporny na działanie czynników środowiskowych
Epizootiologia:
Stwierdzona w Zambii w 1929 rku
Występuje w Afryce, tylko raz stwierdzona poza Afryką, Izrael 1989 r.
Wrażliwe tylko bydło
Wektorem są komary (mechanicznym) i inne owady kłująco-ssące
Szerzy się szybko szczególnie w porze wilgotnej i w nisko położonych wilgotnych terenach
Patogeneza:
Guzki w skórze prawdopodobnie w miejscach ukłucia owadów i wprowadzenia wirusa
Bydło o delikatnej, cienkiej skórze choruje ciężej
Przebieg subkliniczny do zejść śmiertelnych
Nie przenosi się na człowieka
Objawy kliniczne:
Ostra postać:
Podwyższenie temperatury ponad 41°C, utrzymująca się przez 7 dni
Nieznany okres nkubacji w warunkach naturalnych (eksperyment 5 dni)
Niechęć do poruszania się
Brak apetytu
Wzmożone ślinienie
Wypływ z nozdrzy i worka spojówkowego
Guzy na skórze z podniesieniem temperatury
Guzy o średnicy 0,5 do 7 cm na całej skórze, najliczniej na głowie, wokół nozdrzy i oczu oraz karku, gruczole mlekowym, w okolicy krocz i moszny. Sierść na nich nastroszona
Zbite, obejmują wszystkie warstwy skóry
Mogą ulegać owrzodzeniu i wtedy wypływa z nich wydzielina zawierająca wirus
Wypływ z worka spojówkowego i nosa śluzowo-ropny
Guzki mogą być w jamie gębowej, mięśniach, tchawicy, przewodzie pokarmowym, głównie trawieńcu oraz w płucach
Obserwowane poronienia, skóra płodów pokryta guzami
U bahajów trwała lub przemijająca niepłodność
Sekcja:
Guzy skórne na przekroju szaro-różowa masa z nekrotycznym rdzeniem
Tkanki podskórne nacieczone surowiczym płynem o zabarwieniu czerwonym
Wewnątrzplazmatyczne ciałka wtrętowe w komórkach nabłonkowych, makrofagach i limfocytach
Rozpoznanie:
Najszybciej - wykazać w elektronowym mikroskopie transmisyjnym typowych wirionów wirusa w materiale pochodzącym z biopsji guzów
Badanie kliniczne - guzy
Powiększenie węzłów chłonnych powierzchownych
Postępowanie:
Choroba zwalczana z urzędu
Próby leczenia nieudane
W rejonach enzootycznego występowania szczepionki żywe atenuowane
Próby ze szczepionką rekombinowaną (pokswirus owiec z wklonowanym genem wirusa księgosuszu)
ZAKAŹNE ZAPALENIE NOSA I TCHAWICY
Otręt bydła
Exanthema coitale vesiculosum s. pustulosum
Infectious pustular balanoposthitis, IPB, IBP
Infectious bovine rhinotracheitis (red nose)/infectious pustular vulvovaginitis, IBR/IBV
Etiologia:
Wirusy powodujące zakźne zapalenie nosa i tchawicy bydła (IBR), pęcherzykowe zapalenie błony śluzowej sromu i pochwy krów (IPV), poronienia, pęcherzykowe zapalenie błony śluzowej pracia i napletka u buhajów (IPB,IBP) wykazują wiele cech wspólnych
Należą do rodziny Herpesviridae, podrodziny Alphaherpesvirinae, rodzaju Varicellovirus i określane są jako herpeswirus bydła typ 1 (BHV1) tworzą grupę nazwaną bovid herpesvirus 1 (BHV 1) (wcześniej IBR/IPV)
Typowy przedstawiciel rodziny Herpesviridae
Genom zawiera dwuniciowy DNA kodujący 30-40 białek strukturalnych, analiza restrykcyjna wirusowego DNA pozwoliła wyróżnić trzy podtypy BHV:
Podtypy 1 i 2a (IBR-podobne)
Podtyp 2b (IPV-podobny)
Niezależnie od różnic w budowie genomu BHV 1, występuje jako jeden typ antygenowy
BHV 1 ma otoczkę zawierającą lipidy - duża wrażliwość na środki dezynfekcyjne
W środowisku zewnętrznym przeżywa 30 dni w okresie zimowym
W temperaturze 37°C ginie po 10 dniach
Poniżej -65°C zakaźność przez długi czas
W -20°C rok
Stabilny w pH 6,0 - 9,0
Epizootiologia:
BHV 1 szeroko rozpowszechniony w populacji bydła na świecie
Przeciwciała u wielu gatunków zwierząt wolno żyjących, ale objawy kliniczne zakażenia tylko u bydła domowego
BHV1 izolowano również od kleszczy, mogą one być nosicielami wirusa przez długi czas, a nawet BHV 1 może namnażać się w kleszczach
Herpesviridae wywołują zakażenia latentne, lokalizujące się głównie w komórkach zwojów nerwowych, np.. Zwoju nerwu trójdzielnego
Utrzymują się przez całe życie zwierzęcia, okresowo, stress, dochodzi do reaktywacji, replikacji i siewstwa wirusa
Siewstwu nie towarzysza objawy kliniczne natomiast zakażają się kolejne osobniki
Wirus zawlekany jest do stada wraz z chorymi lub bezobjawowo zakażonymi zwierzętami
W obrębie stada szerzy się na drodze kontaktu bezpośredniego drogą aerogenną, poprzez krycie i sztuczną inseminację zakażonym nasieniem (BHV 1 jest wirusem najczęściej izolowanym z nasienia buhajów) oraz pośrednio przez zanieczyszczony sprzęt
BHV 1 przenoszony jest przez:
Zwierzęta, które uległy zakażeniu, nie wykazują objawów klinicznych, ale są siewcami wirusa
Zwierzęta zakażone latentnie, u których dochodzi do reaktywacji i siewstwa w przypadku stresu
Zwierzęta (cielęta), które uległy zakażeniu tuż po porodzie i u których zanika bierna odporność siarowa
IBR/IPV namnaża się górnych odcinkach dróg oddechowych osiągając miano 107.5 TCID50
IBR powoduje znaczne straty w hodowli bydła i ocenia się , że jest drugim schorzeniem w świecie co do częstotliwości występowania
Patogeneza:
Na zakażenie BHV1 wrażliwe jest bydło w każdym wieku
Wirus wnika przez błonę śluzową jamy nosowej osiągając wysokie miana w miejscu wniknięcia
Przenosi się na błonę śluzową worka spojówkowego
Drogą włókien nerwowych dociera do zwoju trójdzielnego. Na tym etapie możliwa wiremia
II droga - przez błonę śluzową układu rozrodczego
Namnaża się w komórkach bł. śl. Przesionka pochwy, pochwy właściwej,a u samców w komórkach bł. śl. worka napletkowego
Dociera do zwojów krzyżowych i to latentne zakażenie komórek nerwowych
Materiał genetyczny BHV1 pozostaje w neuronach zwojów przez całe życie
Stres powoduje reaktywację zakażenia latentnego, efektem jest okresowe siewstwo
Buhaje zakażone latentnie mogą być siewcami wirusa BHV1, nie wykazując przy tym żadnych objawów klinicznych choroby
Przechowywanie nasienia w niskich temperaturach stwarza dobre warunki do przeżywania wirusa
Transfer zarodków nie powoduje niebezpieczeństwa transmisji BHV1
Objawy kliniczne:
Zakaźne zapalenie nosa i tchawicy IBR:
Okres inkubacji 2-4 dni
Surowiczy wypływ z nosa i worka spojówkowego
Ślinienie
Gorączka powyżej 41°C
Brak apetytu
Depresja
Jasnożółte pęcherzyki z płynem surowiczym na bł. śl. nosa,
Po kilku dniach wypływ ropny
Zmiany opryszczkowe przekształcają się w ogniska nekrotyczne pokryte białawym nalotem złuszczonego nabłonka, często przechodzą w owrzodzenia pokryte warstwą włóknika
Zwężanie dróg oddechowych powoduje, że zwierzęta oddychają przez jamę gębową
Powrót do zdrowia po 4-5 tygodniach
U ciężarnych ronienia
W okresie laktacji spadek wydajności mlecznej
Bez zakażenia wtórnego choroba trwa 5-10 dni. Np.. Pasteteurella może powodować powikłania i zejście procesu zapalnego do płuc
Pęcherzykowe zapalenie błony śluzowej sromu i pochwy (IPV) [endometritis, powtarzanie rui, poronienia]
Pierwsze objawy u krów w 2-4 dniu po kryciu, po inseminacji nasieniem z wirusem lub po kontakcie z osobnikiem zakażonym
Zmiany opryszczkowe na bł. śl. Tylnego odcinka pochwy
Obrzęk i przekrwienie bł. śl., srom obrzękły, śluzowata wydzielina brudzi ogon
Zwierzęta niespokojne, często napinające się do oddawania moczu (bolesność w okolicy krocza)
Temperatura 40,5 - 41,5°C
Objawy kliniczne utrzymują się przez 8-14 dni, po czym bł.śl. Pochwy pokrywa się nowym nabłonkiem
Pozostają czerwone wyniosłości, wielkości łebka szpilki, mogące ulegać silniejszemu przekrwieniu w przypadku reinfekcji
U buhajów zmiany na bł. śl. Napletka oraz prącia mają podobny charakter jak u krów
Nabłonek błony śluzowej „posypany otrębami”
Buhaje eliminuje się z dalszego użytkowania
U cieląt zakażenie BHV! Przebiega ze zmianami nekrotycznymi w jelitach i narządach wewnętrznych - są apatyczne, osłabione, wykazują podwyższoną temperaturę
Sekcja:
IBR - :
bł.śl. górnych dróg oddechowych przekrwione, obrzękłe, śluzowo-ropna wydzielina, złogi włóknika
W krtani i tchawicy wybroczyny
Zatoki wypełnione wysiękiem
Histopatologicznie - ciałka wtrętowe Cowdry'ego typu A
Zmiany zapalne w komórkach zwoju nerwu trójdzielnego i OUN
W przewodzie pokarmowym, o ile zajęty:
Nadżerki i owrzodzenia bł.śl., policzków warg, dziąseł, podniebienia twardego, przełyku, przedżołądkach i w trawieńcu
W jelitach stan zapalenia nieżytowego
Ogniska martwicze w kępkach Peyera i w wątrobie
W układzie rozrodczym:
Zapalenie bł.śl. Sromu, pochwy, szyjki macicy, a u samców napletka i prącia
Pęcherzyki, wypełnione surowiczym płynem, rozsiane po całej błonie śluzowej
Proces zapalny może obejmować macicę i wtedy endometritis, u samców stulejka
Poroniony płód : wątroba żółto zabarwiona o zaokrąglonych brzegach, w miąższu ogniska nekrotyczne, w korze nerek liczne wybroczyny
Zakażenie BHV1 w układzie nerwowym:
Okołonaczyniowe nacieki
Ciałka wtrętowe w komórkach nerwowych i astrocytach
Oprócz tego, meningoencephalitis stwierdzane u cieląt może być powodowane przez herpeswirus bydła typ 5 (BHV5)
Rozpoznanie:
Objawy kliniczne nasuwają podejrzenie zakażenia BHV1
Ostateczne rozpoznanie na podstawie badań laboratoryjnych:
Izolacja i identyfikacja wirusa i/lub stwierdzenie obecności specyficznych przeciwciał
Materiał do bad. lab - wymazy z nosa, wymazy lub popłuczyny u samic z pochwy, u samców z napletka
Wymazy powinny być pobrane w najwcześniejszej fazie zakażenia
Podczas sekcji do badań pobiera się: wycinki błon śluzowych, migdałki, wycinki płuc, węzły chłonne oskrzelowe. Z poronionego płodu: wątrobę, płuca, śledzionę. Łożysko
Jeśli w stadzie przypadki zachorowań to pobieramy próbki od zwierząt z typowymi objawami klinicznymi, przede wszystkim z gorączką. Od kilku osobników w różnym wieku.
Do izolacji wirusa używa się pierwotnych hodowli komórek nerki lub jąder cielęcia lub hodowli komórek linii ciągłych, np.. Medin-Darby bovine kidney (MDBK) lub komórek tchawicy
Identyfikacja wyizolowanego wirusa w testach: immunofluorescencji, immunoperoksydazowym, seroneutralizacji z monowalentną surowicą odpornościową lub przeciwciałami monoklonalnymi
Test izolacji pozwala wykryć wirusa BHV1 obecnego w nasieniu w koncentracji 1-5 TCID50
Badania serologiczne wykonuje się w celu:
Potwierdzenia etiologii ostrego procesu klinicznego; w tym celu bada się jednocześnie parę surowic pobraną od tego samego zwierzęcia w fazie ostrej i w okresie rekonwalescencji; stwierdzenie serokonwersji albo czterokrotny lub większy wzrost miana przeciwciał wskazuje na zakażenie wirusem BHV1
Wykazania, że badane zwierzę nie jest zakażone latentnie wirusem BHV1
Określenia stopnia rozprzestrzenienia wirusa BHV1 w stadzie/populacji zwierząt
Badawczym, do oceny odpowiedzi immunologicznej po podaniu szczepionki i zakażeniu kontrolnym
Najczęściej test seroneutralizacji (SNT) i różne odmiany testu ELISA stosuje się do wykrywania przeciwciał.
Każde zwierzę, u którego stwierdzono obecność przeciwciał uważane jest za nosiciela wirusa i potencjalnego siewcę
Wyjątkiem są młode cielęta, które nabyły przeciwciała z siarą (odporność bierna)
Oraz niezakażone osobniki. Którym podano szczepionkę inaktywowaną.
Postępowanie:
Choroba zwalczana y urzędu
W przebiegu stosuje się antybiotyki o szerokim spektrum działania, przeciwdziałając wtórnym infekcjom bakteryjnym
Szczepienia nie zapobiegają zakażeniom szczepami terenowymi, nie zapobiegają siewstwu u zwierząt zakżonych latentnie
Nierzadko szczepy atenuowane, zawarte w szczepionkach żywych, powoduja zakażenia latentne i poronienia u krów
Najlepszym rozwiązaniem jest hodowla i utrzymywanie w stadzie osobników wolnych od zakażenia wirusem BHV1
Warunek ten spełniają zwierzęta seronegatywne w testach SNT lub ELISA
Prowadzenie elitarnych stad ze ścisłą higieną i przestrzeganiem przepisów o obrocie zwierzętami i nasieniem
Badanie serologiczne całego pogłowia zwierząt w danej hodowli co najmniej raz w roku.
Wszystkie zwierzęta wprowadzane do stada powinny być badane serologicznie dwukrotnie w okresie kwarantanny
Tylko osobniki seronegatywne można wprowadzać do stada.
ENZOOTYCZNA BRONCHOPNEUMONIA BYDŁA
Choroby układu oddechowego są główną przyczyną strat w chowie młodego bydła.
Odsetek zachorowań od 20 do 80 %: Austria - 42 %, Irlandia - 60 %, Niemcy - 50%.
Polska (Kondracki, Cąkała) ponad 90%: przy czym procent padłych w stosunku do ich ogólnej liczby 5,3; a wybrakowanych 4,5.
Z dalszej hodowli „wypada” około 10% cieląt
Ze względu na etiopatogenezę zakaźne choroby układu oddechowego bydła dzielimy najczęściej na dwie kategorie:
I - choroby wywoływane przez pojedynczy (często specyficzny) patogen, odgrywający zasadniczą rolę w procesie zakażenia.
II - Zespół oddechowy (Bovine Respiratory Diseases Complex - BRDC) o etiologii wieloczynnikowej
Ad I - Najczęściej wymienia się: pneumokokozę cieląt,
Posocznicę krwotoczną
Zarazę płucną
Zakaźne zapalenie nosa i tchawicy
Syndrom VD-MD z przewagą objawów ze strony układu oddechowego
Epizootiologia tych chorób nie jest w pełni przewidywalna, ponieważ obok typowego patogenu, w znacznym stopniu zależy od osobniczej wrażliwości zwierzęcia.
Oba zespoły czynników niezbędne do wystąpienia pełnego obrazu choroby.
Ad II - Bovine Respiratory Diseases Complex (BRDC)
W etiopatogenezie wymienia się przede wszystkim:
Właściwości osobnicze (poziom odporności, typ oddychania, podatność na stres, kondycja)
Warunki środowiskowe (nieprawidłowe żywienie i utrzymanie zwierząt)
Czynniki zakaźne, zarówno pierwotne jak i wtórne
Epizootiologia schorzenia przewidywalna, rozwijająca się w ściśle określonym czasie i w ramach określonego schematu klinicznego.
Syndrom pojawia się zwykle w następstwie przedłużającej się reakcji stresowej powstającej w organizmie w odpowiedzi na kontakt z nieodpowiednimi warunkami środowiska, które następnie umożliwiają skuteczne działanie immunosupresyjne pierwotnych czynników zakaźnych (wirusów i mykoplazm)
Choroba ta u cieląt, jako
tzw. enzootyczna bronchopneumonia (EBC), przebiega początkowo:
z objawami zapalenia oskrzeli (bronchitis) o różnych stopniu nasilenia, przechodząc w
Ogólne zapalenie płuc
Schorzenie to nazywane też jest:
Enzootycznym odoskrzelowym zapaleniem płuc cieląt,
Bronchopneumonia enzootica vitulorum
Spotykana jest najczęściej w fermach bydła o zamkniętym systemie hodowli, w którym zachodzi daleko posunięta specjalizacja i intensyfikacja produkcji.
W wielu krajach (w tym w Polsce) tendencja wzrostowa zachorowań przede wszystkim z powodu intensyfikacji produkcji i niezadowalających efektów działań prewencyjnych
Niezakaźne czynniki środowiskowe (czynniki ryzyka):
Transport
Błędy żywieniowe
Zmiana środowiska i pielęgnacji
Zabiegi weterynaryjne
Nieprawidłowy mikroklimat pomieszczeń
Konstytutywne (endogenne) czynniki usposabiające:
Niedobory naturalnej odporności przeciwzakaźnej
Dysfunkcje hormonalne
Odmienna w porównaniu z innymi gatunkami zwierząt budowa anatomiczna i fizjologia układu oddechowego
Bydło, poniżej 1 roku życia:
Znacznego stopnia strukturalno-funkcjonalny niedorozwój układu oddechowego
Głównie w zakresie efektywnej wymiany gazowej
W budowie i sprawności systemu oczyszczania śluzowo-rzęskowego.
Bydło, w przeciwieństwie do innych zwierząt domowych, ma o połowę mniejszą powierzchnię wymiany gazowej płuc oraz większą podstawową aktywność wentylacyjną, co przy wzroście zapotrzebowania metabolicznego, jest przyczyną niskiej podaży tlenu.
W efekcie niskiego ciśnienia parcjalnego tlenu lub hipoksji, następuje znaczne osłabienie ruchu migawkowego rzęsek, aktywności fagocytarnej makrofagów płuc oraz obniżenie klirensu.
Patogeneza:
Przy upośledzonym oczyszczaniu i obniżonej lokalnej odpowiedzi immunologicznej w obrębie płuc, różnorodne czynniki zakaźne (wirusy, mikoplazmy, bakterie) mają ułatwiony dostęp do dolnych odcinków drów oddechowych, zapoczątkowując proces chorobowy.
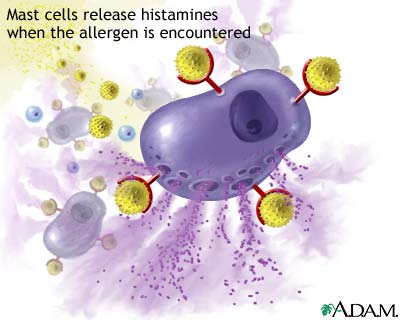
Czynniki zakaźne są liczne i często uzależnione od siebie.
Wirusy i mykoplazmy działają immunosupresyjnie (ale mykoplazmy ułatwiają również superinfekcję poprzez uszkadzanie komórek wydalania rzęskowo-śluzowego, zmniejszają reakcje limfocytów na czynniki mitotyczne oraz upośledzają działalność neutrofilów). Również niektóre bakterie, np. Mannheimia haemolytica serotyp A1 produkuje cytotoksynę niszczącą limfocyty, neutrofile i makrofagi.
Bakterie i ich toksyny uszkadzają tkanki, prowadząc do rozwoju zmian chorobowych i pojawienia się zmian klinicznych
Najczęściej spotykane czynniki zakaźne EBC:
Wirus parainfluenzy typ 3 (PI-3)
Wirus syncytialny (BRSV)
Wirus biegunki i choroby błon śluzowych (BVDV)
Adeno (Adenowirus 3)-, reo-, entero- raz herpeswirusy
Mykoplazmy: M.dispar, M.bovis, M.bovirhinis oraz M.diversum)
Bakterie: Mannheimia (Pasteurella) haemolytica (serotyp A1, Pasteurella multocida (A3), Histophilus (Haemophilus) somnus, Klesiella pneumoniae, Streptococcus sp., Micrococcus sp. Oraz Actinomyces pyogenes.
W postaci chronicznej często dołączają chlamydie: Chlamydophila psittaci oraz beztlenowce z rodzaju Clostridium
Symptomatologia:
W większości przypadków, pomimo różnych czynników wywołujących, przebieg podobny:
Objawy zapalenia oskrzeli i oskrzelików
Zmiany okołooskrzelowe
Początkowo u chorych sztuk wzmożona produkcji śluzu i jego zaleganie w drogach oskrzelowych.
Śluz ten utrudnia ruch rzęsek nabłonka migawkowego pogłębiając powstałą wskutek pierwotnej infekcji wirusowej niedomogę układu śluzowo-rzęskowego.
Przeciągająca się dysfunkcja mechanizmów obronnych oczyszczania śluzowo-rzęskowego sprzyja infekcjom bakteryjnym coraz niżej położonym fragmentom płuc.
Pojawia się wysięk śluzowo-surowiczy z dużą ilością makrofagów i granulocytów obojetnochłonnych.
Po pewnym czasie wysięk śluzowo-ropny, a nawet ropny (np. Corynobacterium pyogenes) - obfity, bardzo gęsty i lepki, pokrywający tchawice i oskrzela.
Wysięk ten może zatykać małe oskrzeliki prowadząc do niedodmy odnośnych części miąższu oraz do koagulacyjnej martwicy z ubytkami tkanki płucnej.
Ponadto liczne złogi włóknika i obrzęki w tkance międzypłacikowej (serotyp A1 Mannheimia haemolytica)
Obecnie wiadomo, że w ostrych i przewlekłych chorobach układu oddechowego do uszkodzenia tkanek dochodzi nie tylko przez czynnik zewnętrzny, ale również poprzez niekontrolowaną odpowiedź gospodarza.
Głównymi czynnikami efektorowymi są toksyczne produkty tlenu i enzymy proteolityczne, ale także
Specyficzne prozapalne mediatory (eikozanoidy) powstające w procesie przemian fosfolipidów błonowych.
AP:
Płuca − niedodma, rozedma, ogniska zwątrobienia, zmiany zapalne
Włóknikowe (krupowe) zapalenie płuc lub nieżytowo−ropne zapalenie płuc (np. C. pyogenes) zależnie od etiologii
Włóknikowe zapalenie opłucnej
Powiększenie przynależnych węzłów chłonnych
Diagnostyka różnicowa:
Rhinitis, bronchitis - monoinfekcje
Podrażnienie gazami
Zagrzybiałe siano
IBR/IPV, MD/BVD
Bad. laboratoryjne:
Izolacja wirusa − SN
Badania serologiczne: ELISA, ID
Materiał: wirusologia − wymazy z nosa, tchawicy lub płuc; bakteriologia − ze zmian w płucach
Profilaktyka:
W zalecanych obecnie kompleksowych programach zmierzających do ograniczania zachorowań i skutków syndromu oddechowego u cieląt najważniejsze są:
Selekcja zwierząt pod katem zwiększonych wymagań związanych z intensyfikacja hodowli
Profilaktyka swoista W OPARCIU O SZCZEPIENIA OCHRONNE prowadzone przed przemieszczaniem zwierząt, ich transportem i zasiedleniem fermy.
Doskonalenie metod leczenia EBC
Strategie leczenia klinicznych przypadków EBC powinna zawierać trzy podstawowe grupy działań:
Eliminację czynników zakaźnych
Korektę zaburzeń sekrecyjno- motorycznych płuc
Modulację procesu zapalnego przebiegającego w układzie oddechowym
Eliminacja czynników zakaźnych:
Istota jest nadal, w miarę możliwości, jako metafilaksja, stosowanie antybiotyków, których rodzaj uległ pewnym zmianom na przestrzeni ostatnich lat.
Ogólne zasady ich stosowania, zwłaszcza w formie metafilaksji są w zasadzie podobne.
Skuteczne postępowanie terapeutyczne zależy od:
Szybkości podania odpowiednio dobranego antybiotyku
Zastosowania go w całym stadzie, jeśli odsetek zachorowań wynosi więcej niż 5-10% zwierząt
Wielkości jego dawki
Częstości stosowania
Przy braku poprawy po 48-72 godzinach wskazana jest modyfikacja leczenia, przy zadawalających efektach, leczenie winno być kontynuowane jeszcze przez 48 godzin po spadku podwyższonej ciepłoty ciała, po poprawie stanu ogólnego i ustąpieniu duszności.
U zwierząt ciężko chorych antybiotykoterapia powinna być kontynuowana zwykle jeszcze przez 5 do 7 dni.
Nawroty choroby wymagają możliwie wczesnej i intensywnej terapii powtórnej.
Aktualnym trendem w leczeniu EBC jest jednak stosowanie antybiotyków długo działających poprzez jedno- lub wyjątkowo dwukrotne parenteralne ich podanie.
Najczęściej stosowana oksytetracyklina o przedłużonym działaniu (L.A.)
tylmikozyna (Micotil - Elanco), florfenikol (Nuflor - Schering, Floron - KRKA)
Tulatromycyna (Draxxin - Pfizer) - półsyntetyczny makrolid z grupy triamilidów
Jeżeli praktyczne możliwości szybkiej oceny antybiotykooporności są ograniczone należy wziąć pod uwagą rodzaj bakterii najczęściej wikłających chorobę.
Na szczególną uwagę zasługują Mannheimia haemolytica i Pasteurella multocida. Są one zwykle wrażliwe na sulfonamidy, penicyline G, ampicyline, amoksycyline, tetracyklinę, chloramfenikol, florfenikol, streptomycynę, flumechinę, neomycynę, kanamycynę, gentamycynę, cefalosporyny, tylozynę oraz modne ostatnio fluorochinolony, czyli inhibitory bakteryjnego enzymu gyrazy DNA (enrofloksacynę, marbofloksacynę, norfloksacynę, danofloksacynę i ciprofloksacynę)
Mykoplazmy wrażliwe są na antybiotyki z grupy tylozyny i fluorochinolony
Korekcja zaburzeń sekrecyjno-motorycznych:
Nieodpowiedni w przebiegu EBC
Stan funkcjonalny mięśni gładkich płuc
Obniżenie przepuszczalności naczyń włosowatych pęcherzyków płucnych (istotnie obniżających efektywną perfuzje gazów)
Zahamowanie oczyszczania śluzowo-rzęskowego („clearance”)
Prowadzi do groźnego upośledzenia wymiany gazowej w płucach.
Korekcja tych zaburzeń polega przede wszystkim na podawaniu:
Leków rozszerzających oskrzela - bronchodilatorów (teofilina)
Preparatów wykrztuśnych -expectorantia o właściwościach sekretolitycznomotorycznych (bromheksyna)
W przypadku powikłań w postaci obrzęku płuc również diuretyki (furosemid) i vasodilatory (nitroprusydek sodowy)
Generalnie leki te ułatwiają pracę przeponowych mięśni oddechowych i poprawiają wymianę gazową. Z tym, że leki wykrztuśne działają na drodze aktywizacji procesów zwiększających usuwanie nadmiaru śluzu z wydzieliną zapalną. Polega to na działaniu sekretolitycznym (mukolitycznym) przez pobudzenie wydzielania gruczołów śluzowych albo depolimeryzację kwasu sjalomukopolisacharydowego warunkującego lepkość śluzu. Wodnista wydzielina łatwiej jest usuwana. Rzęski nabłonka migawkowego gromadzą śluz w receptorach kaszlowych, skąd droga odruchu kaszlowego może zostać usunięty.
Usunięcie śluzu oskrzelowego ma podstawowe znaczenie dla ochrony przed rozwojem choroby i infekcyjnymi powikłaniami. W gęstym, długo zalegającym śluzie, dużo, znajdujących dobre warunki rozwoju, patogenów.
Modulacja odczynów zapalnych płuc:
Słabo lub średnio nasilony odczyn zapalny w płucach, tzw. Hipoergiczny (zwykle pierwsza histaminowa faza zapalenia), odgrywa korzystna role w likwidowaniu i unieczynnianiu ewentualnych patogenów i ich toksyn.
W tym stanie klinicznym dopuszcza się stosowanie, obok antybiotykoterapii, również umiarkowaną immunoterapię (leki bodźćowe), w tym także modną ostatnio tzw. Paraimmunizację (induktory interferonu).
Gdy reakcja zapalna jest zbyt intesywna (hiperergiczna) lub ostry stan zapalny przedłuża się (druga, prostaglandynowa faza zapalenia), pewne mediatory (pochodne kwasu arachidonowego, autakoidy peptydowe, prozapalne cytokiny, neuropeptydy i produkty cytolizy tkanek) uwalniane w miejscu zapalenia wywierają niekorzystny wpływ na funkcjonowanie płuc (uszkodzenia i różnego rodzaju dysfunkcje).
W tym stadium choroby podanie leku przeciwzakaźnego powinno być skojarzone z odpowiednią terapią przeciwzapalną wykorzystującą specyficzne modulatory odczynu zapalnego płuc, a wykluczające zastosowanie silnie działających preparatów immunostymulujących.
Zasadniczym celem modulacji odczynu zapalnego płuc, poprzez zastosowanie odpowiednich leków, jest zmniejszenie lub całkowite wyeliminowanie nieodwracalnych zmian w układzie oddechowym, których powstawanie wiąże się z uwalnianiem prozapalnych mediatorów kaskady kwasu arachidonowego tzw. eikozanoidów.
Doraźny efekt stosowania odpowiednich modulatorów - szybka poprawa stanu klinicznego (spadek gorączki, poprawa łaknienia, zmniejszenie produkcji śluzu, zniesienie nadreaktywności oskrzelowej.
Wśród najczęściej stosowanych obecnie modulatorów tego typu w uzupełniającej terapii EBC znajdują się:
Glikokortykosteroidy (GK, SAIDs) -niewskazane
Niesteroidowe leki przeciwzapalne (NSAIDs) - coraz częściej
NSAIDs zarejestrowane w Polsce:
Megluminian fluniksyny (Finadyne - Schering) - 2,2 mg/kg, i.v., trzykrotnie, co 24 godziny
Meloksikan (Metacam - Boehringer Ingelheim) - 0,5 mg/kg, i.v. 1 x dziennie przez 3 dni
Można również, (ale z mniejszym efektem):
Kwas acetylosalicylowy (Aspiryna w dawce 100 mg/kg p.o. co 12 godzin)
Fenylobutazon (6 mg/kg p.o., 1 x dziennie)
Ketoprofen (3 mg/kg i.m., 3 x co 24 h)
Karprofen
Kwas meklofenamowy
Kwas tolfenamowy
Ibuprofen
Poszukiwania bardziej specyficznych blokerów dla poszczególnych rodzajów prozapalnych mediatorów:
Poszukiwanie specyficznych antagonistów dla autakoidów (cikapost - syntetyczny analog prostacykliny, zileuton i zefirluksat - antagoniści leukotrienów cysteinowych)
Modulacja neurogennych mechanizmów zapalenia i aktywności prozapalnych cytokin głównie IL-1 i TNF
Ograniczanie wpływu produktow zapalenia o własciwościach cytolitycznych poprzez antyproteazy i tzw. Wymiatacze wolnych rodników (Se, Zn, Ca oraz witaminy: E, A i C)
Manipulacje dietetyczne poprzez stosowanie dodatku kwasu α-linolowego, skutecznie zastepujacego kwas arachidonowy, który jak wiadomo jest substratem enzymatycznej kaskady zapalnej.
GRUŹLICA BYDŁA
Zakaźna, zaraźliwa, przewlekła choroba,
Ziarniniaki (gruzełki gruźlicze) w narządach
Etiologia
Mycobacterium bovis - prątek bydlęcy (duże spektrum zakaźne),
M. tuberculosis - p. ludzki,
M. avium - p. ptasi,
Prątki kwasooporne (subst. woskowe i tłuszczowe a barwniki anilinowe),
Duża oporność na czynniki środowiska,
Epidemiologia
Kontakt bezpośredni,
Kontakt pośredni z zanieczyszczonymi przedmiotami,
90% krów - droga aerogenna (kropelkowa lub wdychanie kurzu z prątkami),
Cielęta - droga alimentarna z mlekiem lub w życiu płodowym (gruźlica macicy),
Obecnie gruźlica występuje rzadko,
Polska wolna od gruźlicy (tuberkulinizacja, eliminacja zwierząt zakażonych)
Patogeneza
Wniknięcie prątków
↓
Fagocytoza przez makrofag
Unieszkodliwienie namnażanie,
Niszczenie fagocytów
i rozwój zakażenia
Gromadzenie ziarniny gruźliczej w formie gruzełków - serowacenie, zwapnienie, procesy wysiękowe i wytwórcze
Ognisko pierwotne - zapalenie w miejscu wniknięcia,
Bydło - PŁUCA 90%, przew. pok,
Cielęta - wątroba, płuca, przew. pok.,
Konie, świnie- przew. pok.,
Psy, koty - płuca, przew. pok.,
Zespół pierwotny - ognisko pierwotne + zmiany w przynależnych węzłach chłonnych
Zespół pierwotny niezupełny - przeważa reakcja ze strony węzłów, a ognisko pierwotne ulega wygojeniu,
Uogólnienie wczesne - niska odporność, szerzenie zakażenia drogą naczyń limfatycznych i krwionośnych
Ostra gruźlica prosówkowa (śmierć lub spowolnienie procesu - żywe prątki)
Nadkażenie - gruźlica okresu popierwotnego (przez ciągłość i styczność tkanek)
Uogólnienie późne (słaba odporność, krew i limfa)
Przewlekła gruźlica narządowa
Objawy:
Zależą od umiejscowienia,
Często brak objawów,
W trakcie uogólnienia gorączka ciągła,
Przebieg przewlekły - gorączka na przemian z okresami bezgorączkowymi (gorączka często wieczorami)
Gruźlica płuc - kaszel (przy zmianach temp., po wypiciu zimnej wody), duszność, wypływ, szmery oddechowe, rzężenia
Perlica - gruźlica błon surowiczych - opłucna (tarcia)
Przew. pok - morzyska, biegunki, zaparcia,
Ukł. rozrodczy - ronienia, jałowość, częste ruje, gruźlica najądrza - guz,
Nerki - mocz mętny, białkomocz,
Gruźlica worka osierdziowego,
Grużlica gruczołu mlekowego,
Grużlica CUN
Sekcja:
Guzy gruźlicze w różnych narządach,
Gruźlica prosówkowa - liczne gruzełki,
Gruźlica błon surowiczych:
- perlica,
- gruźlica naciekowa,
- gruźlica naciekowa rozlana,
Rozpoznawanie:
TUBERKULINIZACJA!!!
Śródskórne podanie - wynik po 72-77 h,
TUBERKULINIZACJA PORÓWNAWCZA
Podanie w 2 miejsca szyi tuberkuliny z prątków bydlęcych i ptasich
Wycięcie krzyżyka nożyczkami
Zmierzenie fałdu
Podanie tuberkuliny
Odczyt po 72h
„-” zgrubienie fałdu < 2 mm,
„+ -” 2-4 mm,
„+” > 4 mm lub rozlany obrzęk, wysięk,
PORÓWNAWCZA
„+” bydlęcy > 4 mm niż ptasia,
„+ -” bydlęcy „+” i 1-4 mm różnicy,
„-” bydlęcy „-” lub równy/mniejszy od ptasiej
Postępowanie
Zwalczana z urzędu,
Brak leczenia,
Zwierzęta chore lub „dodatnie” są eliminowane,
Monitoring gruźlicy - 1/3 stad bydła tak, aby w ciągu 3 lat poddać badaniu wszystkie sztuki powyżej 6 TYGODNIA!!!
99,9% stad musi być wolnych od gruźlicy, aby uznać za urzędowo wolne
Akty prawne
Rozporzadzenie Ministra Rolnictwa i Rozwoju Wsi z dnia 27 czerwca 2005r. w sprawie szczegółowych wymagań weterynaryjnych niezbędnych do uzyskania i zachowania uznania stada lub gospodarstwa za urzędowo wolne lub wolne od chorób zakaźnych zwierząt (Dz. U. Nr 126 poz. 1058),
Rozporządzenie MriRW z dnia 23 listopada 2004r. w sprawie zwalczania gruźlicy bydła (Dz. U. Nr 258 poz. 2585),
Rozporządzenie MriRW z dnia 17 grudnia 2004r. w sprawie określenia jednostek chorobowych, sposobu prowadzenia kontroli oraz zakresu badań kontrolnych zakażeń zwierząt (Dz. U. Nr 282 poz. 2813)
PARATUBERKULOZA
Chroniczne, przerostowe zapalenie jelit
Choroba Johnego
Mycobacterium paratuberculosis, G+, kwasooporny,
Przewlekłe, wyniszczające, rozrostowe zapalenie jelit
Przeżuwaczy domowych i dzikich, sporadycznie innych
Znaczenie niedoceniane
Bardzo częste zakażenia subkliniczne (20x więcej niż chorych)
A choroba raczej tylko w warunkach udomowienia (czy niewoli)
Zwłaszcza w stresie (poród, stłoczenie, transport, złe żywienie)
Podlega w Polsce rejestracji
Etiologia
Mycobacterium avium spp. Paratuberculosis
Kwasooporny prątek, bezwzględny tlenowiec, rośnie wolno
Ma szczególne zapotrzebowanie na żelazo (też in vitro)
Wyciąg z jego hodowli = jonina
Wyzwala w zakażonym organizmie nadwrażliwość późną
Chroniony przed słońcem i wysychaniem w glebie czy materiale organicznym przeżywa do roku
Epidemiologia
Choroba występuje na całym świecie, z różnym nasileniem
W USA 1.4 - 18% bydła (regionalnie do 30%) u ponad 20% stad
W Wielkiej Brytanii ponad 17% farm
W Polsce u bydła, owiec, kóz (2% kóz hodowlanych w 16% stad)
Rezerwuar: przeżuwacze domowe oraz dzikie (też zdrowe!)
Wydalają zarazek z kałem (ew. też siarą, mlekiem, nasieniem)
Chore wydalają dużo więcej zarazka niż nosiciele
Inne zakażają się alimentarne (ew. śródmacicznie)
Najłatwiej ulegają zakażeniu zwierzęta młode (dorosłe bardzo oporne)
Zakażenie per os, kał, pasza, pastwisko, zanieczyszczone przedmioty,
Patogeneza
Zarazek wnika przez komórki M do m-f błony podśluzowej jelita biodrowego i ślepego, do ich grudek chłonnych oraz węzłów (dostępność żelaza)
Potem długa faza bezobjawowa (inkubacja 12 m-cy lub więcej)
Działanie makrofagów: IL-12, potem naciek limfocytów CD4, ich cytokiny przyciągają kolejne makrofagi
Bakteriemia jest przynajmniej krótkotrwała, mogą też wystąpić zmiany w wymieniu, płodach, w układzie rozrodczym rozrodczym u buhajów
W 3-5%: zaburzenia wchłaniania, enteropatia białkogubna, trudności z zacieleniem, zmniejszona mleczność, mastity
Przebieg u bydła
Dorosłe, często po jakimś stresorze (wycielenie!)
Okresowe biegunki, potem coraz częstsze, z pęcherzykami gazu
Mimo apetytu postępujące wychudzenie, spadek mleczności
Temperatura normalna, węzły chłonne powiększone
Wybrakowanie (śmierć)
Przebieg u owiec i kóz
Rzadko biegunka
Tylko wyniszczenie i straty produkcyjne
Objawy:
utrata kondycji, wychudzenie,
biegunka przerywana do ciągłej,
przerostowe zapalenie błony śluzowej jelit cienkich - przypomina „fałdy mózgu”
Rozpoznanie - tylko badanie laboratoryjne!!!
Wywiad i badanie kliniczne
Sekcja (rozrostowe zapalenie jelit, węzły chłonne)
Potwierdzenie nie jest proste (czułość i swoistość metod słaba)
Test śródskórny z joniną: dla 75% fałszywie (+) wyników
Jonina i.v.: wykryje 80% chorych (gorączka), ale nie nosicieli
Można diagnozować serologicznie (immunodyfuzja, ELISA)
ELISA wykryje zanim można wyizolować zarazek z kału
Ale też bywają fałszywie (+), więc trzeba potwierdzać:
Bakterioskopowe: zeskrobany z prostnicy (lub pośmiertnie)
Izolacja zarazka z kału lub węzłów: bardzo dobre, ale 8 tygodni
Szybciej PCR-em zarazek w kale można wykryć
Postepowanie - ELIMINACJA!!!
Profilaktyka
Higiena (obrotu, wodopojów, pastwisk itp.)
W niektórych krajach stosuje się szczepionki ( z żywym lub zabitym zarazkiem), ale skuteczność niepewna - utrudniają diagnostykę tej choroby i gruźlicy
Zoonoza
Zagrożenie dla ludzi (zarazek w mleku)
Choroba Crohna: przewlekle ziarniniakowe zapalenie jelit
Podobna do paratuberkulozy
O nieznanej etiologii
U niektórych pacjentów można wykazać Mycobacterium avium ssp. paratuberculosis lub swoiste przeciwciała
BRUCELOZA BYDŁA
ETIOLOGIA
Brucella abortus, rzadziej B. melitensis, wyjątkowo B. suis
Mała pałeczka lub kokopałeczka G-
Bytuje wewnątrzkomórkowo w tkankach gospodarza
Trudna do hodowli - rośnie powoli i wymaga CO2 (rośnie do 6 tyg.)
Przeżywa:
8 m-cy w poronionym płodzie
3-4 m-ce w kale, moczu, gnojowicy
2-3 m-ce w mokrej glebie
Ginie w temp. 60°C po 30 min., 85°C po 5min., 100°C natychmiast
Dobre właściwości dezynfekcyjne - lizol, alkohol etylowy, a. propylowy, kwas karbolowy
EPIZOOTIOLOGIA
Występuje na całym świecie
Skuteczny program zwalczania w wielu krajach (w Polsce w latach 70 w ciągu 10 lat)
Zakażenie przenoszone przez zakażone zwierzęta (w czasie poronienia, okresowo w mleku przez cały okres laktacji, mocz, kał)
PATOGENEZA
Źródło zakażenia:
Spożycie zanieczyszczonej karmy lub wody,
Lizanie zakażonego łożyska, poronionego płodu,
Buhaje z nasieniem,
Uszkodzona skóra wymienia i kończyn
Po zakażeniu - zapalenie łożyska
Poronienie w 5-9 m-cu ciąży ,
Wydalanie bakterii z łożyskiem, wodami płodowymi, wypływem z dróg rodnych
OBJAWY KLINICZNE
Okres inkubacji 14-180 dni (do 250dni)
Krótkotrwały wzrost ciepłoty niezauważalny w stadzie
PORONIENIA!!! między 5-9 mies. ciąży najczęściej (może być w każdym okresie)
Urodzone prawidłowo cielęta padają wkrótce po porodzie
Buhaje - jednostronne lub obustronne zap. jąder, najądrzy i pęcherzyków nasiennych (ogniska martwicowe i ropnie wielkości orzecha laskowego - przewlekły przerost tk. łącznej - obrzęk jąder i najądrzy, powiększenie ob. moszny)
Zap. stawów nadgarstkowego i skokowego, kaletek maziowych
RONIENIA
Zaczynają się często od objawów zwiastunowych porodu
Towarzyszy temu zapalenie dr. Rodnych
przekrwienie bł. śluzowej pochwy z czerwonawymi grudkami wielkości ziarna prosa,
Wypływ śluzowy lub śluzowo-ropny, bezwonny, szarobiały lub czerwonoszary
Kolejne ciąże prawidłowe lub poronienia
W stadzie po fali poronień okresy spokoju, tylko pojedyńcze poronienia, potem znowu się nasilają
Skutek:
Niepłodność,
Powtarzanie rui,
Zatrzymanie łożyska,
Zapalenie macicy
ZMIANY ANATOMOPATOLOGICZNE
Zapalenie macicy:
Kotydelony pokryte lepkim, bezwonnym wysiękiem, żółtoszarym na skutek martwicy,
Tkanki między kotydelonami obrzękłe
Poronione płody
Obrzęk tk. podskórnej, krwisty płyn przesiękowy w jamie klatki piersiowej i otrzewnej,
Wątroba powiększona, pomar.-brąz.,
Powiększenie ww. chłonnych
Jądra: ogniska martwicy i ropnie wielkości orzecha laskowego, przerost tk. łącznej
ROZPOZNANIE:
Wywiad epizootyczny
Obj. kliniczne
Zmiany sekcyjne (mało charakter.)
Musi być potwierdzone:
Bad. bekteriologicznym (materiał: poroniony płód, łożysko, wypływ, nasienie, ropa)
Bad. serologicznym (OKAP, OWD, ELISA)
PCR
POSTĘPOWANIE
Choroba zwalczana z urzędu i podlegająca obowiązkowi zgłaszania (lista OIE)
Programy Inspekcji Weterynaryjnej
Badanie i eliminacja osobników z dodatnimi testami serologicznymi,
Świadectwa zdrowia zwierząt, miejsca pochodzenia i ich oznakowanie
Kraj wolny:
99,8% ferm wolnych od brucelozy (negatywne wyniki bad. serologicznych, brak poronień przez ostatnie 3 lata)
coroczne serologiczne badanie 1/3 populacji z wynikiem nie więcej niż 0,5% wyników dodatnich serolog.
Stado wolne od brucelozy:
nie ma zwierząt szczepionych p-ko brucelozie,
brak obj. klin. przez co najmniej ostatnich 6 m-cy,
dwukrotne bad. serolog. wszystkich zwierząt powyżej 12 mies. życia z wynikiem negatywnym,
nie wprowadzanie zwierząt bez ważnych świadectw zdrowia.
Stado podejrzane o zakażenie
Objawy charakt. dla brucelozy
Bad. laboratoryjne potwierdza brucelozę, chorego osobnika usunięto ze stada, ale nie ukończono bad. labor. pozostałych zwierząt,
Stado z osobników ze stad nie uznanych za wolne od brucelozy,
Bydło z importu jeszcze nie przebadane
SEROLOGICZNE MONITOROWANIE BYDŁA
30% pogłowia w wieku POWYŻEJ 12 M-CY!!!
Wynik Serologiczny dodatni:
Eliminacja chorego osobnika i badania laboratoryjne,
Bad. serolog. pozostałych zwierząt oraz mleka testem ELISA 2x co 8 tyg
Zakaz sprzedaży zwierząt do hodowli,
Oczyszczenie i odkażenie stanowiska,
Nie dopuszczać do wspólnych pastwisk i wodopojów,
Mleko do spożycia tylko po przegotowaniu
ZAGROŻENIE DLA CZŁOWIEKA
Źródło: wydaliny i wydzieliny, mleko (pasteryzacja), poroniony płód
B. abortus, melitensis, suis, canis
Falująca gorączka - ostry i długi przebieg (objawy ogólne) lub przewlekły (ropnie)
Rolnicy, obsługa, lek. wet. (podczas porodów, ronień, odklejania łożyska, płukania dr. rodnych
Kontakt bezpośr., dr. pok., dr. inhal.
Leczenie - tetracykliny (dobre rezultaty)
UWAGA!!!
Należy zachować daleko idącą ostrożność używając rękawic podczas badania poronionego płodu oraz matki.
KAMPYLOBAKTERIOZA
CHOROBA MĘTWIKOWA BYDŁA
ETIOLOGIA
Campylobacter fetus subsp. Veneralis
Spiralnie zgięte bakterie, G-, wykazują postępowo-zwrotny ruch dzięki długiej, pojedyńczej rzęsce
Ma 3 ciepłostałe antygeny somatyczne O, 7 ciepłochwiejnych antyg. otoczkowych K, 1 antyg. rzęskowy H
Wytwarzają ENDOTOKSYNĘ (podana i.v. powoduje poronienie u krowy)
Wrażliwy na promieniowanie słoneczne i środki dezynfekcyjne
EPIZOOTIOLOGIA
W wielu krajach główny czynnik etiologiczny zaburzeń rozrodu bydła
Wprowadzenie inseminacji, szczepień zapobiegawczych oraz programów zwalczania ograniczyło rozprzestrzenieni
Lokalizacja bakterii - ukł. rozrodczy:
Krowy i jałówki: bł. śluz. pochwy, szyjki, macicy i jajowodów,
Buhaje: bł. śluz. żołędzi prącia, napletka, końcowy odcinek cewki moczowej
OBJAWY KLINICZNE
KROWY:
śluzowo-ropne zapalenie macicy
Wczesne zamieranie i resorbcja płodów
Nieregularne ruje, poronienia
BUHAJE:
Bezobjawowo
Kampylobakterioza
Brak zmian anatomopatologicznych
Brak zmian histologicznych
U buhajów brak zmian w nasieniu
ROZPOZNAWANIE
Materiał:
- krowy: śluz pochwowy,
bioptat z szyjki macicy,
poroniony płód
- buhaje: wypłuczyny napletka,
nasienie
Badania laboratoryjne
- bakteriologiczne (war. mikroaerofilne)
- serologiczne (odczyn immunofluores.)
- PCR
POSTĘPOWANIE
Choroba na liście OIE
Izolacja stad zdrowych od zakażonych
Wprowadzenie inseminacji, eliminacja krycia
Produkcja nasienia od buhajów wolnych od zakażenia
Immunoprofilaktyka swoista (szczepienie buhajów zapobiega ich zakażeniu)
Tylko buhaje wolne od zakażenia mogą być wprowadzone do stacji unasieniania + okresowe badanie pogłowia danej stacji
LECZENIE I ZAPOBIEGANIE
Antybiotyki, najczęściej STREPTOMYCYNA miejscowo i ogólnie (zakażone krowy, wlewy donapletkowe, dodatek do nasienia)
Dobre rezultaty: antybiotyk + szczepienie
W celu eliminacji Campylobacter dodaje się różne kombinacje antybiotyków do nasienia płynnego i mrożonego (dodatek penicyliny, streptomycyny, linkomycyny, spektynomycyny, redukowała liczbę bakterii poniżej progu wykrywalności w nasieniu)
CHLAMYDIOZA
ETIOLOGIA
Chlamydia i Chlamydophila z rodziny Chlamydiaceae
U bydła Chlamydophila abortus
U cieląt Ch. Decorum
Niespotykany u innych drobnoustrojów cykl rozwojowy - 2 postacie morfologiczne:
Zakaźne ciałko elementarne EB - postać pozakomórkowa
Niezakaźne ciałko retikularne RB - postać wewnątrzkomórkowa
Cykl rozwojowy:
Ciałka elementarne wiążą swoiste receptory komórki gospodarza i na drodze endocytozy wnikają do atakowanej kom.
Mają zdolność zakażania, wzrostu w makrofagach i po 72h uszkadzania kom. gospodarza, z których się uwalniają
EPIZOOTIOLOGIA
Występuje u zwierząt udomowionych i dzikich, ptactwa i człowieka na wszystkich kontynentach
Źródło:
Zwierzęta chore i bezobjawowi nosiciele
Drogi zakażenia:
Dr. alimentarna i aerogenna
Kontakt z wydzieliną z worka spojówkowego
Dr. rodne, kał
PATOGENEZA
w/w drogi zakażenia
namnażanie w makrofagach
nn. chłonne i krew (chlamydiemia)
narządy płciowe i łożysko
stan zapalny poronienie
przedwczesne porody
słabe cielęta
OBJAWY KLINICZNE
Początkowo przebieg bezobjawowy - nasilenie przy spadku odporności
Cielęta:
Zap. płuc, stawów,
Zap. rogówki i spojówek
Sporadycznie zap. mózgu i rdzenia kręgowego
Krowy:
Zap. dr. rodnych,
RONIENIA!!! w 8-9 m-cu ciąży bez wcześniejszych objawów (czasem rzadki, żółtawy wypływ z pochwy z domieszką skrzepłej krwi) - krowy ronią zwykle raz
Buhaje:
Zap. jąder, najądrzy, pęch. Nasiennych
Pogorszenie jakości nasienia (morfologia i ruchliwość) oraz zdol. zapładniającej o 80%
Zmiany anatomopatologiczne
Łożysko:
Zmiany martwicze kotydelonów, między nimi galaretowate nacieki, brunatnoróżowe (wczesne ronienia)
W późnych zmiany mniej rozległe dot. obwodowych części i ślepego zakończenia łożyska
Poronione płody:
Normalnie rozwinięte, ogólny stan krwotoczny,
Guzowate powiększenie wątroby
Wybroczyny w tk. podskórnej, mięśniach, śluzówce jamy ustnej, oczu, ww. chłonnych,
Buhaje:
Galaretowate nacieczenia barwy bursztynowej worka mosznowego i powrózka nasiennego
Na przekroju jąder serowate ogniska barwy gliniastej od śródjądrza do osłonki jądra
Łącznotkan. przerost tk. gruczołowej oraz torbiele z ropną zawartością
ROZPOZNANIE
Obj. kliniczne i sekcyjne mało przydatne
Badania laboratoryjne:
Próba biologiczna na 6-7 dniowych zarodkach kurzych, myszy, świnek m.
Hodowle komórkowe
Badanie serologiczne (OWD, ELISA)
PCR
Materiał: wypływ z dr. rodnych, fragmenty łożyska, narządy samca, nasienie, krew, narządy miąższowe płodu
POSTĘPOWANIE
Wrażliwe na antybiotyki - tetracykliny, tylozyna, chloramfenikol
Eliminacja zwierząt chorych
Monitoring serologiczny
Tworzenie stad wolnych od choroby
ZAGROŻENIE DLA CZŁOWIEKA- GROŹNA ZOONOZA!
Żródło zakażenia: ptaki - papugi (obserwacja)
Objawy:
Zapalenie spojówek
Zap. Płuc
Zap. przewodu pokarmowego
LEPTOSPIROZA BYDŁA
ETIOLOGIA
Spirochety LEPTOSPIRA (26 serogrup obejmujących 200 serotypów)
Określony serotyp zaadoptowany jest do zwierząt danego gatunku
Bydło:
Leptospira hardjo
L. pomona w Ameryce Płn.
L. grippotyphosa (u zwierząt wolnożyjących)
EPIZOOTIOLOGIA
Źródło:
Zwierzęta chore i bezobjawowi nosiciele poprzez mocz, mleko, nasienie
Drogi zakażenia:
- uszkodzona skóra, błony śluzowe (pochwy i
spojówki)
- droga alimentarna (zanieczyszczona
moczem woda, pasza)
- droga płciowa (nasienie)
PATOGENEZA
Zakażenie
leptospiremia (krew i narz. miąższowe)
eliminacja z krążenia przez przeciwciała
kanaliki kręte nerek i tkanki układu
rozrodczego samic i samców
Uk. rozrodczy i moczowy najczęściej!!!
OBJAWY KLINICZNE
Okres inkubacji 4-10 dni
Brak objawów patognomonicznych
Na terenach enzootycznych - p. utajona
RONIENIA!!! - 3-10 tyg. od zakażenia lub w 3 trymestrze ciąży
Porody przedwczesne
Rodzenie martwych lub słabych cieląt
Spadek wydajności mlecznej, nawet do bezmleczności
Cielęta: temp. 40-41st. C, żółtaczka, anemia hemoglobinuriauria, objawy ogólne
ZMIANY ANATOMOPATOLOGICZNE
Cielęta:
- wybroczyny w błonach śluzowych
- zażółcenie tkanek i narządów
- anemia
- zmiany zwyrodnieniowe nerek - blade lub szare,
powiększone, z wybroczynami
- ogniska martwicze w miąższu wątroby
Poronione płody:
- czerwonawy płyn w jamach ciała
- galaretowate nacieczenia w tk. podskórnej
SEKCJA
ROZPOZNAWANIE
Znajomość sytuacji epizootycznej
Objawy kliniczne i sekcyjne
Badania laboratoryjne ( wykazanie leptospir w tkankach badanych zwierząt lub swoistych p-ciał w surowicy)
Materiał:
- ostry przebieg: wątroba, płuca, mózg, krew, mleko, płyn otrzewnowy)
- przewlekły: nerki, uk. rozrodczy, mocz
ROZPOZNAWANIE C.D.
Serologicznie - immunofluorescencja
Mikroskopowo - płyny ustrojowe w ciemnym polu (leptospiry wykazują ruch, haczykowato zagiete końce)
Hybrydyzacja kwasów nukleinowych z użyciem specyficznych sond - najczulsza, ale droga
Najczęściej stosowany - test aglutynacji mikroskopowej - test referencyjny mimo niskiej czułości i braku odróżnienia p-ciał poszczepiennych od p-ciał po zakażeniu
POSTĘPOWANIE
Lista B OIE
Wprowadzanie do stada zwierząt serologicznie ujemnych
Ochrona stad przed wprowadzeniem zakażonych zwierząt
Nie uodparnianie buhajów w stacjach unasieniania
Obecne testy nie odróżniają zwierząt uodpornionych od zakażonych naturalnie
POSTĘPOWANIE
Niepełna skuteczność antybiotykoterapii
Skuteczniejsze szczepienie + antybiotyki (tetracykliny, streptomycyna) - nie można tego stosować dla buhajów w stacjach unasieniania, bo nie mogą być seropozytywne
Jest potrzeba opracowania czulszych testów serologicznych odróżniających buhaje szczepione od zakażonych naturalnie
ZAGROŻENIE DLA CZŁOWIEKA
L. canicola u psów, L. hardjo u bydła oraz L. icterohaemorrhagiae u szczurów
Zakażenie: kontakt z tkankami padłych zwierząt lub wodami powierzchniowymi zanieczyszczonymi moczem chorych zw.
Drogi: otarcia skóry, rany, błony śluzowe
Przebieg: bezobjawowy do ostrego, nawet śmierć spowodowana niewydolnością nerek
ZAGROŻENIE DLA CZŁOWIEKA
Objawy:
- gorączka, bóle głowy i mięśni, wymioty,
- wysypka, żółtaczka, anemia hemolityczna
- zap. płuc, nerek, opon mózgowych
Rozpoznanie: bad. laboratoryjne
Leczenie: penicylina, streptomycyna
Zazwyczaj pełne wyleczenie (chociaż przy L. icterohaemorhagiae śmiertelność 20%)
ZAGROŻENIE DLA ZDROWIA
Zapobieganie:
- unikać kąpania się lub picia wody z
zanieczyszczonych leptospirami zbiorników,
- na fermach zapowietrzonych noszenie
odzieży ochronnej i przestrzeganie
przepisów sanitarnych,
- można szczepić osoby z grup ryzyka,
- zgłaszanie ognisk klinicznej leptospirozy do
lokalnej stacji sanitarno-epidemiologicznej.
4
Wyszukiwarka
Podobne podstrony:
Biegunki cieląt, zakaźne - przeżuwacze
bydło i małe przeżuwacze
lepto moje, Studia, IV ROK, Bydło, Zakaźne, zakazy bydło, koło 2, EPI koło II
Egzamin z przedmiotu Choroby Zwierzat Gospodarskich, Studia, IV ROK, Bydło, Zakaźne, Egzamin z Zakaz
pytania kolo 1, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos I, PYTANIA
pytania kolo1 zakazne opr, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos I, PYTANIA
DYZENTERIA, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos 3
CH.JOHNNEGO, weterynaria, zakaźne, bydło
ZAKAZ NE ZANIKOWE ZAPALENIE NOSA S WIN , Studia, IV ROK, Bydło, Zakaźne, 3 kolo zakazy
ZARAZA PŁUCNA BYDŁA, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos 2, cw2 odd
GRUŹLICA RZ. OWIEC, weterynaria, zakaźne, bydło
epi-pyt-SW, Studia, IV ROK, Bydło, Zakaźne, 3 kolo zakazy
Choroby byd, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos 2, cw2 odd
Pomór świń klasyczny, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos 3
EBB, weterynaria, zakaźne, bydło
Mykoplazmowe zapalenie płuc s win , Studia, IV ROK, Bydło, Zakaźne, 3 kolo zakazy
BHV-2, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos I, cw4
Zakazy 1 koło pyt i odp, Studia, IV ROK, Bydło, Zakaźne, ZAKAZY, kolos I, zakaz zakazany na 1 kolo n
więcej podobnych podstron