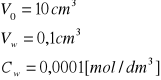1. Metodę polarografii.
Polarografia polega na badaniu zmian natężenia prądu, płynącego przez roztwór z oznaczaną substancją, od liniowo rosnącego potencjału z zastosowaniem kroplowej elektrody rtęciowej (KER) jako elektrody pracującej.
Termin polarografia obejmuje wiele metod elektroanalitycznych opartych na zjawiskach zachodzących w układzie elektrod, z których jedna ulega polaryzacji.
Polarografia należy do tych metod elektrochemicznych, w których bada się natężenie prądu elektrycznego płynącego przez komórkę pomiarową w zależności od przyłożonego do elektrod napięcia. Zależność natężenia od przyłożonego napięcia [I = f (E)] nazywa się krzywą polarograficzną (woltamperometryczną). Termin polarografia należy stosować w przypadku, gdy elektrodą pracującą jest elektroda ciekła (Hg) z powierzchnią odnawiającą się w sposób ciągły lub okresowy.
Poniższy rysunek przedstawia typową krzywą polarograficzną:
Początkowy odcinek ![]()
krzywej odpowiada prądowi szczątkowemu, zwanemu też prądem pojemnościowym. Przyczyną powstania tego prądu jest tworzenie się podwójnej warstwy elektrycznej na powierzchni kropli rtęci. Powstałą podwójną warstwę elektryczną można rozpatrywać jako swego rodzaju kondensator. Ładowaniu tego kondensatora towarzyszy prąd pojemnościowy ![]()
. W związku z małą powierzchnią ![]()
gęstość prądu na katodzie jest większa niż na anodzie. Zatem przy powierzchni kroplowej elektrody rtęciowej następują lokalne zmiany stężenia, a to pociąga za sobą zmianę potencjału elektrody, czyli jej polaryzację. Na anodzie gęstość prądu jest bardzo mała, gdyż jej powierzchnia jest duża. Dlatego nie ulega polaryzacji, a jej potencjał jest stały i anoda może być elektrodą odniesienia. Prąd szczątkowy (odcinek ![]()
krzywej) odpowiada zatem procesowi polaryzacji ![]()
. W punkcie ![]()
zostaje osiągnięte napięcie rozkładowe jednego ze składników (![]()
) i następuje reakcja redukcji zgodnie z równaniem:
![]()
Wynikiem jest wzrost natężenia płynącego prądu przez roztwór. Jony ![]()
ubywają z najbliższego otoczenia elektrody, a w rezultacie powstaje różnica stężeń między warstwą trzyelektrodową a pozostałą częścią roztworu. W wyniku tej różnicy następuje dyfuzja jonów z głębi roztworu do powierzchni elektrody i płynie tzw. prąd dyfuzyjny(![]()
), który przedstawia stromą część krzywej, czyli odcinek ![]()
. Jest to tzw. strefa depolaryzacji ![]()
. Substancje, które przy odpowiednim potencjale depolaryzują ![]()
, czyli ulegają redukcji, noszą nazwę depolaryzatorów. Dalsze zwiększanie napięcia powoduje wzrost szybkości redukcji depolaryzatora. Natężenie prądu dyfuzyjnego osiąga wartość stałą i mówimy o tzw. granicznym prądzie dyfuzyjnym (odcinek ![]()
krzywej - ![]()
). W punkcie ![]()
zostaje osiągnięty potencjał rozkładowy kolejnego depolaryzatora ![]()
i proces się powtarza.
2. Rola elektrolitu podstawowego w polarografii.
W analizie polarograficznej bardzo ważną rolę odgrywa elektrolit podstawowy. Elektrolit podstawowy jest elektrolitem obojętnym, którego kation i anion nie ulegają zmianą elektrolitycznym w badanym przedziale potencjałów.
W skład elektrolitu podstawowego wchodzą:
- elektrolit przewodzący prąd- są to sole mocnych kwasów i zasad (np. NaCl, KCl, LiCl) oraz czwartorzędowe sole amoniowe,
- substancje powierzchniowo czynne (np. żelatyna, surfaktanty), tłumiące maksima,
- roztwory buforowe i związki kompleksotwórcze pozwalające na rozdzielenie fal położonych blisko siebie lub zamaskowanie przeszkadzających kationów.
Elektrolit podstawowy umożliwia depolaryzatorom zbliżanie się do katody prawie wyłącznie na drodze dyfuzji. Gdyby elektrolitu podstawowego nie było, wówczas depolaryzator dostawałby się do elektrody w wyniku migracji elektrycznej, czyli ruchu jonów w polu elektrycznym oraz dyfuzji wywołanej różnicą stężeń jonów znajdujących się w warstwie przyelektrodowej i poza tą warstwą.
Wobec elektrolitu podstawowego prąd graniczny jest równy prądowi dyfuzyjnemu. Duże stężenie elektrolitu podstawowego (ok. 100- krotnie większe od stężenia depolaryzatora) powoduje, że składowa migracyjna prądu spada do zera.
3. Prąd szczątkowy i napięcie rozkładu.
Przy małych napięciach w układzie płynie bardzo mały prąd, tzw. prąd szczątkowy
i dopiero po przekroczeniu pewnego napięcia prąd gwałtownie wzrasta, a następnie osiąga prawie stałą wartość, tzw. prąd graniczny, zależny od stężenia jonu elektrochemicznie czynnego. Prąd szczątkowy jest wynikiem przede wszystkim dwóch procesów: tzw. "upływności kondensatora", którym jest granica faz elektroda/elektrolit i zachodzenia w niewielkim stopniu reakcji elektrodowej przy napięciach niższych od napięcia rozkładu. Różnica pomiędzy prądem granicznym, a prądem szczątkowym jest nazywana prądem dyfuzyjnym. Prąd dyfuzyjny może niekiedy zawierać składową prądu migracyjnego.
W obecności nadmiaru elektrolitu podstawowego jest czystym prądem dyfuzyjnym, proporcjonalnym do stężenia jonu elektrochemicznie czynnego.
Jeżeli nasz układ będzie się składał
z elektrody platynowej zamiast miedziowej, to zauważymy, że ciągła elektroliza pojawi się dopiero wówczas, kiedy przykładane z zewnątrz napięcie osiągnie pewną krytyczną wartość, tzw. napięcie rozkładu. Takie zachowanie jest charakterystyczne dla elektrod polaryzowalnych. Zmiany natężenia prądu w funkcji przyłożonego napięcia dla takiego układu przedstawia rysunek 1.
Potencjał w punkcie Eroz na rysunku 1 nosi nazwę napięcia rozkładu. Jest to napięcie, przy którym następuje widoczne i ciągłe wydzielanie się produktów elektrolizy. Napięcie rozkładu nie ma teoretycznego znaczenia w związku z trudnościami precyzyjnego wyznaczenia jego wartości. Wartość napięcia rozkładu jest wypadkową co najmniej trzech efektów występujących podczas elektrolizy: wstecznej siły elektromotorycznej, polaryzacji stężeniowej i aktywacyjnej.
Gdy do elektrod platynowych przyłożymy napięcie niższe od napięcia rozkładu, wówczas wydzielą się bardzo małe ilości produktów elektrolizy (w omawianym wyżej przypadku Cu i O2) i w pierwszym momencie pojawi się stosunkowo duży prąd, który następnie zmaleje do wartości prądu resztkowego. W ten sposób elektrody zostaną spolaryzowane.
4. Stosowalność układu 3 elektrod w pomiarach.
Współcześnie najczęściej stosowany jest w pomiarach w woltamperometri cyklicznej układ trójelektrodowy składający się z naczyńka pomiarowego, w którym umieszczone są trzy elektrody:
- elektroda badana (tzw. elektroda pracująca, WE),
- elektroda odniesienia (elektroda chlorosrebrowa, RE),
- elektroda pomocnicza (elektroda platynowa, CE)
Kiedyś stosowano tylko dwie elektrody pracującą
i elektrodę odniesienia o powierzchni na tyle dużej by przepływający przez nią prąd nie powodował zmiany jej potencjału. Jeżeli nie jest to możliwe do spełnienia stosowany jest dodatkowy układ elektroniczny - potencjostat i trzecia elektroda pomocnicza przez którą przepływa prąd.
W tym przypadku elektroda odniesienia nie musi mieć bardzo dużej powierzchni ponieważ nie przepływa przez nią prąd. Dodatkowa stosowana w tym układzie elektroda pomocnicza przyjmuje prąd płynący przez elektrodę pracującą. Wykonywana jest zwykle z metalu szlachetnego (najczęściej platyny) lub węgla szklistego. Należy pamiętać, że na elektrodzie pomocniczej przebiega także reakcja elektrochemiczna, a jej produkty mogą zanieczyścić roztwór badany. Dlatego elektroda ta powinna być okresowo czyszczona (np. w kwasie azotowym).
Potencjostat kontroluje potencjał elektrody pracującej względem elektrody odniesienia. Budowa potencjostatu zapewnia, że prąd przepływa pomiędzy elektrodą pracującą, a elektrodą pomocniczą. Nie przepływa natomiast przez elektrodę odniesienia dzięki czemu jej potencjał jest stały.
5. Różnice między polarografią, a woltamperometrią cykliczną.
Woltamperometria i polarografia to elektrochemiczne metody analizy opierające się na pomiarze prądu związanego z przebiegiem reakcji elektrodowej. Pomiar prowadzony jest w tak dobranych warunkach by mierzony prąd odzwierciedlał przebieg interesującego analityka procesu a nie procesów przeszkadzających.
Główną różnicą miedzy polarografia, a woltamperometrią są terminy, które bezpośrednio klasyfikują dana metodę:
- termin polarografia należy stosować, wtedy kiedy jako elektrodę pracującą stosuje się elektrodę ciekłą, której powierzchnia odnawia się w sposób okresowy lub ciągły.
- termin woltamperometria jest zalecany do określenia badania zależności natężenia prądu od doprowadzonego napięcia lub potencjału elektrody z użyciem stacjonarnych (stałych) elektrod wskaźnikowych, niezależnie od tego z jakiego materiału zostały wykonane.
Polarografia to część woltamperometrii, elektrochemiczna metoda analityczna polegająca na przyłożeniu liniowo wzrastającego potencjału elektrycznego do kroplowej elektrody rtęciowej będacej elektrodą pracującą z cyklicznie zmieniającą się w trakcie pomiaru powierzchnią i rejestracji natężenia prądu płynącego przez nią. Wartość natężenia prądu jest proporcjonalna do stężenia obecnej w roztworze substancji ulegającej utlenieniu lub redukcji. Krzywa zależności natężenia prądu od liniowo rosnącego potencjału, rejestrowana za pomocą aparatu zwanego polarografem, w postaci tzw. krzywej polarograficznej pozwala zidentyfikować substancję badaną i określić jej stężenie.
6. Krzywe polarograficzne, a krzywe woltamperometryczne-cykliczne.
Krzywe polarograficzne:
Cykliczna woltamperometria polega na liniowej zmianie w czasie potencjału przyłożonego do stacjonarnej elektrody pracującej umieszczonej w niemieszanym roztworze. Stosowana jest zmiana potencjału w kształcie fali trójkątnej w dobranym zakresie (E0 - E1)
w pojedynczych lub wielokrotnych cyklach w zależności od poszukiwanej informacji. Podczas przemiatania potencjału, układ pomiarowy mierzy prąd, który jest wynikiem reakcji elektrodowej pod wpływem przyłożonego potencjału względem elektrody odniesienia. Wykres zależności prądu od potencjału jest nazywany, woltamperogramem cyklicznym.
Rys.2 ilustruje reakcję odwracalnej pary redoks podczas pojedynczego cyklu potencjałowego. Zakładamy, że początkowo jest obecna w roztworze tylko utleniona forma Ox reagująca szybko z elektrodą. Potencjał ujemny jest wybierany dla pierwszej połowy cyklu, zaczynając od wartości gdzie nie zachodzi redukcja. Kiedy zastosowany potencjał zbliża się do charakterystycznego potencjału formalnego Ef badanego procesu redoks, katodowy prąd zaczyna rosnąć aż osiągnie pik. Kierunek polaryzacji jest zmieniany po przejściu obszaru potencjałów, w którym formował się pik prądu. Po zmianie kierunku polaryzacji, cząsteczki (jony) Red (wytworzone w katodowej połowie cyklu i gromadzone blisko powierzchni) są utleniane z powrotem do Ox, a w wyniku tworzy się pik prądu anodowego.
Rys.2 Typowy cykliczny woltamperogram odwracalnych procesów redoks Ox + ne- ↔ Red.
W czasie przebiegu takich procesów tworzy się warstwa dyfuzyjna blisko powierzchni elektrody. Najlepiej może to być wyjaśnione poprzez dokładne badanie profili stężenie - odległość podczas zmiany potencjału. Wynikiem płynącego prądu jest ciągła zmiana gradientu stężenia w czasie. Należy zwrócić uwagę, że ciągła zmiana stężenia powierzchniowego jest związana z rozbudowaniem grubości warstwy dyfuzyjnej. Stąd, wzrost piku prądu dąży do osiągnięcia kontroli dyfuzyjnej, co przejawia się przy bardziej ujemnych potencjałach spadkiem prądu zgodnie z zależnością t-1/2. W podobny sposób kształtuje się prąd piku anodowego. W tym przypadku prąd jest ograniczony dyfuzją do elektrody formy Red wytworzonej w procesie redukcji, a ponieważ jest ona tylko przy powierzchni elektrody, prąd ten dość szybko obniża się zmierzając do zera.
Cykliczny woltamperogram jest charakteryzowany przez kilka ważnych parametrów. Cztery łatwe do zarejestrowania parametry to, wartości prądów obu pików a także ich potencjały, które dostarczają podstaw dla diagnostyki rozwiniętej przez Nicholsona i Shaina, w celu dokładniejszego analizowania zależności rejestrowanych metodą cyklicznej woltamperometrii.
7.Procesy zachodzące w poszczególnych etapach pomiaru metodą woltamperometri inwerysjnej.
Woltamperometria odwrócona (inwersyjna) umożliwia oznaczenie związków elektrodowo czynnych nawet w zakresie o stężeniach ![]()
. Jest to jedna
z najczulszych metod, a przy tym najtańszych stosowanych w analizie śladowej zarówno kationów metali jaki i anionów nieorganicznych. Proces przebiega w dwóch etapach:
Etap pierwszy: to elektrolityczne wydzielenie analizowanej substancji z roztworu
i osadzenie jej na mikroelektrodzie pracującej np. wiszącej kropli rtęci (![]()
). Jest to proces nie rejestrowany, zachodzący na drodze konwekcji, tzn. przy mieszaniu roztworu. Gdy np. oznaczamy ![]()
, wówczas zachodzi reakcja:
![]()
Na kropli rtęci tworzy się amalgamat ![]()
. Znajdujący się w roztworze ![]()
wydziela się na mikroelektrodzie rtęciowej i z dużej objętości roztworu (np.![]()
) ulega zatężeniu na kropelce rtęci (np. objętości ![]()
), czyli uzyskujemy ok. ![]()
- krotny efekt zatężenia.
Etap drugi: jest to właściwy proces oznaczenia, który polega na rozpuszczeniu wydzielonej na elektrodzie substancji, przy odwróceniu (inwersji) kierunku zmian potencjału elektrody. W przypadku analizy ![]()
mamy proces anodowego rozpuszczania kadmu
z elektrody, czyli:
![]()
Proces anodowego rozpuszczania jest procesem dyfuzyjnym i jest rejestrowany w postaci fali woltamperometrycznej, która stanowi podstawę oznaczeń analitycznych. A zatem w przypadku metod polarograficznych i woltamperometrycznych reakcjom elektrodowym ulegają specyfiki znajdujące się w roztworze, natomiast w przypadku odwróceń woltamperometrii reakcjom elektrodowym ulegają substancje wydzielone uprzednio na elektrodzie pracującej. Metoda ta polega zatem na nagromadzeniu analitu na elektrodzie pracującej, jego roztwarzaniu i rejestracji krzywej ![]()
.
6. Wyprowadzenie wzoru na oznaczenie cynku metodą dodawania wzorca oraz obliczenia.
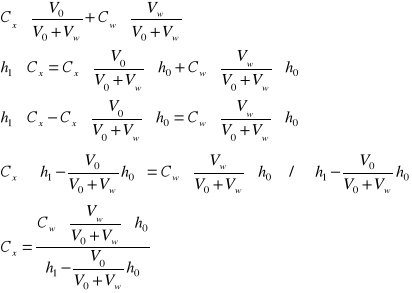
Wyprowadzenie wzoru na oznaczenie cynku metodą dodawania wzorca:
![]()
- nieznane stężenie w próbce i odpowiadająca mu wysokość piku
![]()
- stężenie dodawanego wzorca
![]()
- objętość dodawanej porcji wzorca
![]()
- początkowa objętość próbki
![]()
- wysokość piku po dodaniu wzorca
![]()
- odpowiada stężeniu ![]()
![]()
- nowa wyższa wartość piku po dodaniu wzorca odpowiada stężeniu:
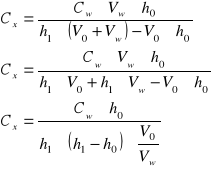
Wyznaczanie stężenia ![]()
w wodzie destylowanej (metoda dodawania wzorca - obliczenie stężenia zgodnie z podanym powyżej wzorem).
Wyznaczanie stężenia |
Natężenie prądu |
|
Nieznane stężenie
|
|
|
Po dodaniu wzorca |
|
|
|
- - - - - - - - |
|
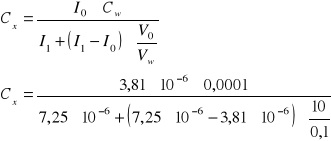
![]()
Stężenie ![]()
w wodzie destylowanej wynosiło ![]()
.
1
PC
Potencjostat
CE
RE
WE
Ig
Eroz
E [V]
I
[A]
E
I
D
C
B
A
I = f(E) Odcinek AB na krzywej odpowiada prądowi szczątkowemu.
I = f(E) Odcinek BC na krzywej odpowiada prądowi dyfuzyjnemu.
A
B
C
D
I
E
I = f(E) Odcinek CD na krzywej odpowiada sterfie depolaryzatora
A
B
C
D
I
E
Rys.1. Zmiana potencjału w czasie w eksperymentach cyklicznej woltamperometrii.
Rys. Krzywa zależności prąd -potencjał
Wyszukiwarka
Podobne podstrony:
Badanie natężenia czynników szkodliwych na stanowisku pracy-hałas, ANALITYCZNE METODY INSTRUMENTALNE
Oznaczanie chromu w ściekach garbarskich metodą z difenylokarbazydem (DFK)-ćwiczenia, ANALITYCZNE ME
Sporządzenie skali wzorców nietrwałych-ćwiczenie, ANALITYCZNE METODY INSTRUMENTALNE
Oznaczanie ChZT i anionów w wodzie, ANALITYCZNE METODY INSTRUMENTALNE
MANGAN I ŻELAZO-AZOTANY-POTENCJOMETRIA-HAŁAS-CHZT-SURFAKTANTY, ANALITYCZNE METODY INSTRUMENTALNE
Oznaczanie azotanów(V) i azotanów(III) w wodzie, ANALITYCZNE METODY INSTRUMENTALNE
Oznaczanie metali ciężkich w glebie metodą ASA-ćwiczenia, ANALITYCZNE METODY INSTRUMENTALNE
Cz 8 1 Instrumentalne metody analityczne Metody elektrochemiczne
polarografia i woltampero, Chemia analityczna
Cz 8 Instrumentalne metody analityczne Metody elektrochemiczne
12 ELEMENTY ANALITYKI GEOCHEMICZNEJ d same metody instrumentalneid 13444
Cz 8 2 Str 15 i 17 Instrumentalne metody analityczne Metody elektrochemiczne
Cz 9 Instrumentalne metody analityczne Metody elektrochemiczne Konduktometria
3 ANALITYCZNE METODY OBLICZANIA PŁYWÓW
Metody - instrukcja dla badaczy STUDIA ZAOCZ 2011, Praca i czas prywatny
Pytania od dr, Studia, IV rok, IV rok, VIII semestr, Metody instrumentalne
chemia analityczna, Farmacja UMB, Farmacja UMB, II Rok, Chemia analityczna II - instrumentalna
więcej podobnych podstron