CHEMIA FIZYCZNA
WYKŁAD I
Ogólne podstawy procesu elektrolizy.
Przewodność elektryczna w roztworach elektrolitów jest ściśle związana z wędrówką jonów. Potwierdzeniem tego są zjawiska elektrolizy
Jeżeli do roztworu jakiegoś elektrolitu wprowadzi się dwa oddzielne przewodniki elektronowe (przewodniki I klasy) - elektrody. Następnie podłączy je do zewnętrznego źródła prądu stałego to po uzyskaniu odpowiedniego napiecia będzie można stwierdzic ze wystepuje zjawisko elektrolizy
Elektroliza - proces elektrochemiczny związany z przepływem ładunków elektrycznych przez roztwór elektrolitu, a przebiegający na powierzchni elektrod.
Zachodzi tutaj nie tylko przemieszczanie substancji w masie elektrolitu, ale także wydzielanie pewnych materiałów materiałów postaci stałej lub gazowej przy odpowiednich elektrodach (katodzie, anodzie)
Warunkiem niezbędnym dla przebiegu procesu elektrolizy musi być obecność swobodnie poruszających się jonów w poddanym procesowi roztworze elektrolitu, w polarnym rozpuszczalniku (zazwyczaj wodzie) lub elektrolicie stopionym.
W procesie elektrolizy prąd przepływa od elektrody dodatniej do ujemnej.
RYSUNEK
Sumaryczna reakcja przebiega na obu elektrodach podczas procesu elektrolizy jest reakcja utleniania-redukcji (redox). Od zwykłych procesów redox procesy elektrolityczne różnią się sposobem wymiany elektronów.
Katoda (redukcja)
Wydzielanie H 2H+ + 2e- → H2
Wydzielanie metali Ag+ + e - → Ag Cu2+ + 2e- → Cu
Redukcja zwiazkow nieorganicznych |
Anoda (utlenianie)
Wydzielanie Cl 2Cl- → Cl2 + 2e-
Wydzielanie tlenu 4OH- → H2O + 4e-
utlenienie związkow nieorganicznych |
PRAWO FARADAYA
I Masa jakiejkolwiek substancji odłożonej, wydzielonej lub rozpuszczonej na elektrodzie jest wprost proporcjonalna do ilości elektryczności, jaka przepływa prze elektrolit.
M = k • Q = k • I • t
m - masa substancji [g]
k - równoważnik elektrochemiczny [g/c]
Q - ładunek elektryczny [C]
I - natężenie prądu [A]
t - czas [s]
II Na odłożenie, wydzielenie lub rozpuszczenie na elektrodach 1 gramorównoważnika jakiejkolwiek substancji zużywa się zawsze tę samą ilość elektryczności równą 1F
F = NA • e ≈ 96500
F - stała Faradaya [c/mol]
NA - Liczba awogarda 6,022169•1023 liczba atomów w gramoatomie ?!) [1/mol]
e - ładunek elektryczny …
Inna postać
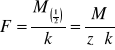
![]()
- masa równoważnikowa [g/mol]
M - masa molowa [g/mol]
z - liczba przejścia ( ładunek rozładowania jonu, wartościowość)
k - równoważnik elektrochemiczny
II prawo inaczej:
Stosunek masy molowej substancji wydzielonej na którejkolwiek z elektrod do wielkości elektrochemicznej jest wielkością stałą.
Poł 2 praw Farad.
![]()
![]()
Jeżeli po jakimś czasie usuniemy zewnętrzne źródło prądu, to na elektrodach wystąpi określona różnica potencjałów i układ taki będzie dostarczał prądu elektrycznego, który jest w stanie wykonać pracę.
Po zwarciu obu elektrod prąd w roztworze popłynie w kierunku przeciwnym do poprzedniego. Taki uklad nazwiemy galwanicznym(?)
W tym przypadku reakcje biegną w kierunku przeciwnym i zachodzą samorzutnie, oddając otoczeniu energię elektryczną związaną z ujemną wartością potencjału termodynamicznego procesu. Reakcja chemiczna, biegnąca w ogniwie, jest reakcją utleniania-redukcji, na którą składają się dwa oddzielne procesy elektrodowe na granicy faz roztwór elektroda.
Na granicy faz musi następować oddawanie, pobieranie elektronów.
Elektroda, półogniwo - układ złożony z przewodnika I klasy roztworu elektrolitu ewentualnie innych faz (gazów, ciał stałych) stykających się z metalem i biorących udział w reakcji elektrodowej .
W układzie półogniwa biegnie w odpowiednich kierunkach reakcja elektrodowa, która różni się do innych tym, że uczestniczą w niej bezpośrednio w charakterze reagentów swobodne elektrony, z czym ściśle wiąże się występowanie różnicy potencjału elektrycznego pomiędzy roztworem a metalem, czyli potencjał elektrody.
Typowym procesem elektrodowym jest reakcja gdzie uczestniczy metal elektrody M, jego jon M+ oraz elektrony swobodne.M2+ + 2e M
Kierunek tej reakcji zależy od kierunku prądu przepływającego przez półogniwo. Jeżeli elektroda ma znak dodatni (anoda), zachodzi redukcja, gdy ujemny (katoda) - utlenianie.
Elektrody wykazujące niezależną od kierunku stałą wartość potencjału są nazywane elektrodami odwracalnymi.
Dlatego też musimy zaznaczyć, że używanie terminów: anoda dla elektrody (+) i katoda dla elektrody (-) ogniw galwanicznych, nie jest ogólnie przyjętym zwyczajem.
Szczególne badania wykazały że na granicy faz: roztwór-elektroda, powstaje skok potencjału - potencjał elektrodowy.
Przyczyną powstawania potencjału na granicy faz jest dążność metalu do przejścia do roztworu. Dążność tę nazwano elektrolityczną prężnością roztwórczą.
Atomy metalu, stykające się z roztworem, przechodzą do roztworu w postaci jonów, oddając elektrodzie jeden (kilka) elektronów. Jony danego metalu znajdujące się w roztworze, wykazują dążność do osadzania się w postaci atomów na metalu. Analizowane skoki potencjalu sa rozne dla odpowiednich ukladow pologniw.
Dobierając odpowiednio dwa układy półogniw uzyskuje się pierwowzór ogniwa galwanicznego, a w rezultacie siłę elektromotoryczną E równą różnicy potencjałów poszczególnych elektrod.
Powstające SEM ogniwa można wyrazić
![]()
Przez SEM ogniwa należy przede wszystkim rozumieć napięcie pomiędzy elektrodami otwartymi mierzone metodami kompensacyjnymi (bez poboru prądu).
W ogniwach galwanicznych może występować roztwór, najczęściej jednak elektrody zanurzone są w dwóch różnych roztworach kontaktujących się ze sobą poprzez porowatą ścianką lub połączonych za pomocą klucza elektrolitycznego.
SCHEMAT OGNIWA GALWANICZNEGO
RYSUNEK
Gdy ogniwo zawiera dwa różne roztwory, na granicy faz ich styku powstaje jeszcze dodatkowy potencjał dyfuzyjny.
E =∏+ - ∏- + ∏D
Gdy ogniwo zawiera jeden roztwór, to potencjał dyfuzyjny jest równy zeru, a siła elektromotoryczna jest sumą kolejnych potencjałów międzyfazowych.
Potencjał dyfuzyjny wystąpi tylko wtedy, gdy liczby przenoszenia kationów i anionów stykających się elektrolitów będą różne. Istnieją elektrolity, dla których liczby przenoszenia jonów są takie same: KCl, Na4NO3, KNO3. Dla tych substancji potencjał dyfuzyjny jest równy zeru.
WYKŁAD II
SEM ogniwa a termodynamika
Powinowactwem chemicznym nazywamy siłę napędową każdego samorzutnego, samorzutnego także wymuszonego procesu chemicznego. W procesie chemicznym układ zmienia stan, dążąc do określonego (poprzez stany pośrednie) stanu końcowego. Ten szereg stanów pośrednich nazywamy drogą przemiany.
Każdy proces wywołany jest działaniem jakichś bodźców termodynamicznych, które mogą mieć związek z właściwościami ciał tworzących dany układ (bodziec wewnętrzny) lub też z siłami oddziaływującymi na układ (bodziec zewnętrzny). Zależnie od tego wyróżniamy procesy samorzutne i wymuszone.
Jeżeli układ pobiera podczas przemiany energię w postaci, np. pracy elektrycznej, to zachodzi proces wymuszony. Bieg chemicznej reakcji wymuszonej wymaga ciągłej ingerencji zew. W postaci dostarczania pracy nie mechanicznej (najczęściej elektrycznej). Przykładem takiej reakcji są wszystkie procesy elektrolizy.
Jeżeli mówimy o pracy związanej z reakcją chemiczną, to odnosimy tę pracę do sił międzycząsteczkowych powodujących występowanie związanej z tymi cząsteczkami energii potencjalnej. Zachodzi zatem proces gromadzenia się energii wewnątrz układu.
Energią wewnętrzną układu nazywamy sumę wszystkich rodzajów energii cząsteczek znajdujących się w układzie. Energia wew. czasteczkowa układu jest więc wielkością charakterystyczną dla danego stanu układu, a niezależną od sposobu dojścia układu do tego stanu.
Energią wewnętrzną układu jest więc wielkością charakterystyczną dla danego stanu układu, a niezależną od sposobu dojścia układu do tego stanu.
Ogniwa galwaniczne są ukł. , gdzie energia chemiczna zamieniana jest na energię elektryczną, przy czym wykorzystuje się procesy wywoływane wymianą elektronów między reagującymi ze sobą substancjami. Zależności te określają prawa termodynamiki.
Z punktu widzenia termodynamiki teoretyczne wartości napięcia ogniwa sporządzonego z reagujących składników (w przypadku odwracalności procesu) są związane z pracą maksymalną, czyli zmianą potencjału termodynamicznego. Pracę tę należy wykonać kosztem energii doprowadzonej z zewnątrz.
∆G = ∆ - T • ∆S
∆G - zmiana potencjału
∆G = ∆H - T∆S
∆G - zmiana potencjału termodynamicznego przebiegającej w ogniwie reakcji chemicznej
∆H - zmiana entalpii reakcji
T - temperatura w skali bezwzględnej
∆S - zmiana entalpii reakcji
Ale maksymalna praca elektryczna, przy założeniu odwracalności procesu w ogniwie równa jest potencjałowi termodynamicznemu przebiegającej reakcji chemicznej.
Lmax = + ∆G
Praca maksymalna wyraża się przeniesieniem Max ładunków elektrycznych (odpowiadających liczbie zużytych Max reakcji gramorównoważników utleniacza lub reduktora) - na wyższy od E woltów poziom potencjału elektrycznego:
Lmax = - zFE
Z - ładunek jonu (liczba gramorównoważników, jaka została przetworzona w wyniku procesu elektrochemicznego)
F - stała Faradaya
E - różnica potencjałów
Iloczyn FE stanowi użyteczną energię elektryczną, która wyzwala się (lub którą należy doprowadzić z zew.) podczas rozpatrywanej reakcji jednego gramorównoważnika substratów. Znak „-„ iloczynu oznacza, że ukł. oddał energię na
zew. Równanie to (łączy termodynamikę procesów elektrochemicznych z termodynamiką reakcji chemicznych) dotyczy jedynie przemian odwracalnych. Ogniwa galwaniczne są jedynymi układami, w których praktycznie reakcje chemiczne można przeprowadzić qwasistatycznie w warunkach ∆G ≠ 0 (tzn. daleko od stanu równowagi chemicznej).
Potencjał elektryczny, a wzór NERNSTA
Wielkość potencjału zależy od rodzaju metalu (M) elektrolitu i aktywności (stężeń) jonów w roztworze:
W ogniwach galwanicznych, sporządzonych z dwóch różnych metali wykorzystano zjawisko przyjmowania przez metal (zanurzony w roztworze elektrolitu) potencjału elektrycznego, którego wielkość zależy od własności drugiego metalu. W procesach tworzenia kationów atomy metalu tracą swe elektrony walencyjne (ulegają utlenianiu), które powstając w nierozpuszczalnej masie metalu, nadają jej ładunek ujemny. Wielkość ładunku, czyli potencjał elektryczny zależy od rodzaju i aktywności jego kationów w roztworze. Nie ma na niego wielkość zanurzonej powierzchni.
Im słabiej związane są jony metalu w jego siatce krystalicznej oraz im większą wykazują zdolność łączenia się z cząsteczkami wody (energia hydratacji), tym więcej kationów przejdzie do roztworu. Szybkie ustalenie się równowagi w takim ukł. jest przede wszystkim aktywnością kationów, które znalazły się w roztworze wykazują skłonność do powtórnego osiadania na powierzchni metalu.
Na granicy faz metal-roztwór, występują siły elektrostatyczne przyciągania między ujemnie naładowaną masą metalu, a kationami o ładunku dodatnim.
Od chwili ustalenia się równowagi między metalem i otaczającym go środowiskiem roztworu ustala się również potencjał metalu.
Jeżeli ogniwo składa się z dwóch elektrod - na jednej zachodzi wydzielenie kationów:
![]()
+ 2e ![]()
![]()
a na drugiej - przechodzenie jonów metalu do roztworu:
![]()
![]()
![]()
+ ![]()
![]()
![]()
Sumaryczna reakcja w ogniwie w stanie równowagi:
![]()
W przypadku rozcieńczonych aktywności jonów można zastąpić stężeniem molowym:
Szereg potencjałów standardowych.
Potencjał elektrody można wyznaczyć tylko w stosunku do innej elektrody (gdyż jeszcze nie wynaleziono metody mierzenia bezwzględnych wartości potencjału elektrody).
Dlatego chcąc określić potencjał elektrody, buduje się w praktyce ogniwo składające się z ej elektrody oraz drugiej elektrody (pomocniczej), o znacznym potencjale i mierzy się SEM tego ogniwa. Na tej postawie oblicza się potencjał elektrody. Umownie przyjęto, że w tego typu pomiarach elektrodą porównawczą jest standardowa elektroda wodorowa.
ELEKTRODA WODOROWA
RYSUNEK
Ustala się stan równowagi:
½ H![]()
+ ![]()
Wzór Nerstona na potencjał elektrody wodorowej:
![]()
aktywność kationów (![]()
) dla standardowej elektrody wodorowej równej 1, zatem:
![]()
Umownie przyjęto że potencjał elektrody wodorowej w każdej temperaturze jest równy zeru.
![]()
Natomiast wartości tego potencjału przyjmuje się jako potencjał odniesienie w pomiarach potencjału elektrod.
Wartość potencjałów elektrod wyznaczone względem potencjału standardowej elektrody wodorowej nazywamy potencjałami standardowymi i tworzą szereg potencjałów standardowych.
Metale o bardziej ujemnym potencjale wypierają z roztworów jony charakterystyczne dla elektrod o potencjale bardziej dodatnim.
![]()
![]()
Każdy metal o standardowym potencjale ujemnym będzie wypierać wodór z roztworu, natomiast metal o potencjale dodatnim będzie sam wypierany przez wodór.
Na podstawie znajomości wartości siły elektromotorycznej ogniwa można obliczyć wartość zmian entalpii swobodnej reakcji zachodzących w ogniwie (∆G0 = -zFE0). Standardowa zmiana entalpii swobodnej reakcji związana jest ze stałą równowagi reakcji chemicznej zależnością:
∆G0 = -2,303 RTlogK
-zFE0 = -2,303 RTlogK
Na podstawie pomiarów siły elektromotorycznej ogniwa można wyznaczyć stałą równowagi reakcji chemicznej K zachodzącej w ogniwie.
Elektrody I rodzaju
Elektroda metaliczna - metal zanurzony do r-ru elektrolitu zawierającego jony tego metalu (M2+/M).
M2+ + 2e - => M
Elektrody metalowe odznaczają się małą odtwarzalnością potencjału, który jest zmienny w czasie. Stosunkowo najlepszą odtwarzalnością spośród elektrod metalowych wykazują elektrody rtęciowe lub amadnganatowe?!
Elektroda gazowa - składa się z metalu (najczęściej szlachetnego, Pt, Pb, Ar) zanurzonego w r-rze nasyconym gazu (elektroda wodorowa, chlorowa, tlenowa …….. ).
Elektroda tlenowa - składa się z metalu (Pt) zanurzonego w r-rze zawierającym jony OH - do którego doprowadzony jest tlen.
Elektroda tlenowa wykazuje słabą odtwarzalność potencjału i nie osiąga nigdy przewidzianej teoretycznie wartości tego potencjału.
Elektroda chlorowa (wykazuje dobrą odtwarzalność i stałość potencjału)
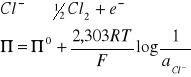
Elektrody utleniające-redukujące - do tego rodzaju elektrod należą półogniwa, w których zachodzą rekcje redox.
Metal elektrody odgrywa rolę przenośnika ładunku elektrycznego:Red ![]()
Ox + 2e-
![]()
![]()
Duże znaczenie mają elektrody utl-red zawierające mieszaninę odpowiednich związków organicznych np. elektroda chinhydrynowa. Składa się ona z blaszki Pt zanurzonej w nasyconym r-rze chinhydronu:
Elektrody II rodzaju
Elektrody II rodzaju wyodrębniono tworząc oddzielny typ elektrod, ze względu na ich specyficzną budowę i własności: M/Ma(s), MIA(ag).
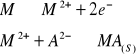
![]()
![]()
M - metal
MA - metal przez słabo rozpuszczalną sól tego metalu i słabo rozpuszczalną drugiego rodzaju
-
Elektrody drugiego rodzaju wykazują bardzo dobrą stałość i odtwarzalność potencjału. Używane są one jako elektrody odniesienia w pomiarach potencjometrycznych
rYSUNEK
2Cl - + 2Hg Hg2CL2 + 2e -
Potencjał elektrody kalomelowej, zależy od aktywności jonów chlorkowych. W r-rach nasyconych aktywność jonów Cl - jest stała.
Dzięki temu elektroda wykazuje duża stałość i odtwarzalność potencjału. Potencjał elektrody kalomelowej zależy od stężenia KCl
W temp 25 stopni potencjal elektrody:
Potencjał [V] |
Stężenie KCl [mol/dm3] |
0,3365 |
0,1 |
0,2802 |
1 |
0,2440 |
Nasycjony |
Elektordy tlenkowe
Hg/HgO(s), OH - elektroda rtęciowa Ag/Ag2O(s), OH - elektroda srebna
Hg + 2OH- HgO + H2O + 2e-
Ruchliwość i liczby przenoszenia jonów.
Pod wpływem zew. Pola elektrycznego jony poruszają się w elektrolicie z różnymi prędkościami. Prędkość ta zależy od wielu czynników, jak: rodzaj jonów, właściwości rozpuszczalnika (np. jego lepkość), stężenie r-ru, natężenie pola elektrycznego
W elektrochemii zamiast pojęcia prędkości jonu wprowadza się pojęcie ruchliwości jonu. Ruchliwością jonu nazywamy prędkość którą ma jon w polu elektrycznym o różnicy potencjału 1V/cm
Ruchliwość jonów (kationów n + i anionów n - ) danego elektrolitu nie są jednakowe i zależą od stężenia. Ruchliwość ta wzrasta w miarę rozcieńczania r-ru rur osiąga maksymalną wartość dla r-ru rur nieskończenie dużym rozcieńczeniu - wtedy nazywamy to graniczną ruchliwością jonu ![]()
![]()
.
Z ruchliwością jonów jest ściśle związane przewodnictwo danego elektrolitu.
![]()
Wielkości Fn + i Fn - nazywamy molowymi przewodnictwami jonowymi. Oprócz ruchliwości jonów ważnymi wielkościami charakteryzującymi zachowanie się jonów w r-rach elektrolitów są tzw. liczby przenoszenia jonów.
Liczba przenoszenia określa ładunek przenoszony podczas ruchu danych jonów o jednakowych ładunkach w stosunku do sumarycznego ładunku przenoszonego przez aniony i kationy. Rozróżnia się liczby przenoszenia kationu t+ i anionu t-
Liczbę przenoszenia kationów t+ nazywa się stosunek ładunku przenoszonego przez kationy do całkowitego ładunku przenoszonego przez jony:
t+ = q+/q t - = q - /q
Suma liczb przenoszenia kationów i anionów jest równa 1: t++ t-=1
Znając wartość liczby przenoszenia jonów dla danego r-ru elektrolitu można obliczyć, jaka część ładunku elektrycznego jest przenoszona przez kationy, a jaka przez aniony.
Liczby przenoszenia związane są z ruchliwością kationów i anionów. Np.: dla elektrolitu KA który w stanie równowagi dysocjuje według równania: KA K+ + A-
Liczby przenoszenia:
Przewodnictwo elektrolitów.
Przewodnictwo elektronowe wykazują przede wszystkim metale i ich stopy stanie stałym lub ciekłym oraz grafit niektóre tlenki siarczki węgliki.
Do grupy przewodników jonowych (elektrolitów) należą natomiast roztwory soli, kwasów, zasad, jak również niektóre sole elektrolitów stopy elektrolitów stanie stopiony.
Roztwór elektrolitów (przewodzące prąd elektryczny) różnią się pod wieloma względami od r-rów nie elektrolitów (nie przewodzących prądu). R-ry elektrolitów wykazują np. wyższe ciśnienie osmotyczne, podwyższenie temp. wrzenia i obniżanie temp. Krzepnięcia w celu ilościowego scharakteryzowania przewodnictwa elektrolitów wprowadzono pojęcie przewodnictwa właściwego i molowego.
Przewodnictwo właściwe elektrolitu K zdefiniowane jest jako odwrotność oporności właściwej elektrolitu:
K = 1/p
Oporność właściwa:
P=R∙s/l
gdzie R- opór elektryczny, s- pole poprzecznego przekroju przewodnika, l- długość przewodnika.
Przewodnictwo właściwe elektrolitu jest przewodnictwem, które wykazuje słupek elektrolitu o dł. 1 cm przekroju poprzecznym 1 cm2.
Wyrażając dl. w cm, opór w Ω a przekrój w cm2 otrzyma się wymiar przewodnictwa właściwego Ω -1cm -1 lub Ω +1cm +1.
Przewodnictwo właściwe jest zależne od stężenia elektrolitów, dlatego też przewodnictwa różnych elektrolitów można porównywać ze sobą tylko w przypadku tego samego stężenia. W celu bardziej ogólnego ujmowania tego zagadnienia wprowadzono pojecie przewodnictwa molowego.
Przewodnictwo molowe λm:
λm = K ∙ V = K ∙ 1000/C
gdzie: V - objętość roztworu, K - przewodnictwo właściwe, C - stężenie molowe elektrolitu.
Liczba 1000 stanowi współczynnik przeliczany pozwalający przejść od objętości roztworu wyrażoną w dm3 do objętości wyrażonej w cm3.
Przewodnictwo molowe λm można uważać za przewodnictwo roztworu zawartego między elektrodami odległymi o 1cm i zawierającego 1 mol elektrolitu.
Przewodnictwo molowe wyraża się w jednostkach cm3/mol∙Ω
Zależność przewodnictwa molowego elektrolitu od stężania molowego może być różna.
Przewodnictwo molowe elektrolitu o ∞ dużym rozcieńczeniu (stężeniu bliskim zeru) nazywa się granicznym przewodnictwem molowym i oznacza λm∞. W tak dużym rozcieńczeniu jony w elektrolicie są bardzo odległe od siebie i poruszają się w sposób niezależny.
Całkowite przewodnictwo elektrolitu o tak dużym rozcieńczeniu jest równe sumie przewodnictw kationów i anionów prawa Kohraw..
Praktyczne wykorzystanie chemicznych źródeł prądu uwarunkowane jest łatwością eksploatacji,zastosowaniwem w produkcji,niedrogich i łatwo dostepnych materiałow,stosunkowo łatwą technologią wytwarzania.
Ogniwa galwaniczno - pierwotne i wtórne spełniają te wymagania w różnym stopniu uzależnionym od typu i rodzaju ogniwa.
OGNIWA GALWANICZNE PIERWOTNE
Ogniwa pierwotne są to źródła energii elektrycznej o działaniu jednokierunkowym.
W nich magazynuje się energię chemiczną, która w czasie wyładowywania przekształcana jest w energię elektryczną.
Ogniwa pierwotne różnią się nie tylko pod względem wielkości i wykonania, ale także pod względem zachodzącej w nich reakcji elektrochemicznej. Ogniwo pierwotne zawiera w sobie chemiczne nośniki energii przeznaczone do przetworzenia. Po zżyciu tych nośników, jak również w wyniku poszczególnych uprzednich przekształceń ogniwo „wyczerpuje się”, czyli staje się niezdatne…
Ogniwa manganowo cynkowe - materiałem aktywnym elektrody dodatniej jest MnO2, a ujemnej metaliczny Z. Elektrolitem jest wodny roztwór chlorku amonu NH4Cl (salmiak) z dodatkiem soli neutralnych neutralnych neutralnych środka zagęszczającego.
1. (+) MnO2 / NH4 / Zn (-)
2. (+) MnO2 / ZnCl2 / Zn (-)
3. (+) MnO2 / KOH / Zn (-)
SEM 1,5 V
W zależności od skłaku elektrolitu ogniwa te mogą pracować w przedziale temp.
Od 233 do 333K - uniwersalneOd 233 do 313K - mrozoodporneOd 253 do 333K - letnie
W ogniwach płaskich elektrodą dodatnią jest aglomerat MnO2 oddzielony od elektrody ujemnej wkładką tekturową nasyconą elektolitem, która spełnia rolę separatora.Elektroda ujemna jest płytką cynkową. Jej przeciwna powierzchnia jest pokryta warstwą grafitu, wilgocioodporną i przewodzącą prąd.
Mechanizm wyładowywania ogniw manganowo cynkowych:
4MnO2 + 4NH4Cl + 2 Zn =
Zn + 2MnO2 + H2O = ZnO + 2 MnO(OH)
Zn + 2MnO2 + 2H2O = Zn(OH)2 + 2MnO(OH)
MnO(OH) + ZnCl2 + Zn[(NH3)4]Cl2
Substraty wyładowania mogą brać udział w reakcjach wtórnych (tworzenia ammokompleksów), przy czym stopień przereagowania zależy od rodzaju elektrolitu, rodzaju dwutlenku magnezu o wartości pobieranego z ogniwa prądu.
Ogniwo cynkowe z depolaryzacją powietrzną - tlen z powietrza jest wykorzystywany jako dodatnia substancja czynna ogniwa. Elektroda z depolaryzacją powietrzną (tlenową) ma bardziej dodatni potencjał niż takie materiały jak tlenek miedziawy i tlenek rtęciowy.
Szybkość reakcji tlenu w roztworze alkalicznym jest dość znaczna. Zapas (+) substancji czynnej z otaczającego powietrza jest praktycznie nieograniczony.
(+) O2 / NH4Cl / Zn (-)
(+) O2 / KOH / Zn (-)
SEM = 1,4 - 1,5 V
Sumaryczna reakcja wyładowania dla układu elektrochemicznego:
2Zn + O2 + 4NH4Cl + 2H2O = ZnCl2 + Zn[(NH3)4]Cl22Zn + O2 + 4KOH + 2 H2O = 2 K2Zn(OH)4
Substancja czynna elektrody dodatniej - tlen z powietrza - jest pochłaniana przez węgiel aktywowany
Pochłaniacz ten nasyca się odpowiednimi substancjami hydrofobowymi (parafina, kauczuk) w celu zwiększenia jego żywotności, a zarazem służy jako lepiszcze. Elektroda może być sporządzona, przez sprasowane mieszaniny materiału węglowego (węgla aktywowanego, grafitu) z subst. hydrofobowymi.
Wyczerpanie ogniwa następuje praktycznie w wyniku całkowitego rozpuszczenia się cynku.
Pracują one w temp. 233 - 238 stopni K, a nawet niższych. Okres użytkowania - powyżej roku.Wadą tego rodzaju elektrod:- duża iliść elektrolitu- szybkie zmniejszanie pojemności przy krótkotrwałych wyładowaniach co jest powodowane małą szybkością adsorbcji (- pochłaniania) O2
Ogniwo żelazne z depolaryzacją powietrzną -
(+) O2 / KOH / Fe (-)
SEM 1,0 VSumaryczna reakcja wyładowania:
2Fe + O2 + 2H2O = 2 Fe(OH)2
Reakcja ta zachodzi bez udziału elektrolitu dzięki czemu można zmniejszyć jego ilość do minimum.
Problemem na drodze do sporządzenia takiego ogniwa jest brak elektrody żelaznej nadającej się do użycia - w charakterze elektrody (-) w ogniwie galwanicznym.
Jak wiadomo, elektroda ogniwa galwanicznego musi zachować aktywność elektrochemiczną również w stanie nie naładowanym oraz wysoką trwałość. Aktywność elektrochemiczną otrzymanego przez redukcje termiczną proszku żelaza można zachować stosując odpowiednią jego obróbkę. Elektrody żelazne wykonuje się przez prasowanie aktywnego proszku żelaza z lepiszczem (klej gumowy) aby zwiększyć wydajność takiej elektrody do masy czynnej wprowadza się dodatki przewodzące prąd (grafit). Elektroda żelazna nie zmienia swojego kształtu w procesie wyładowania i dlatego nie trzeba jej umieszczać w żadnej specjalnej obudowie.
Ogniwo manganowo cynkowe z depolaryzacją powietrzną.
(+) MnO2(O2) / NH4Cl / Zn (-) SEM 1,5 V
Sumaryczna r. wyładowania: 4 MnO2 + 4NH4Cl + 2Zn = 4MnO(OH) + ZnCl2 + Zn[(NH3)4]Cl2
Ogniwo manganowo magnezowe
(+) MnO2 / MgBr2 / Mg (-)
SEM 1,8 - 2,0V
Sumaryczna r. prądotwórcza
2MnO2 + Mg + 2H2O = Mg(OH)2 + 2MnO(OH)
Ogniwo magnezowo bizmutowe
(+) Bi2O3 / MgBr2 / Mg (-)
SEM 1,6 -1,65 V
Sumaryczna r. prądotwórcza
Bi2O3 + 3Mg + 3H2O = 3Mg(OH)2 + 2Bi
Ogniwo Magnezowe z utleniaczem organicznym - substancje organiczne mogą być używane w ogniwach o działaniu krótkotrwałym, jak i w ogniwach długotrwałego użytkowania (aromatyczne związki nitrowe (n-dwunitrobenzen))
Aromatyczne związki nitrowe (n - dwunitrobenzen)
rys
Aromatyczne związki nitrowe (p - nitrozodwumetyloanilina)
Rys
Związki chininowe ( dwuokym p - chitonu)
Rys
Ogniwo aluminiowo - manganowe- materiałem anodowym jest aluminium, natomiast elektrolit jest roztworem AlCl3 z dodatkiem Li2CrO4, wprowadzonym w celu spowolnienia korozji elektrody ujemnej. Dla uniknięcia powstania miejscowych wżerw w aluminium stosuje się anodę bimetaliczną.
Zbudowana jest ona z dwóch warstw: wewnętrznej ze stopu Al z dodatkiem 1 % Zn i zewnętrznej ze specjalnego stopu aluminiowego, którego potęcjał jest mniej więcej o 0,1 V bardziej (+) niż potęcjał warstwy wewnętrznej
(+) MnO2 / Li2CrO4 / Al (-)
AlCl3
Ogniwo rtęciowe z anodą cynkową - energia elektryczna tych ogniw powstaje w wyniku wzajemnego oddziaływania tlenku rtęci i cynku metalicznego w elektrolicie zasadowym.
(+) HgO / KOH / Zn (-)
SEM 1,35V
Zn + HgO = ZnO + Hg
Dodatnia masa czynna składa się z mieszaniny (85 - 95) % tlenku rtęci (II) i (5 - 10) % grafitu
Ogniwo rtęciowe z anodą indową lub tytanową
(+) HgO / KOH / In (-)
(+) HgO / KOH / Ti (-)
2In + 3HgO = In2O3 + 3Hg
OGNIWA REZERWOWEOgniwa rezerwowe: chlorek srebra - magnez - , jako anodę stosuje się czysty techniczny magnez, a katoda jest trudno rozpuszczalny chlorek srebra.
Elektrolitem jest r-r chlorku sodu
(+) AgCl / NaCl / Mg (-)SEM 1,3 - 1,6 VElektrolitem jest r-r chlorku soMg - 2 AgCl = MgCl2 + 2 AgCzas pracy:
kilka minut - kilka godzin (mało trwałe!)
Chlorek miedzi(I) - magnez
(+) CuCl / NaCl / MG (-)
SEM 1,7 - 1,8V
Mg + 2CuCl = MgCl2 + 2Cu
Chlorek ołowiu (II) - magnez
(+) PbCl2 / NaCl / Mg (-)
SEM 0,9 - 1,1 V
Mg + PbCl2 = MgCl2 + Pb
Siarka - magnez
(+) S / NaCl / Mg (-)
SEM 1,6V 1,65V
Mg + 2H2O + S = Mg(OH)2 + H2S
Ołowiowo - cynkowe
(+) PbO2 / H2SO4 / Zn (-)
SEM 2,4 - 2,5 V
Zn + PbO2 + 2H2SO4 = ZnSO4 + PbSO4 + 2H2O
Ołowiowo kadmowe -
(+) PbO2 / H2SO4 / Cd (-)
SEM 2,4V
Cd + PbO2 + 2H2So4 = CdSO4 +PbSO4 + 2H2O
ogniwo rezerwowe z rozpuszczalnymi elektrodami
(+) PbO2 / HClO4 / Pb (-)
(+) PbO2 / HBF4 / Pb (-)
(+) PbO2 / H2SiF6 / Pb (-)
SEM 1,92 V
Użyto elektrolitów w których produkty wyładowania są łatwo rozpuszczalne, co pozwala na lepsze wykorzystanie substancji czynnych. Elektrody mogą być sporządzone z litych nieporowatych materiałów. Ogniwa takich układów charakteryzują się niodwracalnościąa i wyższymi parameterami elektycznymi
Sumarczyna r. wyładowania:
Pb + PbO2 + 4 HClO4 = 2 Pb(ClO4)2 + 2 H2O
Pb + PbO2 + 4 HBF4 = 2 Pb(BF4)2 + 2 H2O
Pb + PbO2 + 4 H2SiF6 = 2 PbSiF6 + 2 H2O
Elektrodę dodatnią ogniwa stanowi elektrolityczny PbO2, osadzony w szkielecie grafitu, niklu, stali nierdzewnej, ołowiu lub innego metalu czy stopu w wyniku anodowania w roztworze azotanu ołowiu.
Ogniwa rezerwowe srebrno - cynkowe
(+) AgO / KOH / Zn (-)
SEM 1,85 V
AgO + Zn = ZnO + Ag
Ogniwo rezerwowe aktywowane gazem - cechą charakterystyczną grupy tych ogniw jest aktywacja polegająca na wprowadzeniu odpowiedniego gazu. Gaz może być substancją czynna elektrody, jak również składnikiem elektrolitu. Do takich układów należą ogniwa aktywowane parami amoniakaln lub gazowym Cl.
(+) PbO2 (lub MnO2) / NH4 CNS, NH3 / Zn (lub Mg, Pb) (-)
(+) Cl2(C) / ZnCl2 / Zn ( lub Mg, Al) (-)
SEM - 2,0 V
Zn + PbO2 + 4NH4 CNS = Zn(CNS)2 + Pb(CNS)2 + 2H2O + 4NH3
Zn + Cl2 = ZnCl2
Ogniwa RODZAJU DRUGIEGO
Substancje czynne elektody +, - (zwanej utleniaczem i paliwem) są gromadzone w ogniwie oddzienie. R. spalania zachodzi oddzielnie następje więc konieczność odprowadzania subst. czynnych do miejsca spalania. Miejsce w którym zachodzi reakcja spalania jest podst. elementem ogniwa paliwowego.
Budowa ogniw paliwowych wymaga specjalnych i coraz to nowych konstrukcji. Każdy materiał konstrukcyjny, każda część składowa podczas działania zużywa się, koroduje, ulega reakcji chemicznej, dlatego też elektrody i materiały konstrukcyjne ogniw paliwowych zmieniają się w czasie.
Trwałość og. paliwowych określa głównie zdolność działania ich elektrod. Sprawność tych ogniw może być b. dobra - pod tym względem wprzedzają one w zasadzie wszystkie pozostałe przetworniki energii i to nie tylko teoretycznie. Sprawność tych ogniw jest prawie niezależna od wymiarów urządzenia.
Konstrukcja ogniw paliwowych jest prosta - nie zawierają one ruchomych, ścierających się części konstrukcyjnych, oprócz urządzeń wprowadzających czynnik roboczy w obieg.
Konstrukcja og. paliwowego jest prosta. Brak ruchomych, konstrukcyjnych (odpornych na ścieranie) elementów, najbardziej wrażliwą częścią ogniwa jest elektroda POROWATA
Klasyfikacja ogniw paliwowych odbywa się wg. temp. działania, jak również wg. jakości elektrolitu. Stosowany elektrolit tych ogniw może być r-rem wodnym, stopioną solą, stałym tlenkiem (o charakterze półprzewodników).
Ogniwa o niskiej temp. posiadają elektrolit sporządzony z r-rów wodnych - ponieważ punkt krzepnięcia i wrzenia elektrolitu określa się odpowiednio dolną i górną granicą zakresu temp. działania, stąd określa sięobszar temp. działania, który uzależniony jest także od subst. czynnej, katalizatorów, materiałów kanstrukcyjnych.
W ogniwach o niskiej temp. działania wyróżniamy dwie podgrupy:
1) podgrupę ogniw pracujących w zwykłej temp. (323-373) K
2) podgrupę ogniw pracujących w średniej temp. (423-523) K
<przewodnictwo elektronowe, dziurowe! powtórzyć!>
Ogniwa o wysokiej temp. zawierają elektrolit ze stopionych soli. Elektrolity ze stopionych soli skł. się z mieszaniny weglanów metali alkalicznych.
W zależności od składu elektrolitu i materiałów konstrukcyjnych ogniwa temperatura działania leży między (873-1173) K. Ten zakres temp. wydziela pierwszą podgrupę. Ogniw paliwowych pracujących w wysokiej temp. (powyżej 1173 K) zawierają stały elektrolit o charakterze półprzewodników. Niektóre stałe tlenki o własnościach półprzewodników powyżej 1173 K są już dobrymi przewodnikami elektrycznymi. Ich materiałem podst jest przeważnie tlenek Zr (cyrkonu) stabilizujący się za pomocą różnych innych tlenków (X, Ca)
Ogniwa galwaniczne - wtórne
Wtórne ogniwo galwaniczne działa podobnie jak ogniwo pierwotne, ale wymaga uprzedniego ładowania (napełnia energię elektryczną), po którym można z niego pobierać energię (wyładować).
Procesy ładowania i wyładowania powtarzać można wielokrotnie. Takie og. nazywami AKUMULATORAMI, czyli ogniwami wymagającymi przed właściwym procesem pracy - AKUMULACJI ENERGII
Akumulator kwasowy
Akumulator kwasowy (ołowiowy) jest niezdatny do dalszego użytkowania po 250-300 cyklach. Reakcje chemiczne zachodzące w czasie pracy akumulatora wywołują zmiany fizykochemiczne w elektrodach..
Zgodnie z teorią podwójnej sulfatacjii r. zachodzące na + i - elektrodach w czasie wyładowania i ładowania akumulatora są następujące
(+) PbO2 + 3H+ + HSO2- PbSO4 + 2H2O
(-) Pb + HSO4- PbSO4 + 2e + H+
PbO2 + Pb + 2H2 SO4 2Pb SO4 + 2 H2O
Zgodniej z teorią podwójnej solfatacji w czasie wyładowania akumulatora na obu elektrodach powstaje siarczan ołowiu (II) na wskutek redukcji PbO2 na elektrodzie - i utleniania Pb na elektrodzie -
Akumulator zasadowy
Akumulator zasadowy odnosi się zazwyczaj do trzech ukł. elektrochemicznych:
- akumulatora kadmowo-niklowego
- akumulatora żelazowo-niklowego
- akumulatora srebrow0-cynkowego
Akumulatory zasadowe charakteryzują sie niższymi (w porównaniu do kwasowych) energiami właściwymi (masy i objętości)
Procesy na elektrodzie elektrodzie tlenku (wodorotlenku) niklowego zachodzą pomiedzy substancjami stałymi, bez uprzedniego przechodzenia jonów niklu do r-ru.
Wdł teorii FOERSTERA proces ładowania i wyładowania jest następujący:
Ni(OH)2 * 2H2O + OH = 0,5 NiO2 * 3H2O + 2H2O + e
2Ni(OH)2 + 2OH = Ni2O3 * 1,5H2O + 1,8H2O + 2e
Ni(OH)2 ∙ 2H2O + OH- ½ NiO2 ∙ 3 H2O + 2H2O + e
- jest to równanie wynikające z obliczeń termodynamicznych
2Ni(OH)2 + 2OH = Ni2O3 * 1,5H2O + 1,8H2O + 2e
równanie stanowiące chemiczną analizę subst tworzących się w czasie ładowania w wyładowania elektrody
W każdym z równań jest inny stopień utlenienia tlenków niklu. Foerster twierdził, że pierwotnymi produktami w procesie ładowania są związki NiO2 ...
przechodzą w Ni2O3 * nH2O a tylko częściow tworzą się z Ni2O3 połączenia o zmiennym sł. chemicznym typu mocnych r-rów.
Badania wykazały, że NiO2 jest bezpostaciowa i nietrwała.
Wyszukiwarka
Podobne podstrony:
Pstrona MO., POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 2, StudiaI
MiBM III, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 3, StudiaIII
Produkcja cegły czerwonej, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Seme
Pytania i odpowiedzi FCS ost, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, S
Bazy Danych wyklady sem III, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Se
TM2.x, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 2, StudiaII cz1,
Zagadnienia Matematyka2, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semest
powierzchniowa, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 3, Stud
notatka, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 2, StudiaII cz
Pstrona MD., POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 2, StudiaI
MiBM III, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr 3, StudiaIII
mechana i mechana doświadczalna - tematy, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - M
Opracowane zagadnienia, POLITECHNIKA ŚLĄSKA Wydział Mechaniczny-Technologiczny - MiBM POLSL, Semestr
więcej podobnych podstron