Protokół z ćwiczenia 5.
Korozja metali I
Wydział Budownictwa, Architektury i Inżynierii Środowiska Budownictwo-Magisterskie |
Piotr Antecki |
Data wykonania ćwiczenia: 16-12-2002 |
Grupa I |
Prowadzący: mgr Aurelia Gałgan |
godz. 9:45 |
PRZEBIEG DOŚWIADCZENIA:
Ćwiczenie składało się z trzech części:
rdzewienie żelaza
Przed doświadczeniem przygotowano płytki ze stali zwykłej(rdzewnej) oraz nierdzewnej przez oczyszczenie papierem ściernym, odtłuszczenie metanolem i osuszenie
Zważono płytki z dokładnością do 0,001 g
Przygotowano 200 ml roztworu o składzie 3 % NaCl i 0,3 % H2O2 przez zmieszanie po 100 ml. 6% NaCl i 0,6% H2O2. Otrzymany roztwór rozlano do dwóch zlewek.
Umieszczono w roztworach na 45 min. płytkę stalową i nierdzewną i prowadzono obserwację
wykonanie tlenowego ogniwa stężeniowego
Oczyszczono i osuszono płytkę ze stali zwykłej
Naniesiono kroplę wskaźnika ferrykslylowego i obserwowano zachodzące zmiany barwy w kropli.
Wyznaczanie potencjałów elektrod (Fel, Cu, Ni, Al )
Po mechanicznym oczyszczeniu i odtłuszczeniu płytek Fe, Cu, Ni, Al zbudowano z nich i z elektrody kalomelowej ogniwo. Zbadano SEM zbudowanych ogniw
Mierzono potencjał co 15 sekund od czasu zanurzenia elektrod w roztworze 3% NaCl w czasie 4 minut.
WYNIKI DOŚWIADZCENIA
a)Doświadczenie miało na celu obserwacje zjawiska korozji metali a dokładniej stali zwykłej i nierdzewnej . Po przygotowaniu płytek zwarzono je o otrzymano następujące wyniki:
Stal zwykła 5,928 g
Stal nierdzewna 14,204 g
Po umieszczeniu płytek w roztworze 3% NaCl i 0,3% H2O2 już po chwili zauważamy na płytce rdzewnej pierwsze zmiany , pierwsze ślady rdzy ((rdzawe zabarwienie płytki) oraz na powierzchni pojawiają się pęcherzyki powietrza . Przez dalszą część doświadczenia płytka dalej korodowała aż po 45 min. praktycznie cała powierzchnia płytki pokryta była rdzą.
Po osuszeniu płytkę zwarzono i okazało się ze jej masa wzrosła o 0,125g do 6,053 g.
W przeciwieństwie do blaszki ze stali zwykłej na blaszce ze stali nierdzewnej nie zaszły praktycznie żadne zmiany (po około 40 pojawiło się kilka pęcherzyków na jej powierzchni).Jej masa nie uległa zmianie po osuszeniu wynosiła 14,204 g.
|
waga przed zanurzeniem do roztworu |
waga po wyjęciu z roztworu |
stal zwykła |
5,928 g |
6,053 g |
stal nierdzewna |
14,204 g |
14,204 g |
b) Po kilku minutach pojawiają się delikatnie zabarwione na niebiesko plamki na środku kropli. Następnie kolor intensywnieje, po czym na obrzeżach kropel pojawia się różowawe zabarwienie (kolor malinowy). Ostatecznie otrzymujemy dwubarwne krople ferroksylowego roztworu: w środku niebieskie a na zewnątrz malinowe.
c) W trzeciej części badaliśmy SEM ogniw. Oto wyniki :
Czas (s) |
Cu |
Al |
Fe |
Ni |
0 |
-0,003 |
0,548 |
0,189 |
0,122 |
15 |
-0,006 |
0,539 |
0,207 |
0,070 |
30 |
-0,008 |
0,539 |
0,210 |
0,054 |
45 |
-0,009 |
0,540 |
0,217 |
0,034 |
60 |
-0,009 |
0,541 |
0,226 |
0,027 |
75 |
-0,010 |
0,542 |
0,234 |
0,013 |
90 |
-0,009 |
0,542 |
0,240 |
0,005 |
105 |
-0,010 |
0,541 |
0,240 |
0,000 |
120 |
-0,010 |
0,543 |
0,252 |
-0,004 |
135 |
-0,010 |
0,543 |
0,257 |
-0,004 |
150 |
-0,010 |
0,543 |
0,261 |
-0,014 |
165 |
-0,010 |
0,543 |
0,265 |
-0,013 |
180 |
-0,010 |
0,543 |
0,269 |
-0,012 |
195 |
-0,010 |
0,543 |
0,272 |
-0,017 |
210 |
-0,010 |
0,544 |
0,275 |
-0,019 |
225 |
-0,009 |
0,544 |
0,278 |
-0,021 |
240 |
-0,009 |
0,543 |
0,281 |
-0,019 |
OPRACOWANIE WYNIKÓW:
a) Płytka ze zwykłej stali w skutek przebywania w agresywnym środowisku - o dużym stężeniu O2 uległa korozji. Zauważalna zmiana masy płytki (przyrost o 0,125 g) wynika z osadzenia się rdzy na powierzchni płytki. Zaszły następujące reakcje:
Na anodzie: Fe→Fe2+ + 2e.
Na katodzie: 2H2O2→2H2O+O2
2H2O +O2+4 e→ 4 OH-
W elktrolicie: NaCl →Na+ + Cl-
W elektrolicia zaszły również reakcje powstawania rdzy:
2OH- + Fe2+ → Fe(OH)2
2Fe(OH)2 + O2 + (n-2)H2O → Fe2O3 . n H2O
Na płytce ze stali nierdzewnej nie zaszły żadne reakcje w wyniku czego jej masa nie zmieniła się.
b) Na płytce, w miejscu, gdzie nanieśliśmy kroplę, powstało ogniwo stężeniowe w skutek czego zaczął przebiegać proces korozji. Na obrzeżach zaszedł proces katodowy:
1/2 O2 + H2O + 2e → 2 OH-
Jony OH- spowodowały malinowe zabarwienie fenoloftaleiny wchodzącej w skład wskaźnika ferroksylowego.
Na anodzie zaszła reakcja:
Fe→Fe2+ + 2e
Z kolei w elektrolicie doszło do wytrącenia rdzy wg reakcji:
2OH- + Fe2+ → Fe(OH)2
2Fe(OH)2 + O2 + (n-2)H2O → Fe2O3 . n H2O
W miejscu, gdzie spotykały się jony Fe2+ i OH- między anodą a katodą w strefie pośredniej strącał się osad, co prowadziło do powstawania zaobserwowanego brunatnego pierścienia.
c) po zestawieniu otrzymanych wyników sporządziłem wykres:
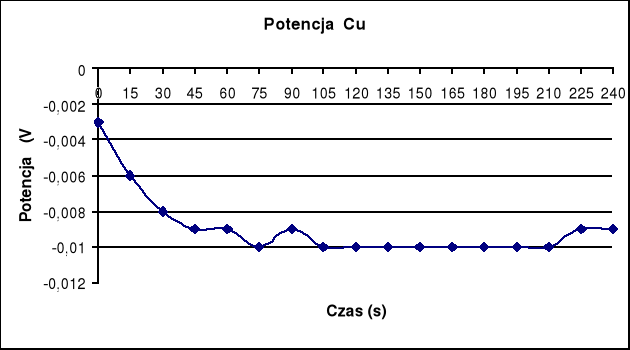
Potencjał Cu
Czas (s) |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
Potencjał |
-0,003 |
-0,006 |
-0,008 |
-0,009 |
-0,009 |
-0,010 |
-0,009 |
-0,010 |
-0,010 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
-0,010 |
-0,010 |
-0,010 |
-0,010 |
-0,010 |
-0,010 |
-0,009 |
-0,009 |
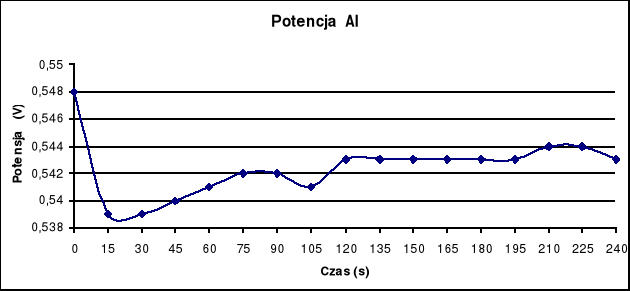
Potencjał Al.
Czas (s) |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
Potencjał |
0,548 |
0,539 |
0,539 |
0,540 |
0,541 |
0,542 |
0,542 |
0,541 |
0,543 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
0,543 |
0,543 |
0,543 |
0,543 |
0,543 |
0,543 |
0,544 |
0,543 |
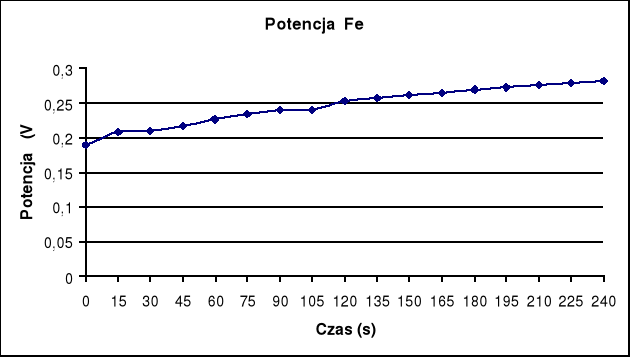
Potencjał Fe
Czas (s) |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
Potencjał |
0,189 |
0,207 |
0,210 |
0,217 |
0,226 |
0,234 |
0,240 |
0,240 |
0,257 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
0,261 |
0,261 |
0,265 |
0,269 |
0,272 |
0,275 |
0,278 |
0,281 |
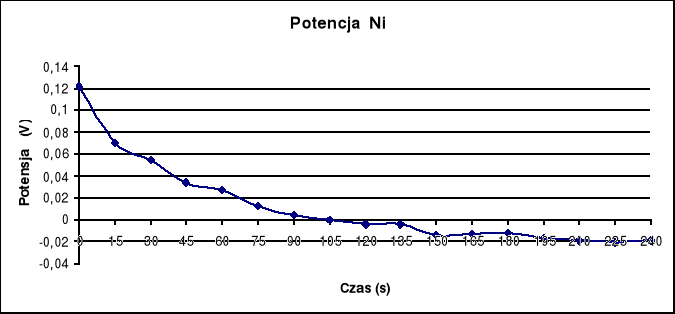
Potencjał Ni
Czas (s) |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
Potencjał |
0,122 |
0,070 |
0,054 |
0,034 |
0,027 |
0,013 |
0,005 |
0,000 |
-0,004 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
-0,004 |
-0,014 |
-0,013 |
-0,012 |
-0,017 |
-0,019 |
-0,021 |
-0,019 |
Średnie wartości SEM otrzymanych w pomiarach :
Cu = -0,009 V
Al = 0,542 V
Fe = 0,245 V
Ni = 0,011 V
Obliczanie potencjałów normalnych metali wzg. elektrody wodorowej otrzymamy wg wzoru
E=E1-E2, E1-potencjał elektrody dodatniej, E2-potencjał elektrody ujemnej .
dla miedzi: elektrodą dodatnią jest elektroda miedziana (wg tablic +340mV), ujemną jest zaś kalomelowa (+249mV)
E = Emiedziana - Ekalomelowa
Emiedziana = Ekalomelowa -(-E) = 249mV - 9 mV = 240mV
dla aluminium: elektrodą dodatnią jest elektroda kalomelowa (+249mV), ujemną jest zaś aluminiowa (wg tablic -166mV)
E = Ekalomelowa - Ealuminiowa
Ealuminiowa = Ekalomelowa - E = 249mV - 542mV = -293mV
dla żelaza: elektrodą dodatnią jest elektroda kalomelowa (+249mV), ujemną jest zaś żelazna (wg tablic -440mV)
E = Ekalomelowa - Eżelazna
Eżelazna = Ekalomelowa - E = 249mV - 245mV= 4 mV
dla niklu: elektrodą dodatnią jest elektroda kalomelowa (+249mV), ujemną jest zaś niklowa (wg tablic -220mV)
E = Ekalomelowa - Eniklowa
Eniklowa = Ekalomelowa - E = 249mV - 11mV = 238 mV
Otrzymane potencjały |
Potencjały z tablic |
|
Cu |
0,24V |
0,34V |
Al |
-0,29V |
-1,66V |
Fe |
0,04V |
-0,44V |
Ni |
0,24V |
-0,22V |
Otrzymane przez nas wyniki znacznie odbiegają od wyników w tablicach . Jest to spowodowane najprawdopodobniej błędnymi pomiarami lub tez wadliwym sprzętem pomiarowym.
Wyszukiwarka
Podobne podstrony:
Protokół z ćwiczenia nr 3, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.labo
Protokół z ćwiczenia 12, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.labork
sprawozdanie cwiczenia 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
Hydroliza soli i pH roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.
więcej podobnych podstron