Zaprawy wiążące
Poprzez zaprawy wiążące rozumiemy spoiwa, uzyskane z materiałów, które po zmieszaniu tworzą masę plastyczną, która po stwardnieniu wykazuje zdolność do spajania ze sobą różnych materiałów.
Wyróżniamy zaprawy:
powietrzne
plastyczne
Zaprawy powietrzne to zaprawy twardniejące na powietrzu i nie odporne na działanie wody. Do najważniejszych zaliczamy wapno. Wapno palone CaO otrzymuje się przez termiczny rozkład wapieni w temperaturze 900 - 1100oC.
CaCO3 → CaO + CO2
Wapno gaszone Ca(OH)2 otrzymujemy w wyniku działania wody na wapno palone.
CaO + H2O → Ca(OH)2
Z wapna gaszonego wytwarza się zaprawę murarską złożoną z 1 części obj. wapna i 3-6 części piasku i wody. Piasek ma za zadanie zwiększyć porowatość zaprawy i zapobiec skurczom podczas wysychania zaprawy. Proces wiązania i twardnienia zaprawy ilustruje reakcja.
Ca(OH)2 + CO2 = CaCO3 + H2O + 3,81 ∗ 104y / mol (9,1 kcal/mol)
Do sporządzania zaprawy stosuje się również wapno hydrauliczne, czyli stały wodorotlenek wapnia w postaci sproszkowanej.
Do zapraw powietrznych zaliczyć można także gips sztukaterski zawierający głównie półhydrat CaSO4 * 1/2 H2O.
Zaprawy hydrauliczne to zaprawy twardniejące na powietrzu i w wodzie, a po stwardnieniu odporne na działanie wody. Do najważniejszych materiałów spośród spoiw hydraulicznych wyróżniamy cement portlandzki, składający się z wapieni, glin lub mieszaniny tych składników - margli. Zawartość tych składników określają moduły: hydrauliczny, krzemianowy i glinowy.
Podstawowymi składnikami cementu są:
krzemian trójwapniowy - 3CaO ∗ SiO2
krzemian dwuwapniowy - 2CaO ∗ SiO2
glinian trójwapniowy - 3CaO ∗ Al2O3
żelazoglinian czterowapniowy - 4CaO ∗ Al2O3
Wiązanie i twardnienie cementu przebiega w trzech zasadniczych etapach:
Uwodnienie (hydratacja) różnych soli
Hydroliza - uzyskuje się zasadę wapniową oraz słabe kwasy
Krystalizacja nowych soli
Fizyczne zjawiska towarzyszące wiązaniu i twardnieniu cementu wyjaśnia teoria A.A. Bajkowa: wg. niej rozróżniamy trzy stadia; stadium rozpuszczania, koloidacji i krystalizacji. Wiązanie cementu jest procesem egzotermicznym. Istnieje kilka odmian cementu portlandzkiego. Najważniejsze z nich to cement boksytowy i żużlowy. Cement znajduje szerokie zastosowanie w budownictwie; poprzez zmieszanie go z wodą i kruszywem otrzymuje się materiał budowlany zwany betonem. Uzbrojenie cementu prętami stalowymi daje tzw. żelazobeton łączący wytrzymałość betonu na ściskanie z wytrzymałością stali na rozciąganie. Natomiast dodanie do zaprawy środków gazotwórczych powoduje powstanie tzw. gazobetonu charakteryzującego się 2-3 razy mniejszym ciężarem właściwym od ciężaru cegły.
Ćwiczenie 1
Oznaczenie zawartości wolnego CaO w cemencie.
1 g. wysuszonego cementu wsypano do kolby Erlenmeyera. Następnie do niej wlano 80 cm3 zagotowanej wody destylowanej i 40 cm3 roztworu HCl. Całość gotowano przez ok. 3 min. celem odpędzenia CO2. Następnie dodano 3-5 kropel 1% r-ru fenoloftaleiny i miareczkowano roztworem KOH do wystąpienia barwy różowej. Część HCl przereagowała z CaO wg. reakcji:
CaO + 2HCl = CaCl2 + H2O
Część kwasu, który nie przereagował z CaO oznaczono przez miareczkowanie KOH. Wyniki doświadczenia ujęto w tabelce 1.
Procentową zawartość CaCO w próbce można również obliczyć wg wzoru:
%CaO = (40 - a) * 1.4
%CaO = (40 - 28) * 1.4
%CaO = 16.8
gdzie: a - ilość cm3 KOH, zużyta na zobojętnienie nadmiaru HCl, który nie przereagował z wolnym CaO
(40 - a) - ilość cm3 HCl, która przereagowała z wolnym CaO
Tab.1.
Nr. oznaczenia |
Ilość cm3 0.5 M |
Ilość HCl reagująca z CaO |
Zawartość CaO w próbce |
|||
|
HCl |
KOH |
cm3 0.5 M roztworu |
g |
g |
g |
1 |
40 |
28 |
12 |
0.02328 |
0.168 |
16.8 |
Ćwiczenie 2
Oznaczenie zawartości niedopału w wapnie palonym.
Niedopał - ta część węglanu wapnia CaCO3, która podczas prażenia wapienia nie uległa rozkładowi na CaO i CO2. Doświadczenie przeprowadzono na aparacie do analizy gazometrycznej.
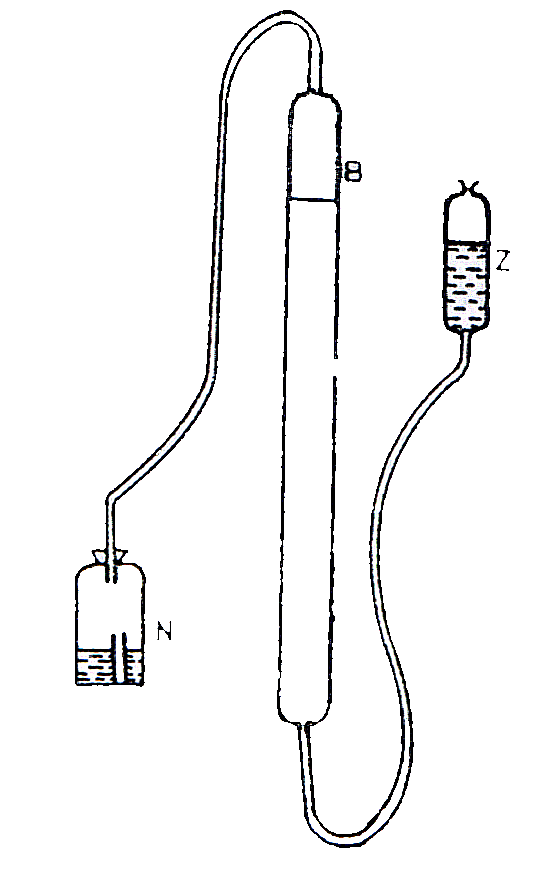
Rys 1. Aparat do analizy gazometrycznej
B - kalibrowana biureta
Z - zbiornik wyrównawczy
N - naczynie reakcyjne - zamknięte korkiem
Do naczynia wlano 25 cm3 HCl i umieszczono w nim probówkę z polistyrenu w której znajdował się 1 g wapna palonego i ołowiany ciężarek. Poprzez poruszenie naczyniem N zainicjowano reakcję HCl z próbką (wapno). Wydzielił się CO2, który zwiększył objętość gazu w biurecie. Po 15 minutach zmierzono obj. gazu w biurecie. Ponadto odczytano temp. otoczenia (t) i ciśnienie barometryczne (b). Prężność pary wodnej (f) nad roztworem NaCl odczytano z tabeli. Objętość (V) wydzielonego CO2 przy temp. t i ciśn. b oraz prężność pary f nad roztworem NaCl w biurecie zredukowano do objętości V0 posługując się wzorem:
![]()
![]()
![]()
![]()
8.974 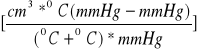
Procentową zawartość CO2 w wapnie palonym oblicza się ze wzoru:![]()
![]()
![]()
![]()
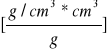
gdzie: n - ciężar badanej próbki wapna palonego w g.
0.0019768 g/cm3 - ciężar właściwy CO2 w warunkach normalnych.
Wyniki doświadczenia ujęto w tabeli 2.
Tab.2.
Nr próbki
|
1
|
|
Masa próbki (g) |
1 |
|
Temperatura otoczenia t(0C) |
20 |
|
Ciśnienie barometryczne b(mmHg) |
745 |
|
Prężność pary H2O przy temp. t f (mmHg) |
13.0 |
|
b-f (mmHg) |
732 |
|
Objętość gazu w biurecie |
przed reakcją V1 (cm3) |
15 |
|
po reakcji V2 (cm3) |
25 |
|
różnica V2-V1 V (cm3) |
10 |
Objętość CO2 w war. Norm. V0 (cm3) |
8.974 |
|
Zawartość w probówce |
% CO2 |
0.01773 |
-1-
Wyszukiwarka
Podobne podstrony:
chemia zaprawy wiążące bzyk
chemia zaprawy wiążące
Korozja metali, Energetyka, Chemia
Adsorpcja, Energetyka, Chemia
Sprawozdanie chemia, WAT, I sem. Energetyka, Chemia, Chemia
Lepkość, Energetyka, Chemia
Chromatografia, Energetyka, Chemia
laborki pytania, WAT, I sem. Energetyka, Chemia, Chemia
Terminy ćwiczeń laboratoryjnych jesień2011, WAT, I sem. Energetyka, Chemia, Chemia
Elektrocheamia, Energetyka, Chemia
Hydroliza, Energetyka, Chemia
Miareczkowanie, Energetyka, Chemia
Korozja metali, Energetyka, Chemia
Adsorpcja, Energetyka, Chemia
metody otrzymywania soli, ENERGETYKA AGH, sem 2, chemia
Pomiar pH. hydroliza soli, Energetyka, I rok, chemia
Analiza ilościowa-objętościowe oznaczanie kwasów i zasad, Energetyka, I rok, chemia
więcej podobnych podstron