Elektrochemia - Przepływowi prądu elektrycznego przez przewodnik drugiego rodzaju (elektrolit) towarzyszą przemiany chemiczne objęte ogólną nazwą elektrolizy. Podstawą ich jest zjawisko dysocjacji elektrolitycznej, to znaczy rozszczepiania pewnej części cząsteczek rozpuszczonych w cieczy na jony dodatnie (kationy) i ujemne (aniony). W solach i zasadach kationami są jony metali, w kwasach - jony wodoru. Anionami zaś są: w solach i kwasach jony reszty kwasowej, w zasadach - jony grupy (OH)-. Pod wpływem różnicy potencjałów między zanurzoną w elektrolicie elektrodą dodatnią (anodą) i elektrodą ujemną (katodą), kationy dążą do katody, aniony zaś - do anody. Na katodzie kationy metalu odzyskują brakujące im elektrony, w wyniku czego osadzają się na niej jako cząsteczki metali. Aniony natomiast wchodzą zwykle jeszcze w reakcję chemiczną z kationami elektrolitu, w wyniku której tworzą się cząsteczki kwasu lub wody oraz powstają cząsteczki gazu (zwykle tlenu), który wydobywa się na zewnątrz. Aby aniony elektrolitu nie wchodziły w· reakcję z materiałem anody, ta ostatnia jest zwykle wykonana z węgla.
Ćwiczenie 1
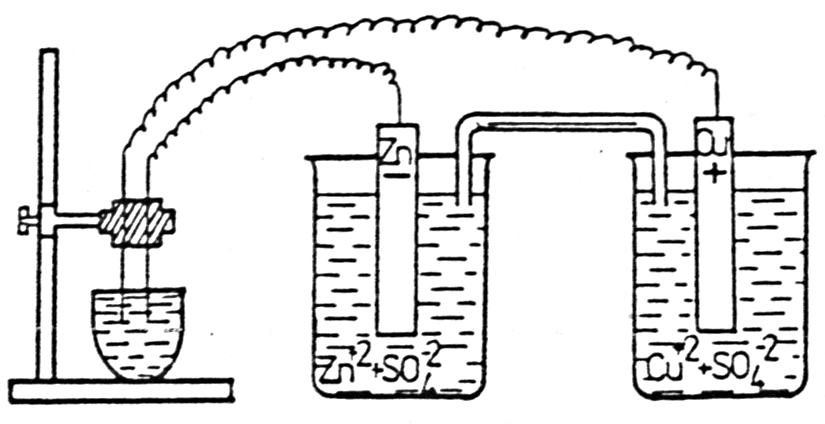
Wykonanie ogniwa dwumetalicznego
Rys.1. SCHEMAT OGNIWA GALWANICZNEGO
Powyższy rysunek ilustruje doświadczenie, które polega na umieszczeniu płytki cynkowej w zlewce z ZnSO4 i płytki miedzianej w zlewce z CuSO4. Następnie roztwory należy połączyć kluczem elektrolitycznym napełnionym KCl. Następnie końce przewodów przymocowanych do płytek należy zanurzyć w tygielku wypełnionym roztworem Na2SO4. Do tygielka dodać należy kilka kropel fenoloftaleiny.
Wynikiem doświadczenia było pojawienie się różowego zabarwienia w pobliżu przewodu połączonego z płytką Zn. Świadczy to o tworzeniu się NaOH w wyniku elektrolizy Na2SO4. Wynika stąd, że płytka Zn jest ujemną elektrodą ogniwa galwanicznego.
Ćwiczenie 2
Elektrolityczne powlekanie miedzią.
Przed przystąpieniem do doświadczenia dwie płytki miedziane (katodę i anodę) dokładnie oczyszczono i zważono na wadze analitycznej. Następnie przygotowano roztwór CuSO4 zakwaszony H2SO4. Płytki zamocowano na uchwytach elektrolizera i umieszczono w przygotowanym roztworze. Elektrolizer uruchomiono na 10 min. przy natężeniu prądu 2 A. Po zakończeniu elektrolizy płytki wysuszono i ponownie zważono. Wyniki pomiarów są zamieszczone w tabeli 1.
Tab.1.
Waga katody przed elektrolizą |
Waga katody po elektrolizie |
Przyrost masy katody |
Waga anody przed elektrolizą |
Waga anody po elektrolizie |
Ubytek masy anody |
60,5340 g |
60,1214 g |
0,4126 g |
72,5688 g |
72,1414 g |
0,5726 g |
Uzyskane laboratoryjnie wyniki można skonfrontować z wartościami teoretycznymi, wyliczonymi z I prawa Faradaya.
m = k * I * t - postać I pr. Faraydaya
gdzie:
k - równoważnik (dla Cu k=31,78)
I - natężenie prądu
t - czas
m = 31,78 amp.sek. * 600 s. * 2 A
m = 38136 mg
Wnioski:
Nieścisłość jaka wyniknęła w próbie laboratoryjnej pomiędzy przyrostem masy katody a ubytkiem masy anody wyniknęła z niedoskonałości przeprowadzonej próby. Nieprecyzyjne wykonanie doświadczenia spowodowało powstanie różnicy mas.
Natomiast niezgodność wartości teoretycznych a otrzymanych laboratoryjnie również wynika częściowo z powyższego wniosku, a także z faktu, iż wynik obliczeń teoretycznych rzadko pokrywa się z wynikami otrzymanymi na drodze laboratoryjnej.
- 1 -
Wyszukiwarka
Podobne podstrony:
Korozja elektrochemiczna, Energetyka, I rok, chemia
ROZWI ZANIA KONSTRUKCYJNE E, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, Energetyka
Korozja metali, Energetyka, Chemia
Adsorpcja, Energetyka, Chemia
222222222, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, Energetyka
nie ważne jest ustalenie odbiorników I kategorii i dopuszcza, SGSP, SGSP, cz.1, elektroenergetyka, e
Kotłownia elektryczna, Energetyka, Surowce energetyczne
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
Kolokwium I nieorganiczna- elektrochemia, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMI
Urządzenia z osłoną olejową Exo, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
Instalacja elektryczna obiektach budowlanych, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, Energ
Cw nr 1a z energetyki, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, Energetyka
Lista5 2011L, Polibuda, Studia II stopnia, Semestr I, Maszyny elektryczne w energetyce
ZALICZENIE LABORKI MASZYNY ELEKTRYCZNE, Energetyka Politechnika Krakowska Wydział Mechaniczny I stop
17.Elektryczność statyczna, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
Energetyka, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, dyskietka do elektry
13. urządzenia grzejne, SGSP, SGSP, cz.1, elektroenergetyka, energetyka, elektra na egzamin
więcej podobnych podstron