Budowa związków kompleksowych
Określenie: „kompleks” odnosi się do cząsteczek lub jonów, w których z atomem >A< związane są inne atomy >B< lub grupy atomów >C< w liczbie (zwykle) przewyższającej wartościowość atomu >A<.
Atom >A< nazywany jest „rdzeniem” lub „atomem centralnym”.
Atomy >B< lub grupy >C< nazywane są „ligandami”.
Cały zespół jednego lub kilku atomów centralnych i związanych z nimi ligandów nazywa się „jednostką koordynacyjną” lub „kompleksem”.
Kompleks może być:
1) kationem
np.: [Cr(H2O)6]3+ kation h e k s a a k w a c h r o m u (III)
[Al(OH)(H2O)5]2+ kation p e n t a a k w a h y d r o k s o g l i n u
2) anionem
np.: [Fe(CN)6]3- anion h e k s a c y j a n o ż e l a z i a n o w y (III)
[Fe(CN)6]4- anion h e k s a c y j a n o ż e l a z i a n o w y (II)
3) obojętną cząsteczką
np.: [Co(NO2)3(NH3)3] t r i a m i n a t r i n i t r o k o b a l t (III)
[Fe(CO)5] p e n t a k a r b o n y l ż e l a z o (0)
Liczba koordynacyjna
Każdy atom centralny ma charakterystyczną „liczbę koordynacji” („liczbę koordynacyjną”) czyli tzw. „ligandowość”, która jest liczbą atomów bezpośrednio z nim związanych.
W najczęściej spotykanych kompleksach liczba koordynacyjna (LK) jest następująca:
jeżeli centralny jest atom metalu jednowartościowego, to zwykle LK = 2 np. [Ag(CN)2]-
jeżeli centralny jest atom metalu dwuwartościowego, to zwykle LK = 4 np. [Cu(NH3)4]2+
jeżeli centralny jest atom metalu trójwartościowego, to zwykle LK = 6 np. [Al(H2O)6]3+
Przestrzenna budowa kompleksów
W przypadku najprostszych kompleksów:
jeżeli LK = 2, to struktura przyjmuje kształt liniowy:
L O L
jeżeli LK = 4, to kompleks przyjmuje kształt płaskiego kwadratu lub czworościanu:
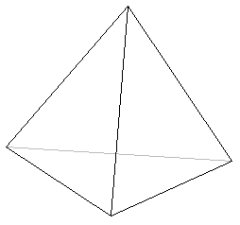
L L
lub
L L
jeżeli LK = 6, to kształt bipiramidy tetragonalnej czyli ośmiościanu:
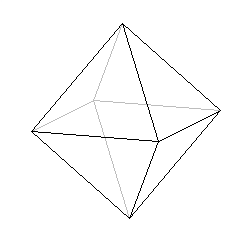
Wzory kompleksów
We wzorach kompleksów umieszcza się:
jako pierwszy symbol pierwiastka atomu centralnego,
w drugiej kolejności wymienia się (symbolami lub wzorami) jonowe ligandy,
następnie ligandy neutralne.
Wzór całego kompleksu zamyka się w nawiasy kwadratowe.
Jeżeli w skład kompleksu wchodzi większa ilość ligandów i to w różnych klasach (kationowe, anionowe, obojętne), to kolejność w każdej klasie ligandów powinna być alfabetyczna wg. symboli pierwiastków, których atomy związane są bezpośrednio z atomem centralnym.
Przykłady wzorów kompleksów:
[CoCl(NH3)5]2+ atom centralny: Co (dokładnie: Co3+);
ligand jonowy: Cl− ;
ligand obojętny: NH3
[Fe(CN)5CO]2− atom centralny: Fe (dokładnie: Fe3+);
ligand jonowy: CN− ;
ligand obojętny: CO
[Co(CN)(CO)2 (NO)] − atom centralny: Co (na zerowym stopniu utlenienia);
ligand jonowy: CN− ;
ligandy obojętne: CO i NO (alfabetycznie: C przed N)
Nazwy kompleksów
W nazwach kompleksów:
nazwę pierwiastka stanowiącego atom centralny umieszcza się za nazwami ligandów wymienionych alfabetycznie;
stosuje się liczebniki: di, tri, tetra, penta, heksa itd. jeżeli ligand występuje odpowiednio dwu-, trzy-, cztero-, pięcio- lub sześciokrotnie w danym kompleksie;
nazwy ligandów tworzy się następująco:
a) cząsteczki obojętne nazywa się następująco:
H2O akwa NH3 amina
CO karbonyl NO nitrozyl
b) nazwę liganda anionowego tworzy się dodając na końcu literę „o”, do nazwy soli
zawierającej taki anion:
![]()
siarczano („siarczan” + „o”)
S2O32- tiosiarczano („tiosiarczan” + „o”)
![]()
wodorosiarczano („wodorosiarczan” + „o”)
C2O42− szczawiano („szczawian” + „o”)
C4H6O42− winiano („winian” + „o”)
podobnie:
C6H5− fenylo („fenyl” + „o”)
stosuje się także nazwy:
OH− hydrokso Cl− chloro
CN− cyjano O2− okso
SCN− tiocyjaniano S2− tio
(tradycyjnie: rodano) H− hydrydo
NO2− nitro
(azotyno, azotano(III))
c) ligandy kationowe występują niezmiernie rzadko, w nietypowych przypadkach
Przykłady nazw kompleksów:
kation pentaaminachlorokobaltu(III)
w nazwie tej:
liczebnik „penta”,
kolejność nazw ligandów alfabetyczna: „amina” przed „chloro”,
atom centralny: kobalt(III) tzn. Co3+,
końcówka nazwy w dopełniaczu według ogólniejszej reguły budowania nazw kationów (kation czego?);
anion pentacyjanokarbonylożelazianowy(III)
w nazwie tej:
liczebnik „penta”,
kolejność alfabetyczna nazw ligandów: „cyjano” przed „karbonyl”(łącznik gramatyczny „o”),
atom centralny: żelazo(III) tzn. Fe3+
końcówka „-owy” według ogólniejszej reguły budowania nazw anionów
(anion jaki? np.. „azot” - „azotanowy”, więc „żelazo” - „żelazianowy”)
anion cyjanodikarbonylonitrozylokobaltanowy(0)
w nazwie tej:
.......................... (uzupełnij samodzielnie)
Tworzenie kompleksów
Kompleksy powstają ze związków prostych, w wyniku przyłączenia jonów lub cząsteczek obecnych w środowisku reakcji, do atomów (metali) w innym związku. Połączenie następuje na zasadzie tworzenia wiązań koordynacyjnych (tj. donorowo-akceptorowych), dzięki obecności wolnych par elektronowych w wiążącym atomie liganda - ten atom liganda jest donorem, a atom centralny (metal), w pierwotnym związku prostym jest akceptorem pary elektronowej tworzącej nowe wiązanie.
Tendencję do tworzenia kompleksów wykazują głównie metale grup pobocznych tj. bloku d.
Przykłady:
chrom |
(Cr) |
[Cr(NH3)6]3+ |
[Cr(OH)4]- |
[Cr(OH)6]3- |
mangan |
(Mn) |
[Mn(CN)6]3- |
[Mn(CN)6]4- |
[Mn(CN)6]5- |
żelazo |
(Fe) |
[Fe(CN)6]3- |
[Fe(CN)6]4- |
[FeF6]3+ |
kobalt |
(Co) |
[Co(NH3)6]3+ |
[Co(NH3)4(H2O)2]3+ |
[Co(NO2)4(NH3)]- |
nikiel |
(Ni) |
[Ni(NH3)4]2+ |
[Ni(CO)4] |
[Ni(H2O)6]2+ |
miedź |
(Cu) |
[Cu(NH3)4]2+ |
[Cu(CN)2 ]- |
[CuCl2(H2O)2] |
srebro |
(Ag) |
[Ag(NH3)2]+ |
[Ag(CN)2]- |
[Ag(S2O3)2]2- |
złoto |
(Au) |
[Au(CN)4]- |
[AuCl4]- |
|
cynk |
(Zn) |
[Zn(OH)4]- |
[Zn(NH3)4]2+ |
|
kadm |
(Cd) |
[CdCl6]4- |
|
|
rtęć |
(Hg) |
[HgCl4]2- |
|
|
platyna |
(Pt) |
[PtCl6]2- |
[PtCl3(NH3)3] |
|
i inne.
Kompleksy tworzą także niektóre metale grup głównych (bloku p lub także s):
glin |
(Al) |
[Al(OH)4]- |
[Al(OH)6]3- |
[Al(OH)2(H2O)4]+ |
beryl |
(Be) |
[Be(OH)4]2- |
|
|
cyna |
(Sn) |
[Sn(OH)3]- |
|
|
ołów |
(Pb) |
[Pb(OH)3]- |
|
|
arsen |
(As) |
[As(OH)4]- |
|
|
i inne.
Kompleksy chelatowe
Niektóre cząsteczki, zawierające więcej niż jedną, wolną parę elektronów, mogą wiązać się z atomem centralnym więcej niż jednym wiązaniem koordynacyjnym. Takie ligandy nazywane są „chelatowymi” lub „kleszczowymi”, a związki takie nazywa się „chelatami”, „związkami chelatowymi” lub „związkami kleszczowymi”.
Na przykład EDTA czyli kwas etylenodiaminatetraoctowy (skrót od nazwy angielskiej), nazwywany także „kwasem wersenowym”. Związek ten (oraz jego sole - „werseniany”) znajduje bardzo istotne zastosowanie w analityce chemicznej. Strukturę tej substancji można przedstawić następująco:
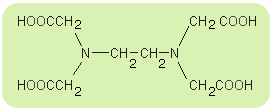
Związek ten tworzy chelatowe struktury kompleksowe jako ligand:
- sześciokleszczowy: 2 x para elektronów przy atomie azotu oraz
4 x para elektronów przy atomie tlenu z grupy -OH,
- dwukleszczowy: tylko 2 x para elektronów przy atomie azotu.
Roztwory kompleksów
Wiele kompleksów o charakterze soli dobrze rozpuszcza się w wodzie (często lepiej niż proste sole, z których kompleks powstaje). W roztworze wodnym związki takie dysocjują na jony kompleksowe. Takie, złożone jony zwykle są bardzo trwałe.
Roztwory związków kompleksowych, tj. zawierające jony kompleksowe, mają często wyraźną, charakterystyczną barwę.
Przykłady:
[Co(NH3)6]Cl3 ![]()
[Co(NH3)6]3+ + 3 Cl- roztwór o barwie żółtej
[CoCl(NH3)5]Cl2 ![]()
[CoCl(NH3)5]2+ + 2 Cl- roztwór o barwie purpurowoczerwonej
[Cu(H2O)4]Cl2 ![]()
[Cu(H2O)4]2+ + Cl- roztwór o barwie niebieskiej
Trwałość kompleksów
Struktury kompleksowe tj. związki lub jony w roztworach wodnych na ogół dysocjują tylko w nieznacznym stopniu.
Na przykład proces:
[Ag(CN)2]- ⇄ Ag+ + CN-
przebiega tylko ze znikomo małą wydajnością co oznacza, że praktycznie nie ma w roztworze jonów Ag+ i CN-.
Reakcję tworzenia kompleksu można przedstawić schematycznie:
M + n L ⇄ MLn
M - atom centralny (metal) L - ligand MLn - kompleks
Jest to proces równowagowy, podlega prawu działania mas i stąd stała równowagi reakcji tworzenia kompleksu, nazywana „stałą trwałości”:
K1 = β = ![]()
Dla reakcji odwrotnej tj. rozpadu (dysocjacji) kompleksu:
MLn ⇄ M + n L
definiuje się „stałą nietrwałości”:
K2 = ![]()
= 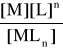
Stałe te charakteryzują każdy kompleks. Na przykład im wartość stałej nietrwałości jest mniejsza, tym trwalszy jest kompleks.
W praktyce podaje się wartość stałej nietrwałości kompleksu w formie:
pK2 = − log10(K2) = − log10(![]()
)
im większa jest wartość pK2, tym trwalszy jest kompleks.
W trakcie tworzenia się kompleksów następuje często podstawianie jednych ligandów innymi tj. o mniejszej stałej nietrwałości. Tworzą się w ten sposób kompleksy trwalsze.
Przykład:
[Ag(NH3)2]+ K2 = ![]()
= 9,3⋅10-8 pK2 = 7,03
[Ag(S2O3)2]3- K2 = ![]()
= 3,5⋅10-14 pK2 = 13,46
oznacza to, że po wprowadzeniu jonów tiosiarczanowych do amoniakalnego roztworu jonów srebra utworzy się tiosiarczanokompleks srebra.
Zadania
Sformułuj nazwy kompleksów: anionowych, kationowych, obojętnych, których wzory podano w niniejszym opracowaniu.
Zapisz wzory i podaj nazwy soli potasowych zawierających aniony kompleksowe oraz wodorotlenków zawierających kompleksowe kationy wykorzystując przykłady jonowych kompleksów podanych w niniejszym opracowaniu.
Napisz wzory kompleksów, których wzory podano w niniejszym opracowaniu.
Określ stopnie utlenienia pierwiastków w podanych kompleksach.
Zapisz równanie reakcji tworzenia kompleksu (kompleksowania), którego stała trwałości opisana jest zależnością:
β = 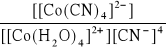
Zapisz wyrażenie opisujące stałą nietrwałości (

) kompleksu powstającego w reakcji:
[Cu(H2O)4]2+ + 2 Br− ⇄ [CuBr2(H2O)2]
6
Wyszukiwarka
Podobne podstrony:
zad. kompleksowanie, chemia, szkolka
ćw.1 kompleksy, Chemia ogólna i żywności, instrukcje do ćwiczen z chemii ogólnej i żywności na I sem
sprawozdanie kompleksy, Chemia Medyczna, Chemia fizyczna
kompleksy, chemia(1)
W18S-kompleksy, chemia, szkolka
Sprawozdanie 3 Związki kompleksowe, Chemia Medyczna, Laboratorium
kompleksy, chemia nieorganiczna
badanie właściwości redoks kompleksów Fe, chemia nieorganiczna, laboratorium, Chemia nieorganiczna
Kompleksy i elektrochemia notatka, ~FARMACJA, I rok, CHEMIA OGÓLNA I NIEORGANICZNA, Chemia końcowy z
ŚCIĄGA - CHEMIA - KOMPLEKSOMETRIA+Twardość wody, KOMPLEKSOMETRIA
ŚCIĄGA - CHEMIA - KOMPLEKSOMETRIA+Twardość wody, KOMPLEKSOMETRIA
Chemia Analityczna kompleksometria (zagadnienia) i
sprawko z kompleksy I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
Związki kompleksowe, AGH różne, chemia wykłady
Kompleksometria, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
KOMPLEKSOMETRIA- PRZYKŁADOWE ZADANIA (wersja zminimalizowana), studia, chemia analityczna, komplekso
Precypitometria i kompleksometria (1), rok numero deux, chemia analityczna, I semestr
Cw9 Reakcje kompleksowania II, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
Cw8 Reakcje kompleksowania I, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna
więcej podobnych podstron