Wyznaczanie granicznego przewodnictwa równoważnikowego elektrolitów mocnych i słabych |
|
|
Marcin Górski |
Data: |
|
Mirosław Dziergowski |
Zaliczenie: |
|
Cel ćwiczenia.
Celem ćwiczenia jest wyznaczenie granicznych przewodnictw elektrolitów mocnych i słabych.
Zasada pomiaru.
Graniczne przewodnictwo równoważnikowe elektrolitów mocnych można wyznaczyć w oparciu o zależność:
,gdzie:
- przewodnictwo równoważnikowe,
- przewodnictwo równoważnikowe graniczne,
a - stała,
c - stężenie elektrolitu.
Pomiar przewodnictwa elektrolitów wykonuje się metodą Kohlrauscha, która polega na wyzna-czeniu oporu naczynka przy użyciu mostka Wheatstone'a.
Pomiar składa się z dwóch części. W pierwszej z nich wyznacza się tzw. s t a ł ą n a c z y n k a (k). W tym celu wprowadza się roztwór KCl o znanym przewodnictwie właściwym w żądanej temperaturze do naczynka pomiarowego. Pomiar daje opór cieczy wzorcowej, skąd można wyz-naczyć stałą naczynka.
W obliczeniach szczególnie dla roztworów o małym przewodnictwie, należy uwzględnić przewod-nictwo wody użytej do przygotowania roztworów (wynika to z dysocjacji wody, rozpuszczenia dwutlenku węgla, wymycia alkaliów ze szkła).
W analogiczny sposób należy zmierzyć przewodnictwo roztworów: CH3COONa, HCl, NaCl.
Schemat urządzenia pomiarowego.
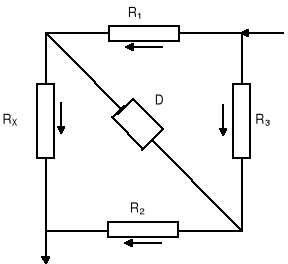
Wyniki pomiarów.
T = 25oC k = 0,528
Stężenie |
CH3COONa |
HCl |
NaCl |
||||||
|
G [Ω-1] |
κ [Ω-1⋅cm-1] |
Λ [Ω-1⋅cm2⋅ g-równ.-1] |
G [Ω-1] |
κ [Ω-1⋅cm-1] |
Λ [Ω-1⋅cm2⋅ g-równ.-1] |
G [Ω-1] |
κ [Ω-1⋅cm-1] |
Λ [Ω-1⋅cm2⋅ g-równ.-1] |
3,125⋅10-3 |
6,9⋅10-4 |
3,62⋅10-4 |
115,960 |
2,5⋅10-3 |
1,32⋅10-3 |
421,750 |
8⋅10-4 |
4,20⋅10-4 |
134,544 |
6,25⋅10-3 |
1,27⋅10-3 |
6,69⋅10-4 |
106,974 |
5,23⋅10-3 |
2,76⋅10-3 |
441,484 |
1,44⋅10-3 |
7,58⋅10-4 |
121,334 |
1,25⋅10-2 |
2,38⋅10-3 |
1,25⋅10-3 |
100,369 |
1,015⋅10-2 |
5,36⋅10-3 |
428,544 |
2,75⋅10-3 |
1,45⋅10-3 |
115,996 |
2,5⋅10-2 |
4,12⋅10-3 |
2,17⋅10-3 |
86,930 |
2,005⋅10-2 |
1,058⋅10-2 |
423,341 |
5,21⋅10-3 |
2,75⋅10-3 |
109,948 |
5⋅10-2 |
6,16⋅10-3 |
3,25⋅10-3 |
65,005 |
3,75⋅10-2 |
1,98⋅10-2 |
395,925 |
9,85⋅10-3 |
5,19⋅10-3 |
103,968 |
10-1 |
1,32⋅10-2 |
6,97⋅10-3 |
69,670 |
7,4⋅10-2 |
3,91⋅10-2 |
390,665 |
1,945⋅10-2 |
1,02⋅10-2 |
102,667 |
Obliczenia.
1. Obliczenie stałej naczynka oraz przewodnictwa właściwego i równoważnikowego badanych elektrolitów.
Stałą naczynka (k) wyznaczamy wg. zależności:
,gdzie
κwz - przewodnictwo właściwe 0,01M roztworu KCl w temp. 25oC
Gwz - przewodnictwo roztworu KCl
Gwody - przewodnictwo wody destylowanej użytej do przygotowania roztworów.
Przewodnictwo właściwe (κ) i przewodnictwo równoważnikowe (Λ) obliczamy we wzorów:
(1)
(2)
,gdzie κ - przewodnictwo właściwe
k - stała naczynka
G - przewodnictwo roztworu
Gwody - przewodnictwo wody destylowanej użytej do przygotowania roztworów.
Λ - przewodnictwo równoważnikowe
Crówn. - stężenie wyrażone w gramorównoważnikach [g-równ./cm3].
Obliczenia przykładowe (dla roztworu CH3COONa).
Dane |
||
Stała naczynka |
k |
5,28⋅10-1 |
Przewodnictwo wł. KCl |
κ |
1,413⋅10-3 |
Przewodnictwo H2O |
Gwody |
3,62⋅10-6 |
Z zależności (1) obliczamy κ:
dla C = 3,125⋅10-3 κ = 5,28⋅10-1⋅(6,90⋅10-4 - 3,62⋅10-6) = 3,62⋅10-4 [Ω-1⋅cm-1].
dla C = 6,25⋅10-3 κ = 5,28⋅10-1⋅(1,27⋅10-3 - 3,62⋅10-6) = 6,69⋅10-4 [Ω-1⋅cm-1].
dla C = 1,25⋅10-2 κ = 5,28⋅10-1⋅(2,38⋅10-3 - 3,62⋅10-6) = 1,25⋅10-3 [Ω-1⋅cm-1].
dla C = 2,5⋅10-2 κ = 5,28⋅10-1⋅(4,12⋅10-3 - 3,62⋅10-6) = 2,17⋅10-3 [Ω-1⋅cm-1].
dla C = 5⋅10-2 κ = 5,28⋅10-1⋅(6,16⋅10-3 - 3,62⋅10-6) = 3,25⋅10-3 [Ω-1⋅cm-1].
dla C = 10-1 κ = 5,28⋅10-1⋅(1,32⋅10-2 - 3,62⋅10-6) = 6,97⋅10-3 [Ω-1⋅cm-1].
Przeliczenie stężenia molowego na równoważnikowe:
Zgodnie ze wzorem:
1 mol CH3COONa posiada masę molową 82 [g/mol], czyli 1 g-równ. tego związku będzie posia-dał taką samą masę molową jaką posiada 1 mol.
Z zależności (2) obliczamy Λ:
dla C = 3,125⋅10-3 Λ=
dla C = 6,25⋅10-3 Λ=
dla C = 1,25⋅10-2 Λ=
dla C = 2,5⋅10-2 Λ=
dla C = 5⋅10-2 Λ=
dla C = 10-1 Λ=
Dla elektrolitów HCl i NaCl obliczamy κ z zależności (1) i Λ z zależności (2) w analogiczny spo-sób jak wyżej.
2. Obliczenie granicznego przewodnictwa równoważnikowego dla kwasu octowego (CH3COOH).
Ponieważ kwas octowy jest słabym elektrolitem nie można, więc wyznaczyć graficznie dla niego przewodnictwa równoważnikowego granicznego, gdyż w tym przedziale stężeń wykres nie będzie liniowy. Aby obliczyć Λ∞ CH3COOH wykorzystamy wcześniej wyznaczone doświadczalnie przewodnictwa równoważnikowe graniczne mocnych elektrolitów (CH3COONa, HCl, NaCl).
Zgodnie z prawem niezależnej wędrówki jonów, graniczne przewodnictwo równoważnikowe dla kwasu octowego można zapisać wzorem:
Elektrolity mocne można zapisać:
Dodatkowo znając przewodnictwo równ. graniczne dla NaCl można obliczyć Λ∞ CH3COOH z zależności
Dane: |
|
Elektrolit |
Λ∞ |
CH3COONa |
96,119 |
HCl |
423,811 |
NaCl |
123,085 |
Niektóre równoważnikowe przewodnictwa jonowe w rozcieńczeniu niekończenie wielkim w temperaturze 25oC. |
||
H+ |
349,7 |
|
Na+ |
50,1 |
|
Cl- |
76,6 |
|
CH3COO- |
40,8 |
|
|
||
Elektrolit |
Λ∞ |
Λ∞ |
|
Wartość obliczona w t = 25oC |
Wartość tablicowa w t = 25oC |
CH3COONa |
96,119 |
90,9 |
HCl |
423,811 |
426,3 |
NaCl |
123,085 |
126,7 |
CH3COOH |
396,845 |
390,5 |
VI. Wnioski.
Zarówno przewodnictwo równoważnikowe Λ, jak i przewodnictwo właściwe κ zależą w dużej mierze od stężenia i temperatury.
Badając zależność przewodnictwa właściwego od stężenia elektrolitu mocnego można wysnuć wniosek, że przewodnictwo właściwe rośnie ze wzrostem stężenia. Wzrost ten wywołany być może zwiększeniem liczby jonów będących nośnikami prądu elektycznego. Wielkości te nie są jednak do siebie wprost proporcjonalne. Przewodnictwo właściwe rośnie bowiem wolnej niż stężenie.
Przyczyną zmniejszania się przewodnictwa równoważnikowego mocnych elektrolitów wraz ze wzrostem stężenia jest nie tylko siła wynikająca z istnienia spadku potencjału pomiędzy elektroda-mi, ale również inne siły hamujące ruch jonów.
Te siły hamujące ruchy jonów można wyjaśnić za pomocą teorii Debye'a i Hueckela. Założeniem tej teorii (w przypadku mocnych elektrolitów o małych stężeniach) jest tworzenie się chmur elektronowych w roztworze co powoduje obniżenie przewodnictwa, w stosunku do tego, które byłoby, gdyby jony zachowywały pełną indywidualność i swobodę. Natomiast w przypadku mocnych elektolitów w roztworach bardziej stężonych skutkiem zmniejszania się przewodnictwa jest występowanie tzw. efektu relaksacyjnego i elektroforetycznego. Efekt elektroforetyczny, polega na tym, że jon centralny porusza się wraz ze swoją otoczką dipoli wodnych w środowisku, które nie znajduje się w stanie spoczynku. Ponieważ w chmurze jonowej znajdują się przeważnie jony przeciwnego znaku niż znak jonu centralnego, to poruszają się one wraz ze swoimi otoczkami dipoli wodnych w przeciwnym kierunku niż rozpatrywany jon. Na skutek tego dochodzi do wystąpienia dodatkowych sił tarcia. Natomiast drugi efekt, efekt relaksacyjny jest procesem tworzenia się chmury jonowej i jej zanikania pod wpływem ruchu jonów. Gdy prędkość tworzenia się tej chmury jonowej i prędkość jej zanikania są nieskończenie duże wówczas prowadzi to do zburzenia symetrii chmury, jej średnia gęstość ładunku zmniejsza się przed jonem, a zwiększa za nim. W związku z tym chmura jonowa zaczyna wywierać wpływ elektrostatyczny hamujący i jest on tym większy im większa jest prędkość poruszającego się jonu.
Schemat mostka Wheatstone'a
R1 R2 R3 RX - opory
D - detektor
Wyszukiwarka
Podobne podstrony:
61 881 892 Evaluation of PVD Coatings for Industrial Applications
20030831190201id#881 Nieznany
04 92 881
881
042 USTAWA o wyrobach budowlanych [D U 04 92 881]
880 881
881
881
04 92 881
ploch 881
881
04 92 881 O WYROBACH BUDOWLANYCH
881
881
881
881
II DWK 12 Preludium i fuga f moll nr 12 BWV 881
ploch 881
więcej podobnych podstron