Koszt inkrementalny = 
Władysław Grześkiewicz
Wykorzystanie analiz ekonomicznych do oceny programu zdrowotnego
1. Rodzaje analiz farmakoekonomicznych
W Polsce i wielu krajach rosną koszty świadczeń medycznych, na wzrost których istotny wpływ ma przede wszystkim rozwój drogich technologii medycznych. Zmiany demograficzne, skutkując wydłużeniem się życia ludzkiego, a leczenie chorób związanych ze starością jest szczególnie kosztowne. Na wpływ kosztów istotny wpływ ma świadomość i rosną oczekiwania społeczne.
Wzrost wydatków na ochronę zdrowia na przełomie lat 70 i 80 XX wieku spowodował potrzebę dokonania oceny ekonomicznej programów zdrowotnych. Zastosowanie oceny ekonomicznej wynikało z dysproporcji wydatków na opiekę zdrowotną przy ograniczoności zasobów jakimi dane państwo dysponuje i jest w stanie na nią przeznaczyć. Czynnikiem, który znacząco przyczynia się do wzrostu kosztów leczenia szpitalnego jest farmakoterapia, polegająca na użyciu leków. Szpitale są kategoria zakładów opieki zdrowotnej zużywających najwięcej leków, gdyż farmakoterapię bezpośrednią stosuje się systematycznie. Problem wzrostu wydatków na leki staje się coraz bardziej dotkliwy, gdyż wydatki te rosną szybciej niż zasoby finansowe społeczeństwa.
Na początku lat 70 ubiegłego wieku wyodrębniła się nowa dyscyplina nauki - farmakoekonomika, której głównym celem jest ekonomiczna ocena produktów farmaceutycznych, koncentrowanie się na analizie pomiędzy kosztami a wynikami alternatywnych metod leczenia.
Farmakoekonomika nie jest nauką o oszczędzaniu, ale o racjonalnym wykorzystaniu środków w ochronie zdrowia.
Według M.F. Drummonda „Analiza ekonomiczna”, w ochronie zdrowia to analiza porównawcza alternatywnych sposobów postępowania/podejmowania decyzji/ pod względem zarówno kosztów jak i konsekwencji. Obecnie do oceny ekonomicznej programów zdrowotnych (inaczej analizie farmakoekonomicznej lub farmakoekonomice) wykorzystywane są następujące rodzaje analiz:
1) analiza minimalizacji kosztów (cost-minimalisation analysis - CMA),
2) analiza efektywności kosztów (cost-effctiones analysis - CEA ),
3) analiza kosztów korzyści (cost-benefit analysis - CBA ),
4) analiza użyteczności kosztów (cost-utility analysis - CUA),
analiza kosztów i konsekwencji choroby (cost-conseguence analysis - CCA).
Przedstawione analizy można podzieli na dwie grupy. Pierwszą grupę stanowią analizy powalające ocenić, które z porównywalnych programów zdrowotnych są bardziej opłacalne. Pozwalają udzielić odpowiedzi na pytanie: jaki jest najlepszy sposób wykorzystania posiadanych zasobów? Do grupy tej należy analiza efektywności kosztów oraz jej odmiany jaką jest - analiza minimalizacji kosztów i analiza użyteczności kosztów. Do drugiej grupy zalicza się jedynie analiza kosztów korzyści, która dostarcza informacji o tym, który program jest bardziej opłacalny, ale także powala ocenić wartość danych programów.
Analiza minimalizacji kosztów pozwala na porównanie kosztów technologii medycznych, uznanych za identyczne pod względem wyników klinicznych. Umożliwia określenie najmniej kosztownego spośród dwóch lub więcej alternatywnych programów, których wynik zdrowotny jest taki sam. Analiza efektywności kosztów pozwala na porównanie kosztów procedur medycznych wyrażonych w jednostkach pieniężnych z efektami klinicznymi, wyrażonymi w tzw. jednostkach naturalnych (mmHg ciśnienia krwi, mmol/l, poziomu cukru, czasu do wystąpienia bólu itp.). Umożliwia dokonanie porówna zbliżonych, medycznie alternatywnych sposobów postępowania.
Analiza kosztów korzyści, polega na oporowaniu kosztów i korzyści, wyrażonych w jednostkach pieniężnych. Umożliwia porównanie programów zdrowotnych o różnych wynikach i podejmowanie decyzji o alokacji środków na ich realizację. Wynikiem ich może być:
1. stosunek kosztów do korzyści,
korzyść netto, czyli różnica między korzyścią a kosztem danej procedury medycznej.
Analiza użyteczności kosztów, polega na zestawieniu kosztu interwencji medycznej w jednostkach pieniężnych z efektami interwencji, wyrażonymi przeżywalnością powiązaną z jakością życia jednostkach, tj. w latach życia skorygowanych w zależności od jakości życia lub poziomu niesprawności. Jednostki skorygowanych lat życia określają użyteczność terapii.
Analiza kosztów i konsekwencji choroby, jest rodzajem badania, w którym przyjmuje się najmniej założeń, jest najbardziej ogólnym przedstawieniem informacji, opisujących wartość farmakoterapii lub innych sposobów leczenia. Analiza ta polega na określeniu kosztów i przedstawieniu, bez łączenia w jakimkolwiek współczynnik. Koszty i efekty stosowania, np. leku, w porównaniu z jedną lub więcej alternatywami są wymieniane w zdezagregowanej formie, np. koszty leków, koszty pobytu w szpitalu, inne koszty.
Sposób mierzenia korzyści stanowi cechę wyróżniającą różne techniki ewaluacji ekonomicznej. Kiedy korzyści wyrażane są w pieniądzu, z definicji stają się porównywalne z kosztami. Metoda ewaluacji ekonomicznej, w której korzyści wyraża się w ujęciu finansowym , zalicza się do analizy typu koszt -korzyść CBA). Rezerwowany termin CBA jest przez ekonomistów dla analiz, których podstawą stanowi neoklasyczna ekonomia dobrobytu. Jeżeli korzyści nie są wyrażane w kategoriach finansowych mamy do czynienia z rodzajem analizy koszt- efektywność. Istotną grupą analiz z zakresu ekonomiki jest analiza typu koszt - użyteczność, korzyść (nie finansowa) miara indywidualnej użyteczności ze zdrowia. Tabela 1 ilustruje metody, w zależności od tego, czy korzyść wyraża się w pieniądzu, czy też nie oraz czy korzyść określa się na podstawie preferencji konsumenta, czy bez ich uwzględnienia.
Tabela 1. Pomiar technik analiz faramkoekonomicznych
Korzyści oparte na preferencjach |
Korzyści mierzone w kategoriach finansowych |
|
|
Tak |
Nie |
Tak |
CBA |
CEA (CUA) |
Nie |
CBA (ale nie w ujęciu ekonomii dobrobytu) |
CEA |
CBA- analiza koszt-korzyści, CEA - analiza koszt- efektywności, CUA - analiza koszt - użyteczności
Źródło: Dolan P., Olsen A.J., Dystrybucja usług medycznych. Zagadnienia ekonomiczne i etyczne, CeDeWu.Pl, Warszawa 2008, s. 127.
Analiza farmakoekonomiczna ma być pomocna wyborze danej interwencji /programu opieki zdrowotnej, W ujęciu ekonomicznym wykorzystuje się potencjalne kryterium Pareto, które służy do sprawdzenia, czy potencjalne zyski osób którym zastosowano skuteczną interwencję zrekompensują straty osób poszkodowanych.
1.1. Analiza minimalizacji kosztów
Analiza minimalizacji kosztów (CMA) przeprowadzana jest wtedy, gdy alternatywne programy zdrowotne mogą dać taki sam wynik zdrowotny i porównanie ich ograniczone jest tylko do analizy kosztów, np. do kosztów pośrednich medycznych. Podejmujący decyzję wybierają program, którego całkowity koszt jest najniższy, zapewnia to najlepsze wykorzystanie zasobów finansowych.
Zabieg chirurgiczny, który tradycyjne wykonywany jest w szpitalu i wymaga długiej hospitalizacji, można bez pogorszenia wyniku zdrowotnego zastąpić zabiegami ambulatoryjnymi. Analizę minimalizacji kosztów stosuje się najczęściej w przypadku leków o tej samej skuteczności, ale różnym sposobie dawkowania. Wyniki przeprowadzonej analizy kosztów przygotowania chorych do przeszczepu szpiku kostnego leczonych busulfanem oraz ich terapia treosolfanem ilustruje tabela 2.
Z danych przedstawionych wynika, iż pomimo wyższych kosztów leczenia treosulfanem od busulfanem łączne koszty hospitacji chorego są niższe. Omawianej analizie czyniony jest jednak zarzut, iż est ona wykonywana w szpitalach dość powierzchownie. Ogranicza się do zastosowania najtańszych leków w leczeniu danej choroby. Nie uwzględnia wszystkich kosztów choroby pacjenta. Powoduje do generowanie dalszych kosztów w szpitalu lub leczeniu poszpitalnym.
Tabela 2. Analiza kosztów przygotowania chorych do przeszczepu szpiku kostnego otrzymujących cyklofoslamid z busulfanem lub treosulfanem
Analizowany parametr |
busulfan |
Treosulfan |
Średni czas hospitacji |
70 |
53 |
Rekonstrukcja granulopoezy > 0,5 G/1 (doba po przeszczepie) |
16 |
19 |
Rekonstrukcja płtykotworzenia > 20 G/l (doba po przeszczepie) |
18 |
25 |
Czas trwania powikłań zakaźnych (dni) |
13 |
9 |
Liczba chorych wymagających odżywiania pozajelitowego |
4 |
1 |
Całkowity koszt leczenia (zł) |
31.557,78 |
40.777,90 |
Koszty leczenia wspomagającego (zł) |
31.087,38 |
26.481,00 |
Koszty antybioterapii (zł) |
15.613,34 |
12.962,04 |
Koszty antybioterapii doustnej (zł) |
821,33 |
674,55 |
Koszty antybioterapii dożylnej (zł) |
14.792,01 |
12.228,41 |
Źródło: Jankowiak-Gracz, L. Gil, I. Kołodziej, M. Komornicki, Badania farmakologiczne w farmacji onkologicznej, Farmacja Polska 2005, Nr 2(61), s.103.
1.2. Analiza efektywności kosztów
Analiza efektywności kosztów (CEA) (dawniej nazywanej koszty -efektywność) jest analizą, w ramach której dokonuje się pełnej oceny ekonomicznej, w której bada się koszty jak i konsekwencje porównywanych programów zdrowotnych. Warunkiem umożliwiającym przeprowadzenie analizy jest zastosowanie dla porównanie programów zdrowotnych, tej samej jednostki pomiaru wyniku. W analizie efektywności kosztów wyniku przedstawiane są w jednostkach naturalnych, np. wyliczenie, zyskane lata życia, czas wolny od objawów choroby, czy bardzie specyficzne dla danej choroby sposoby wyrażania wyniku, np. liczba napadów bólów głowy w przypadku leczenia migreny. Warunkiem wykorzystania przedmiotowej analizy jest wyrażanie wyników zdrowotnych w takich samych jednostkach naturalnych, np. w dniach albo w latach. Efekty programów zdrowotnych są zdrowotne i ekonomiczne. Efektami zdrowotnymi są np. zmiany w śmiertelności, chorobowości i jakości życia, efektami ekonomicznymi są, np. oszczędności wynikające ze zmniejszenia kosztów choroby lub straty spowodowane przez niepożądane działania zastosowania niepożądanych programów. Pomiar efektów zdrowotnych i ekonomicznych najbardziej wyrazisty jest przez porównanie z alternatywa „nieliczenia”. Wyniki analizy koszty -efektywność są prezentowane w postaci współczynnika koszty/efektywność, który pokazuje, np. ile kosztuje uzyskanie 1 roku życia, uratowanie życia 1 pacjenta , lub w postaci współczynnika efektywność/koszty, który przedstawia, ile efektu można uzyskać za jednostkę kosztu (wydania 1PLN). W omawianej analizie przy porównaniu programów zdrowotnych wykorzystywana jest ocena tzw. kosztu dodatkowego jednostki efektu (ICER -Incremental Cost/Effetiveness Ratio), tj. różnicy kosztów porównywalnych programów /różnica wyników porównywalnych programów, znanych w ekonomii pod nazwą kosztów marginalnych. W ramach tej metody dokonywania wyboru przedsięwzięcia w opiece zdrowotnej dokonuje się na podstawie:
porównania średnich kosztów jednej jednostki uzyskanego efektu:
na podstawie kosztów krańcowych (inkrementalnych),
Założenie:
Koszt programu „A” > Koszt programu „B”
Efekty programu „A” > Efektu programu „B”
to:
Koszt inkrementalny = 
Założenie:
Koszt programu „B” > Koszt programu „A”
Efekty programu „B” > Efektu programu „A”
Koszt inkrementalny = 
Przykładowa analizę koszty-efekty ilustruje tabela 3.
Z przedstawionych danych wynika, iż wyboru należy dokonać między lekiem B a lekiem C, gdyż one charakteryzują się najniższym wskaźnikiem efektywności kosztowej. Z kolei, uwzględniając koszt dodatkowej jednostki efektu, czyli koszt uratowania dodatkowego życia dokonujemy porównania poniesionych kosztów i uzyskanych efektów, czyli tzw. inkrementalnego współczynnika efektywności kosztów (20.000 -9.000): (5-3) = 5.500.
Tabela 3. Analiza efektywności kosztowej 3 leków ratujących życie
Lek |
Koszt leczenia 100 pacjentów |
Uratowanie życia na 100 leczonych pacjentów |
Wskaźnik efektywności kosztowej |
A |
35.000 PLN |
1 |
35.000 |
B |
9.000 PLN |
3 |
3.000 |
C |
20.000 PLN |
5 |
4.000 |
Źródło: R. Niżankowski i inni, Analiza opłacalności, Uniwersytecie Wydawnictwo Medyczne „VESALIUS”, Kraków 2002, s.25.
Jeżeli u 100 pacjentów zastosowujemy lek C zamiast leku B, wówczas można ocalić 2 dodatkowe życia, a koszt uratowania dodatkowego życia wyniesie -5.500 PLN. Decyzja będzie należeć do dysponenta środków.
Przykładem analizy efektywności kosztów może być przeprowadzone w Polsce przez E. Orlewską i zespół porównanie kosztów i efektów stosowania heparyny drobnocząstkowej(enoksparyny) i heparyny niefrakcjonowanej (HNF) w ostrych zespołach wieńcowych. Dane o wynikach i kosztach badań kliniczno-ekonomicznych ilustruje tabela 4 i 5. Z przedstawionych danych wynika, ze stosowanie enoksaparyny pozwala zaoszczędzić w przypadku jednego pacjenta 12 zł, ale równocześnie zmniejsza prawdopodobieństwo wystąpienia zdarzenia krańcowego (zgon, zawał czy nawrót choroby wieńcowej).
Tabela 4. Koszt poszczególnych typów procedur wykonania w grupie chorych przyjętych z powodu ostrego zespołu wieńcowego leczonych enosparyną lub INF.
Zastosowane leczenie |
Koszty (w zł) |
Niefrakcjonowana heparyna (60.000 j.m.) |
7,34 |
Enoksaparyna (80 mg co 12 godz. przez 2,6 dni) |
130,5 |
APTT |
8 |
Koronografia |
900 |
Przezskóna angioplastyka naczyń wieńcowych |
5.000,00 |
Pomostowanie aortalno-wieńcowe |
6.500,00 |
Leczenie chorego z niestabilną dusznicą bolesną lub zawałem mięśnia sercowego bez załamka Q (bez enoksaparyny, HNF, zabiegów rewaskalarazycyjnych) |
682,00 |
Leczenie chorego z zawałem mięśnia sercowego (bez zabiegów rewaskularyzacyjnych) |
1.756,00 |
Leczenie chorego z niestabilna dusznicą bolesną (bez zabiegów rewaskularyzacyjnych) |
824,00 |
Źródło: za J. Stępniewski (red.n.), Strategia, finanse i koszty szpitala, ABC a Wolters Kluwer busness, Warszawa 2008, s. 357.
\
Tabela 5. Wyniki analizy farmaoekonomicznej leczenia enoksparyną lub HNF chorych przyjętych do szpitala z powodu ostrego zespołu wieńcowego
Analizowany parametr |
Grupa |
Wynik |
Średni koszt leczenia 1 pacjenta |
Chorzy leczeni enoksparyną |
1 085,00 zł |
|
Chorzy leczeni HNF |
1 097,00 zł |
Prawdopodobieństwo wystąpienia zdarzenia końcowego |
Chorzy leczeni enoksparyną |
0,2 |
|
Chorzy leczeni HNF |
0,23 |
Źródło: Jak w tabeli 4, s. 357.
Wykonanie tego typu analizy powala pozwala dać odpowiedź na pytanie, kiedy omawiane alternatywne sposoby leczenia stan się sobie równorzędne pow względem kosztowym.
1.3. Analiza kosztów korzyści
W analizie kosztów korzyści (CBA) zarówno koszt postępowania, jak i wynik są wyrażone w jednostkach monetarnych. Wyniki alternatywnych sposobów leczenia powikłań, przeliczane są na jednostki pieniężne. Korzyści w analizie wydajności kosztów można wyodrębnić na:
1. bezpośrednie, część wydatków na opiekę zdrowotną, których udało się uniknąć przez wdrożenie danego programu,
2. pośrednie, potencjalny wzrost zarobków lub produktywności, który nie byłby możliwy bez realizacji danego programu,
niewymierne, poprawa stanu zdrowia, zmniejszenie bólu,
W ramach dokonywanej metody można wyodrębnić jako obszar analizy:
- korzyści dla osoby chorej,
- korzyści prywatne, w odniesieniu do osób z ryzykiem zachorowania,
- korzyści społeczne.
Do charakterystyki zależności między korzyściami i kosztami można wykorzystać wskaźniki:
- współczynnik korzyści/ koszty - iloraz całkowity korzyści i całkowitych kosztów,
- wartość korzyści netto - różnicę całkowitych korzyści i całkowitych kosztów,
- wewnętrzną stopę zysku (rentowności) - procentowy stosunek korzyści netto do całkowitego kosztu.
Porównując dwa programy, należy brać pod uwagę nie tylko wartość obliczonych współczynników, ale także bezwzględny wynik monetarny kosztów i korzyści. Analiza korzyści kosztów (inaczej koszty-korzyści) nie może być jedyną metodą oceny ekonomicznej programów zdrowotnych. W literaturze przedmiotu wskazuje się, że analiza kosztów i korzyści może być pomocna do oceny efektywności programów:
- szczepień przeciw grypie lub wirusowym zapaleniu wątroby typu B,
- leczeniu nadciśnienia w wybranej grupie populacji w celu zapobiegania zawałom serca.
W ramach tej metody za wskazaną jest, gdy zachodzi relacja w ramach, której
Korzyści netto > Korzyści - Koszty
Wskaźnik = Koszty > 1
kosztów korzyści Korzyści
W ramach analizy kosztów i efektów wyniki porównywalnych programów wyrażane są w kategoriach opisowych, np.: ilości uratowanych lat życia, ilości uratowanych osób, zaoszczędzonych dni kalectwa.
Metoda kosztów korzyści pojawiła się w farmakologii stosunkowo niedawno i jest uznawana jako metoda eksperymentalna. W celu jej uwiarygodnienia jest niezbędne porównanie kosztów otrzymanych tym sposobem z rzeczywistymi transakcjami płatniczymi. Ponadto budzi kontrowersje z punktu widzenia etycznego ze względu na wycenę wyników zdrowotnych w wyrażeniu finansowym.
1.4. Analiza użyteczności kosztów
Analiza użyteczności kosztów (CUA), dawniej nazywaną analizą koszty-użyteczność) jest najstarszą metoda oceny farmakologicznej, pierwowzorem której jest analizą kosztów i korzyści z projektów inwestycyjnych. Służy temu porównanie wartości wszystkich zużytych przy realizacji programu zdrowotnego zasobów (kosztów) z wartością wyników (korzyści) tego programu. W analizie kosztów korzyści koszty jak i wyniki muszą być wyrażone w jednostkach monetarnych. W praktyce wyliczenie korzyści w jednostkach monetarnych jest bardzo utrudnione, np. gdy korzyścią jest uratowanie życia ludzkiego, zmniejszenie bólu, zwiększenie komfortu życia chorego.
Analiza kosztów i użyteczności, ta metoda porównuje wyniki programów wyrażonych w jednostkach użyteczności (satysfakcji) najczęściej w jednostkach „QALY”- lata życia skorygowane jakością (Quality-Adjusted Life Years) określają wskaźnik życia, przypisując mu wielkość między 0,00 (gdy następuje zgon) a 1,0 (gdy pacjent cieszy się dobrym zdrowiem). Jednostka QALY może być zastosowana na poziomie oceny jakości usług zdrowotnych świadczonych przez poszczególne instytucje medyczne. Na poziomie makro, w celu tworzenia polityki zdrowotnej oraz alokacji zasobów stosowana jest jednostka DALY.
W ramach wskaźnika QALY można wyróżnić trzy odrębne strumienie zdrowia. Pierwszy jest strumieniem retrospektywnym, określającym liczbę lat przeżytych przez daną osobę, wyrażony wskaźnikiem jakości życia. Drugi, określany jest jako strumień prospektywnym/ przyszłościowym, wyrażającym liczbę życia ważonych jakością, jakiej dana osoba może oczekiwać bez interwencji opieki medycznej. Trzeci strumień dotyczy przyszłości, po oszacowaniu ilości lat życia ważonych jakością dana osoba może spodziewać się, kiedy skorzysta z interwencji opieki medycznej.
Metody określania QALY dokonuje się poprzez tabele oceniające zdrowie poprzez funkcje: zdolności podróżowania, przymusowe przywiązanie do łóżka. Tabele konstruowane są w skali od „O” (śmierć) i „1” (doskonałe zdrowie). Stan zdrowia po zastosowanym leczeniu można ustalić według opinii lekarzy, pacjentów, rodziny. Wpływu leczenia na poprawę jakości i przedłużenia życia wyrażone w jednostkach QALY obrazuje wykres 1.
Wykres 1. Wpływ leczenia na poprawę jakości i przedłużenia życia wyrażone w jednostkach QALY
Źródło: Dolan P., Olsen A.J., Dystrybucja usług medycznych. Zagadnienia ekonomiczne i etyczne, CeDeWu.Pl., Warszawa 2008, s. 138.
Czas życia oznaczamy odpowiednio symbolem T0 (bez leczenia) i T1 (z leczeniem). Ogólny wzór zwiększenia QALY można zapisać jako:
QALYG = Q1 x T1 - Q0 x T0
gdzie: pierwsza po prawej część równania wyraża oczekiwane efekty zdrowotne (zwiększenie jakości i długości życia) w wyniku leczenia, a drugi składnik wzoru oznacza profil bez leczenia.
Wykres 1 obrazuje wzrost QALY jako zacienione pole, gdzie jakość życia związana jest ze zdrowiem oznaczmy symbolem Q0 w przypadku kiedy nie podjęto leczenia, natomiast w przypadku leczenia - symbolem Q1. Przedstawiony model analizy farmakoekonomiczne dobrze prezentuje się w teorii, ale trudniej uzyskać wiarygodne dane liczbowe, które pozwoliłyby zastosować ten ogólny, ale prosty wzór.
QALY opiera się na (1) liczbie lat zyskanej dzięki danej interwencji medycznej oraz (2) jakości życia uzyskanych lat. Wynik jest uzyskiwany poprzez pomnożenie obu współczynników. Pierwsza zmienna oznacza ilość lat, o które wydłużone zostanie życie pacjenta dzięki danej procedurze (na przykład jeśli będzie to 7 lat, współczynnik ten wyniesie 7). Druga zmienna oznacza subiektywne odczucie satysfakcji z życia w skali od 0 (śmierć) do 1 (pełne zdrowie). Uwzględnia ona w sposób spójny status zdrowotny, psychospołeczny oraz socjologiczny badanej osoby. Uzyskuje się ją pytając pacjenta na ile lat życia w pełnym zdrowiu zamieniłby 10 lat życia przy obecnym stanie zdrowia? Przykładowo, jeśli osoba sparaliżowana wolałaby żyć 1 rok w całkowitym zdrowiu (zamiast 10 lat przy obecnym stanie zdrowia) to stan zdrowia ma dla niej wartość 0,1.
Wydłużenie życia chorego o 6 lat przy jego wartości 0,3 daje zysk 1,8 QALY (6*0,3). Warto zauważyć, że wydłużając życie o mniejszą ilość lat, ale za to bardziej poprawiając jego jakość można uzyskać wyższy wskaźnik QALY. Jest to sposób umożliwiający porównywanie różnych procedur medycznych. W ramach tej analizy wybierane są te przedsięwzięcie, które ma najniższe koszty na jedno uzyskane QALY:
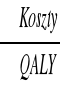
lub na podstawie analizy inkrementalnej (ile kosztuje każda dodatkowa jednostka
QALY uzyskana droższym programem.
Przykładem analizy może być wykonana przez E. Orlewską i zespół porównanie kosztów i efektów leczenia postmenopauzalnej osteroporozy kalcytoniną łososiową, alleodroniem i raioksylenem w grupie kobiet w wieku 60-70 lat. Wyniki powyższej analizy ilustruje tabela 6.
Tabela 6. Wyniki analizy użyteczności kosztów leczenia postmenopauzalnej osteroporozy kalcytoniną łososiową, alleodroniem i raioksylenem w grupie kobiet w wieku 60-70 lat
Sposób leczenia |
Koszt leczenia na 1 pacjentkę (w zł) |
Wynik (QALY) |
Kalcytonina |
12.229,60 |
16,21 |
Alendromian |
5.745,1 |
16,23 |
Raloksylen |
8.608,90 |
16,35 |
Źródło: Jak w tabeli 411., s. 360.
Analiza przedstawionych danych pokazuje, że terapia kalcytonamina jest zarówno najdroższą jak i najmniej efektywną (najniższy wynik QALY leczenia). W przypadku analizy użyteczności kosztów głównym problemem jest prawidłowe oszacowanie QALY, praktyce jest trudne, pracochłonne, a w przypadku braku danych wręcz niemożliwe.
1.5. Analiza kosztów i konsekwencji choroby
Analiza kosztów konsekwencji choroby (CCA) jest najprostszą w formie, ale i jednocześnie najbardziej wszechstronną prezentacją informacji dotyczących farmakologii lub innych interwencji medycznych. Program zdrowotny o najniższych kosztach jest realizowany. Metoda ta ma ograniczone zastosowanie gdyż rzadko osiągane są przez porównanie programy kliniczne równoważne efekty. Istotą analizy jest analiza kosztów i konsekwencji choroby. W metodzie tej dokonuje się określenia wysokości kosztów jak i następstwa porównywalnych programów zdrowotnych w postaci listy. Ma to ułatwić podjecie decyzji, nie wyznacza jednak systemu wartościowania, a podejmujący decyzje musi stworzyć własna listę wartościowania. Prawidłowe sporządzenie analizy kosztów i konsekwencji choroby jest niezbędne do przeprowadzenia pozostałych typów analiz kosztów choroby. W ramach analizy kosztów danej jednostki chorobowej nie uwzględnia się wyników klinicznych terapii. Może być wykorzystywana jako źródło informacji dotyczących, miedzy innymi:
1. obciążenia finansowego związanego z daną chorobą,
2. uświadomienia znaczenia ekonomicznego danych jednostek chorobowych,
pozwalających określić priorytety badawcze,
3. identyfikacji najbardziej znaczących elementów kosztów danej choroby.
Obecnie wyróżnia się dwa modele analizy kosztów choroby:
model oparty na rozpowszechnieniu - analizuje się koszty związane z dana jednostką chorobową, które zostają poniesione w analizowanym roku.
model oparty na zapadalności - analizuje się koszty choroby w ciągu całego życia osób, u których w danym roku rozpoznano chorobę. Metoda ta informuje o wydatkach, które zostaną poniesione w przyszłości i dlatego może być wykorzystana na przykład przy ocenie wartości programów zapobiegawczych i podejmowaniu decyzji z nimi związanymi.
W analizie kosztów choroby jest kwestia prawidłowego oszacowania kosztów utraconej produktywności. Do tego celu można wykorzystać jedną z metod jaką jest:
metoda kapitału ludzkiego, w ramach której przyjmuje się, że dana praca w ogóle nie zostanie wykonana, w związku z czym wartość uzyskanego wyniku często jest zawyżana, np. nie brana jest pod uwagę możliwość wykonania danej czynności przez kogoś innego lub w późniejszym terminie, po powrocie chorego do zdrowia,
metoda kosztów frykcyjnych, w ramach której podstawą jest założenie, że wartość utraconej produktywności jest zależna od czasu potrzebnego do przywrócenia wyjściowego stanu.
Przykłady analizy kosztów konsekwencji choroby ilustruje tabela 7, w której przedstawione zostały dane o kosztach bezpośrednich, pośrednich i wynikach zdrowotnych w sposób umożliwiający podjecie decyzji.
W analizie kosztów konkurencji zużyte zasoby, wyniki zdrowotne są oszacowane i przedstawione tabeli. Korzystający z analizy może wybrać interesujące go elementy kosztów i konsekwencji i wykorzystać do oceny wartości danego programu. Analiza kosztów i konsekwencji choroby przedstawiając wpływ nowego programu możliwie wszechstronnie umożliwia podejmującemu decyzję ocenę programu. Wada jednak tej metody jest to, ze nie wszystkie dane sa porównywalne pod względem jakości.
Tabela 7. Zestawienie analizy kosztów i konsekwencji choroby
Przedmiot badania |
Koszty medyczne |
Koszty pośrednie |
Wyniki |
Jakość życia |
Subopulacja |
szczepienie przeciwko ospie wietrznej |
leczenie ambulatoryjne, szpitalne, intensywna opieka medyczna, szczepionka |
nieobecność w pracy opiekunów |
Przypadki ospy powietrznej, powikłania |
- |
dzieci |
profilaktyka przeciwbakteryjna pacjentów operowanych |
leki, leczenie ambulatoryjne, ponowna hospitacja |
- |
zakażenie, drenaż ran, nawroty |
- |
pacjenci, u których wykonano operacje sutki lub operacje przepukliny |
profilaktyka choroby wieńcowej u chorych z nadciśnieniem tętniczym |
leki |
- |
ciśnienie tętnicze krwi, częstość odstawiania leku, działania niepożądane |
ocena jakości życia dokonana przez pacjentów |
pacjenci łagodnym lub umiarkowanym nadciśnieniem tętniczym |
leczenie chorych z zakażaniem HIV |
leczenie ambulatoryjne, szpitalne, leki |
Nieobecność w pracy, utrata zarobków |
dni z objawami choroby, dni spędzone w łóżku z powodu objawów choroby |
ocena jakości życia dokonana przez pacjentów |
zakażeni HIV |
leczenie schizofrenii |
intensywna opieka medyczna, hospitalizacja |
- |
obciążenie dla opiekunów, psychoterapia |
ocena jakości życia dokonana przez pacjentów |
chorzy na schizofrenię |
Źródło: E. Orlewska, Podstawy farmakoekonomiki, Vademecum Farmakoekonomiki UNIMED 1999, s. 104.
2. Uwagi końcowe
Rozważania na temat uzyskiwanych korzyści i poniesionych wydatków na program zdrowotny tak jak i daną dziedzinie aktywności gospodarczej napotyka w empirycznej analizie na istotne problemy. Dotyczą one metody pomiaru badanego zjawiska, zbierania danych i interpretacji wyników. Dodatkowe trudności ze stosowaniem rachunku korzyści (efektów) uzyskanych w wyniku usługi zdrowotnej wynikają stąd, że wytwarzanie usług i ich użycie pokrywa się w czasie. W analizie usług zdrowotnych istotną barierą będzie zdefiniowanie ewentualnych korzyści uzyskanych w wyniku usługi medycznej i nadanie określonej wartości w wyrażeniu finansowym czy wymiarze poprawy zdrowia.
Istotą prezentowanych analiz farmakoekonomicznych jest porównanie rezultatów procedur medycznych z ich kosztami. O ile koszty liczone są w nich w podobny sposób, to pomiar i wycena rezultatów programów ochrony zdrowia, czyli korzyści są różne. Metodologia analiz ekonomicznych powinna mieć na względzie wypracowane wytyczne dobrej praktyki farmakekonomicznej, którymi są:
cel i zastosowanie badań farnakoekonomicznych oraz ich status,
metodykę badań farmakoekonomicznych,
zasady etyczne obowiązujace przy przeprowadzaniu i publikowaniu badań farmakoekonomicznych.
Stanowią one w pewnym stopniu ochronę przed nieprawidłowym prowadzeniem oraz co się wiąże nieprawidłową interpretacją badań farmakoekonomicznych.
Wytyczne przeprowadzania analiz farmakologicznych powinny uwzględniać:
wytyczne formalne, opracowane w krajach, w których przeprowadzanie analiz farmakologicznych, w przypadku ubiegania się o refundacje leku jest obowiązkowe,
wytyczne nieformalne, opracowane w krajach, w których przeprowadzenie analiz farmakoekonomicznych, w przypadku ubiegania się o refundację danego leku jest nieobowiązkowe, ale zalecane,
wytyczne naukowe, opracowywane w celu poprawy jakości oraz dyskusji na temat metody badań farmakoekonomicznych.
Streszczenie
Celem artykułu jest zapoznanie czytelnika z programami realizowanymi w ramach farmakoekonomiki, dyscypliny będącej częścią ekonomiki zdrowia. Istotą farmakoekonomiki jest analiz kosztów i korzyści przy ocenie poszczególnych programów zdrowotnych z zastosowaniem leków. Znajomość tych zagadnień pozwala nie tylko ocenić efektywność określonych terapii i procedur medycznych w wymiarze finansowym, ale także umożliwia ich bezpośrednie porównanie ze sobą. Wiedza ta daje decydentom zajmujących się opieką zdrowotną narzędzie do podejmowania decyzji odpowiedzialnej i efektywnej polityki zdrowotnej.
Bibliografia:
Dolan P., Olsen A.J., Dystrybucja usług medycznych. Zagadnienia ekonomiczne i etyczne, CeDeWu.Pl, Warszawa 2008.
Drummond M., O'Brien B., Stodidart G.,TorranceG.W., Metody badań ekonomicznych programów ochrony zdrowia, VM Media, Gdańsk 2003.
Gentzen T., Ekonomika zdrowia. Teoria i praktyka, PWN, Warszawa 2000.
Jankowiak-Gracz, H., Gil L., Kołodziej I., Komornicki M., Badania farmakoekonomiczne w farmacji onkologicznej, Farmacja Polska 2005, Nr 2.
Orlewska E., Czech M., Słownik farakoekonomiczny, Unimed, Warszawa 2002.
Orlewska E., Nowakowska E., Farmakoekonomika, Akademia Medyczna im. Karola Modzelewskiego, Poznań 2004.
Stępniewski J. (red. n.), Strategia, finanse i koszty szpitala, ABC a Wolters Kluwer busness, Warszawa 2008.
Witczak I., Ekonomika szpitala. Uwarunkowania, elementy, zasady, CeDeWu.Pl, Warszawa 2009.
Wydatki na leki w Polsce w 2000 r. wynosiły około -10 mld zł, zaś w 2020 r. planowany jest wzrost do kwoty około 21,3 mld zł (za: I. Witczak, Ekonomika szpitala. Uwarunkowania, elementy, zasady, CeDeWu.Pl, Warszawa 2009, s. 65.
E. Orlewska, E. Nowakowska, Farmakoekonomika, Akademia Medyczna im. Karola Marcinkowskiego, Poznań 2004, s.9.
M. Drummond, B. O'Brien, G. Stodidart, G.W. Torrance, Metody badań ekonomicznych programów ochrony zdrowia, VM Media, Gdańsk 2003, Rozd. I.
T. Gentzen, Ekonomika zdrowia. Teoria i praktyka, PWN, Warszawa 2000, s.75.
Disabillity - Adjusted Lite Year (DALY), dodane lub stracone lata życia ze skorygowaną niesprawnością.
Dolan P., Olsen A.J., Dystrybucja usług medycznych. Zagadnienia ekonomiczne i etyczne, CeDeWu.Pl.,
Warszawa 2008, s. 137.
E. Orlewska, E, Nowakowska, Op. cit., s.121.
15
Q1
Q01
T1
T0