Reakcje chemiczne
Reakcja chemiczna - proces, w trakcie którego z atomów, cząsteczek lub jonów substancji wyjściowych (substratów) powstają cząsteczki, atomy lub jony substancji końcowych (produktów). Właściwości produktów różnią się od właściwości substratów.
Przykłady: otrzymywanie wody
otrzymywanie soli, np. NaCl
otrzymywanie alkoholu etylowego
Zapis reakcji chemicznej - równanie reakcji:
- dostarcza informacji o składzie chemicznym (jakościowym i ilościowym) substratów i produktów, niekiedy o efektach energetycznych towarzyszących reakcji,
- nie informuje o mechanizmie reakcji ani o stopniu przereagowania.
UWAGA:
formalny zapis reakcji chemicznej jest równaniem matematycznym, zatem obie strony równania winny być przedzielone matematycznym znakiem równości ”=”.
Używanie strzałek pojedynczych lub podwójnych zostało zarezerwowane dla procesów nieodwracalnych lub odwracalnych, a także dla procesów, których produkty nie są znane (np. w procesach chemii organicznej).
Typy reakcji chemicznych (podział)
1) - synteza
2) - analiza czyli rozkład
3) - wymiana
ad 1) synteza:
substraty - pierwiastki lub związki chemiczne,
produkt - jeden związek chemiczny.
Ogólnie: aA + bB = AaBb
Przykłady: Fe + S = FeS
C + O2 = CO2
CaO + CO2 = CaCO3
As2O5 + 3 H2O = 2 H3AsO4
CO2 + NH3 + H2O = NH4HCO3
ad 2) analiza:
substrat - jeden związek chemiczny,
produkty - pierwiastki lub związki chemiczne
Ogólnie: AaBb = a A + b B
Przykłady: 2 HgO = 2 Hg + O2
H2SO3 = SO2 + H2O
MgCO3 = MgO + CO2
2 NaHCO3 = Na2CO3 + CO2 + H2O
ad 3) wymiana
a) pojedyncza
substraty jeden pierwiastek chemiczny
i i
produkty jeden związek chemiczny
Ogólnie: A + BC = AC + B
Przykłady: Zn + 2 HCl = ZnCl2 + H2
CuSO4 + Fe = FeSO4 + Cu
2 KI + Cl2 = I2 + 2 KCl
b) podwójna
Ogólnie: AB + CD = AD + CB
Przykłady: FeS + H2SO4 = FeSO4 + H2S
Pb(NO3)2 + 2 HCl = PbCl2 + 2 HNO3
BaCl2 + CuSO4 = BaSO4 + CuCl2
Inne podziały reakcji chemicznych
1. Reakcje egzotermiczne i endotermiczne.
Uwzględnia efekt energetyczny reakcji, najczęściej wymianę ciepła, np.:
C + O2 = CO2 - 394 kJ/mol lub C + O2 = CO2 ΔH = -394 kJ/mol
reakcja egzotermiczna
(znak "-" świadczy o wydzielaniu ciepła)
2 Ag2O = 4 Ag + O2 + 60 kJ/mol lub 2 Ag2O = 4 Ag + O2 ΔH = 60 kJ/mol
reakcja endotermiczna
(znak "+" świadczy o pobieraniu ciepła)
2. Reakcje z przeniesieniem elektronów między reagentami, reakcje utleniania-redukcji (reakcje redoks).
3. Reakcje jonowe, cząsteczkowe i rodnikowe.
Zależnie od charakteru jednostek biorących udział w reakcji.
4. Reakcje odwracalne i nieodwracalne.
Z teoretycznego punktu widzenia wszystkie reakcje są odwracalne, tzn., jeżeli zapewni się układowi odpowiednie warunki, to z produktów ponownie powstają substraty:
A + B 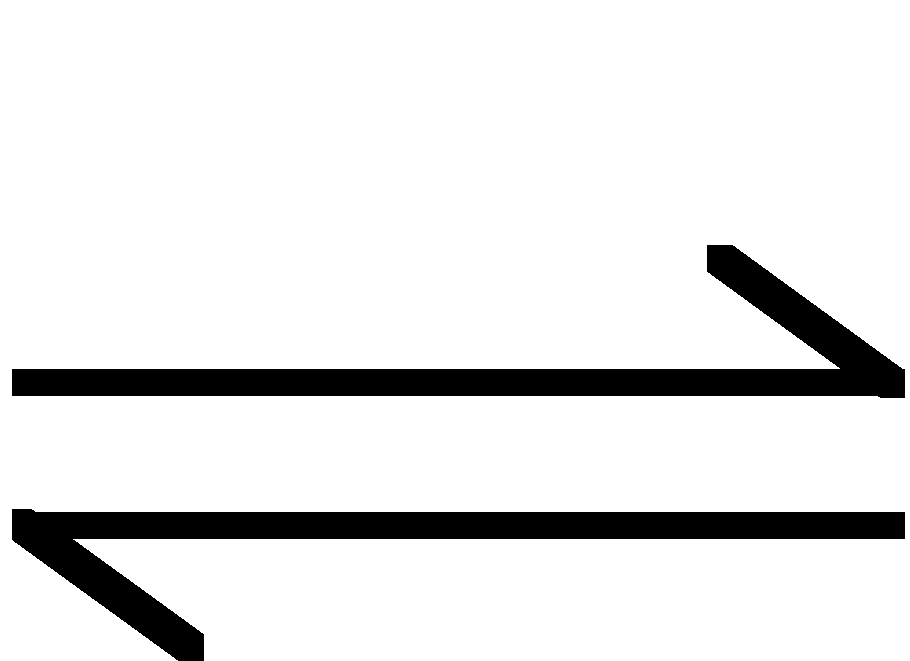
C + D
Często warunki konieczne dla przebiegu danej reakcji są zupełnie różne niż dla reakcji odwrotnej, co oznacza, że w warunkach przebiegu danej reakcji nie może praktycznie przebiegać reakcja odwrotna. O takich reakcjach mówimy, że są praktycznie (nie teoretycznie) nieodwracalne.
Podział reakcji chemicznych z uwagi na rodzaj reagujących substancji lub rodzaj otrzymywanych produktów:
1. syntezy z pierwiastków, np.:
a) tworzenie wodorków niemetali:
3 H2 + N2 = 2 NH3
2 H2+ S2 = 2 H2S
b) tworzenie tlenków (zarówno metali jak i niemetali):
4 Li + O2 = 2 Li2O
2 Na + O2 = Na2O2
C + O2 = CO2
N2 + O2 = 2 NO
4 P + 5 O2 = P4O10
2. reakcje roztworów kwasów z metalami:
a) kwasy beztlenowe wchodzą w reakcje tylko z metalami nieszlachetnymi (np.: K, Ba, Na, Mg, Al, Zn, Cr, Fe, Cd, Co, Ni, Pb), przy czym produktami reakcji są: odpowiednia sól i wodór, np.:
2 HCl + Mg = MgCl2 + H2↑
2 HBr + Zn = ZnBr2 + H2↑
b) kwasy tlenowe nieutleniające, takie jak: H2SO4 (rozcieńczony), H3PO4, CH3COOH wchodzą w reakcje tylko z metalami nieszlachetnymi, przy czym produktami reakcji są: odpowiednia sól i wodór, np.:
H2SO4(rozc.) + Zn = ZnSO4 + H2↑
3 H2SO4(rozc.) + 2 Al = Al2(SO4)3 + 3 H2↑
2 H3PO4 + 3 Fe = Fe3(PO4)2 + 3 H2↑
2 CH3COOH + Mn = (CH3COO)2Mn + H2↑
c) kwasy utleniające, takie jak H2SO4 (stężony), HNO3 (zarówno rozcieńczony jak i stężony), HClO3 i HClO4 wchodzą w reakcje z większością metali, przy czym produktami reakcji są: odpowiednia sól, tlenek pierwiastka kwasotwórczego i woda, np.:
6 H2SO4(stęż.) + 2 Al = Al2(SO4)3 + 3 SO2↑ + 6 H2O
8 HNO3(rozc.) + 3 Ni = 3 Ni(NO3)2 + 2 NO↑ + 4 H2O
4 HNO3(stęż.) + Cu = Cu(NO3)2 + 2 NO2↑ + 2 H2O
2 HNO3(stęż.) + Ag = AgNO3 + NO2↑ + H2O
Uwaga: stężone roztwory kwasów utleniających w kontakcie z wieloma metalami (Fe, Zn, Al, Cr, Pb, Ni) powodują ich pasywację, tzn. pokrywanie się powierzchni metalu cienką, ściśle przylegającą warstwą tlenku. Zatem, praktycznie, reakcje w tych warunkach nie zachodzą.
3. reakcje roztworów zasad z metalami:
z roztworami mocnych zasad wchodzą w reakcje tylko metale amfoteryczne, przy czym produktami są odpowiednia sól i wodór, np.:
NaOH + Al + H2O = NaAlO2 +3/2 H2↑
2 KOH + Zn = K2ZnO2 + H2↑
4. reakcje tlenków niektórych metali (litowców i berylowców) z wodą - produktami są odpowiednie wodorotlenki, np.:
Na2O + H2O = 2 NaOH
K2O + H2O = 2 KOH
CaO + H2O = Ca(OH)2
BaO + H2O = Ba(OH)2
5. rozkład termiczny wodorotlenków (oprócz wodorotlenków większości litowców) - produktami są: tlenek metalu i woda, np.:
Cu(OH)2 ![]()
CuO + H2O
2 Fe(OH)3 ![]()
Fe2O3 + 3 H2O
6. rozkład termiczny niektórych soli słabych kwasów tlenowych np. węglanów czy siarczanów(IV) (oprócz odpowiednich soli litowców) - produktami są: tlenek metalu i bezwodnik kwasu, np.:
CaCO3 ![]()
CaO + CO2↑
CuCO3 ![]()
CuO + CO2↑
MgSO3 ![]()
MgO + SO2↑
7. rozkład termiczny niektórych wodorosoli - produktami są sól prosta, bezwodnik kwasu i woda, np.:
2 NaHCO3 ![]()
Na2CO3 + CO2 + H2O
Ca(HCO3)3 ![]()
CaCO3 + CO2 + H2O
8. reakcje kwasów z zasadami - poduktami są
a) sole proste i woda, np.:
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
2 HCl + Ca(OH)2 = CaCl2 + 2 H2O
b) wodorosole (w reakcjach z mocnymi zasadami lub bezwodnikami mocnych zasad) i woda, np.:
H3PO4 + KOH = KH2PO4 + H2O
KH2PO4 + KOH = K2HPO4 + H2O
K2HPO4 + KOH = K3PO4 + H2O
2 H2SO4 + CaO = Ca(HSO4)2 + H2O
Ca(HSO4)2 + CaO = 2 CaSO4 + H2O
H2S + NaOH = NaHS + H2O
NaHS + NaOH = Na2S + H2O
c) hydroksosole (w reakcjach mocnych kwasów ze słabymi zasadami lub bezwodnikami słabych zasad) i woda, np.:
HCl + Mg(OH)2 = MgOHCl + H2O
HCl + MgOHCl = MgCl2 + H2O
H2SO4 + 2 Cu(OH)2 = (CuOH)2SO4 + 2 H2O
H2SO4 + (CuOH)2SO4 = 2 CuSO4 + 2 H2O
HCl + ZnO = ZnOHCl
HCl + ZnOHCl = ZnCl2 + H2O
9. inne reakcje podwójnej wymiany, stosowane w zależności od potrzeb, np.:
a) otrzymywanie wodorotlenków, np.:
NiSO4 + 2 NaOH = Ni(OH)2↓ + Na2SO4
AlCl3 + 3 KOH = Al(OH)3↓ + 3 KCl
b) otrzymywanie produktów gazowych, np.:
CaCO3 + 2 HCl = CO2↑ + CaCl2 + H2O
NH4Cl + NaOH = NH3↑ + NaCl + H2O
c) otrzymywanie hydroksysoli:
Co(NO3)2 + KOH = Co(OH)NO3↓ + KNO3
CdCl2 + NaOH = Cd(OH)Cl↓ + NaCl
Zadania
I. Napisać równania poniższych reakcji, dobrać współczynniki stechiometryczne.
1. cynk + kwas siarkowy(VI)(rozc.) =
2. glin + kwas solny (chlorowodorowy)=
3. glin + kwas siarkowy(VI)(stęż.) =
4. glin + kwas siarkowy(VI)(rozc.) =
5. magnez + kwas ortofosforowy(V) =
6. chrom + kwas solny (chlorowodorowy)=
7. żelazo + kwas azotowy(V)(rozc.) =
8. rtęć + kwas siarkowy(VI)(stęż.) =
9. kadm + kwas solny (chlorowodorowy) =
10. srebro + kwas azotowy(V)(rozc.) =
11. srebro + kwas siarkowy(VI)(stęż.) =
12. wapń + kwas chlorowy(V) =
13. magnez + kwas siarkowy(VI)(rozc.) =
14. mangan + kwas siarkowy(VI)(rozc.) =
15. żelazo + kwas ortofosforowy(V) =
16. glin + kwas azotowy(V)(rozc.) =
17. tlenek magnezu + ditlenek siarki =
18. tlenek żelaza(II) + pentatlenek diazotu =
19. tlenek cyny(II) + heptatlenek dichloru =
20. tlenek kobaltu(II) + pentatlenek difosforu =
21. tlenek wapnia + ditlenek węgla =
22. tlenek sodu + ditlenek krzemu =
23. tlenek baru + ditlenek węgla =
24. tlenek niklu(II) + tritlenek siarki =
25. tlenek żelaza(II) + pentatlenek dichloru =
26. tlenek baru + tritlenek diazotu =
27. wodorotlenek kadmu + ditlenek węgla =
28. wodorotlenek magnezu + tlenek chromu(VI) =
29. wodorotlenek baru + ditlenek krzemu =
30. wodorotlenek strontu + ditlenek siarki =
31. tlenek wapnia + kwas ortofosforowy(V) =
32. tlenek cynku + kwas chlorowy(VII) =
33. tlenek żelaza(III) + kwas solny (chlorowodorowy) =
34. tlenek miedzi(I) + kwas siarkowy(VI) =
35. tlenek miedzi(II) + kwas azotowy(V) =
36. tlenek srebra + kwas siarkowy(VI) =
37. tlenek manganu(II) + kwas ortofosforowy(V) =
38. tlenek ołowiu(II) + kwas azotowy(III) =
39. tlenek magnezu + kwas chlorowy(VII) =
40. tlenek niklu(II) + kwas chlorowy(V) =
41. tlenek glinu + kwas azotowy(V) =
42. tlenek tytanu(IV) + kwas siarkowy(VI) =
43. tlenek chromu(III) + kwas bromowodorowy =
44. tlenek bizmutu(III) + kwas azotowy(V) =
45. tlenek miedzi(II) + kwas chlorowy(VII) =
46. tlenek rtęci(II) + kwas azotowy(V) =
47. tlenek żelaza(III) + kwas solny (chlorowodorowy) =
48. wodorotlenek glinu + kwas chlorowy(VII) = (3 etapy)
49. wodorotlenek niklu(II) + kwas chlorowy(V) = (2 etapy)
50. wodorotlenek chromu(III) + kwas fluorowodorowy = (3 etapy)
51. wodorotlenek miedzi(II) + kwas azotowy(V) = (2 etapy)
52. wodorotlenek cynku + kwas azotowy(V) = (2 etapy)
53. wodorotlenek miedzi(II) + kwas solny (chlorowodorowy) = (2 etapy)
54. wodorotlenek żelaza(III) + kwas siarkowy(VI) = (3 etapy)
55. wodorotlenek bizmutu(III) + kwas azotowy(III) = (3 etapy)
56. wodorotlenek wapnia + kwas ortofosforowy(V) = (2 etapy)
57. wodorotlenek potasu + kwas siarkowodorowy = (2 etapy)
58. wodorotlenek sodu + kwas ortofosforowy(V) = (3 etapy)
59. wodorotlenek litu + kwas siarkowy(VI) = (2 etapy)
60. wodorotlenek wapnia + kwas siarkowy(VI) = (2 etapy)
61. wodorotlenek baru + kwas ortofosforowy(V) = (3 etapy)
62. wodorotlenek wapnia + kwas siarkowodorowy = (2 etapy)
63. wodorotlenek sodu + kwas siarkowy(VI) = (2 etapy)
64. wodorotlenek potasu + kwas siarkowy(VI) = (2 etapy)
65. wodorotlenek strontu + kwas ortofosforowy(V) = (3 etapy)
66. wodorotlenek cynku + kwas bromowodorowy = (2 etapy)
67. kwas ortooksoborowy + wodorotlenek potasu = (3 etapy)
68. kwas ortoarsenowy(V) + wodorotlenek potasu = (3 etapy)
69. amoniak + kwas siarkowy(VI) = (2 etapy)
70. siarczan(VI) magnezu + wodorotlenek sodu = (2 etapy)
71. azotan(V) miedzi(II) + wodorotlenek sodu = (2 etapy)
72. wodorotlenek sodu + bromek chromu(III) = (3 etapy)
73. chlorek żelaza(III) + wodny roztwór amoniaku = (2 etapy)
74. siarczan(VI) niklu(II) + wodorotlenek sodu = (2 etapy)
75. chlorek kadmu + wodorotlenek potasu = (2 etapy)
76. azotan(V) ołowiu(II) + chlorek żelaza(III) =
77. azotan(V) bizmutu(III) + siarczek potasu =
78. siarczan(VI) miedzi(II) + siarczek sodu =
79. cyjanek potasu + kwas siarkowy(VI) =
80. siarczan(VI) glinu + bromek baru =
81. węglan wapnia + kwas ortofosforowy(V) =
82. metakrzemian sodu + kwas siarkowy(VI) =
83. cyjanek potasu + kwas chlorowodorowy (kwas solny) =
84. siarczan(IV) baru + kwas chlorowodorowy (kwas solny) =
85. wodorotlenek cynku + wodorotlenek potasu =
86. wodorotlenek cyny(II) + wodorotlenek sodu =
87. wodorotlenek glinu + wodorotlenek sodu = (sól meta- lub orto-)
88. wodorotlenek cyny(IV) + wodorotlenek sodu = (sól meta- lub orto-)
89. wodorotlenek ołowiu(II) + wodorotlenek potasu =
90. wodorotlenek ołowiu(IV) + wodorotlenek potasu = (sól meta- lub orto-)
II. Napisać równania poniższych reakcji chemicznych, dobrać współczynniki stechiometryczne.
1. Kwas węglowy i siarkowy(IV) są nietrwałe i rozkładają się na odpowiednie bezwodniki i wodę. Napisać równania odpowiednich reakcji.
2. Napisać równania reakcji powstawania kwasu ortofosforowego(V) i difosforowego(V) z odpowiedniego bezwodnika kwasowego i wody.
3. Pentatlenek diazotu i tritlenek diazotu tworzą z wodą odpowiednie kwasy. Napisać równania reakcji tworzenia tych kwasów.
4. Metan (CH4) spala się w tlenie z utworzeniem ditlenku węgla i wody. Napisać równanie odpowiedniej reakcji.
5. Węglik glinu pod działaniem wody rozkłada się tworząc metan i wodorotlenek glinu. Napisać równanie reakcji.
6. Wodorotlenek żelaza(III) rozkłada się podczas prażenia dając w pierwszym etapie tlenek wodorotlenek żelaza(III) i wodę. Napisać równanie reakcji.
7. Węglan wodorotlenek miedzi(II) podczas ogrzewania rozkłada się dając tlenek miedzi(II), ditlenek węgla i wodę. Napisać równanie reakcji.
8. W wyniku reakcji kwasu ortooksoborowego z sodą (węglan sodu) powstają heptaoksotetraboran disodu, ditlenek węgla i woda. Napisać równanie reakcji.
9. Metaliczny cynk i glin roztwarzają się w roztworze wodorotlenku sodu z utworzeniem odpowiednich soli i wydzieleniem gazowego wodoru. Napisać równania odpowiednich reakcji.
10. Ogrzewanie roztworu siarczanu(IV) sodu z siarką prowadzi do powstania tiosiarczanu(VI) sodu. Napisać równanie reakcji.
11. Superfosfat podwójny (diwodoroortofosforan(V) wapnia) otrzymuje się działając kwasem ortofosforowym(V) na fosforyt (ortofosforan(V) wapnia). Napisać równanie reakcji.
12. Dekatlenek tetrafosforu reaguje z chlorowodorem, w wyniku czego powstaje chlorek tlenek fosforu(V) i kwas metafosforowy(V). Napisać równanie reakcji.
13. Azotek magnezu reaguje z wodą, przy czym jednym z produktów jest amoniak. Napisać równanie odpowiedniej reakcji.
14. Roztwór nadtlenku wodoru otrzymuje się w wyniku działania rozcieńczonego roztworu kwasu siarkowego(VI) na nadtlenek baru. Napisać równanie reakcji.
15. Węglan amonu otrzymuje się w wyniku ogrzewania siarczanu(VI) amonu z węglanem wapnia. Napisać równanie reakcji.
16. Roztwór azotanu(V) kadmu tworzy z nadmiarem wodnego roztworu amoniaku azotan(V) tetraaminakadmu. Napisać równanie reakcji.
17. Jony miedzi(II) reagują z nadmiarem roztworu cyjanku potasu; w pierwszym etapie reakcji tworzy się żółty osad cyjanku miedzi(II), który natychmiast ulega redukcji do białego cyjanku miedzi(I), przy czym wydziela się dicyjan. W dalszym toku procesu cyjanek miedzi(I) tworzy z nadmiarem cyjanku potasu trwały tetracyjanomiedzian(I) potasu. Napisać równania wszystkich reakcji.
18. W wilgotnym powietrzu miedź utlenia się tworząc wodorotlenek węglan miedzi(II) (patyna). Napisać równanie reakcji.
19. Acetylen powstaje w wyniku rozkładu węgliku wapnia (karbid) pod wpływem wody. Napisać równanie reakcji.
20. Działaniem fluorowodoru na krzem otrzymuje się fluorek krzemu i wodór. Napisać równanie reakcji.
21. Napisać równania reakcji kwasu siarkowodorowego z roztworami:
a) chlorku arsenu(III)
b) heksachloroarsenianu(V) potasu,
c) heksachlorocynianu(IV) sodu,
d) azotanu(V) bizmutu(III),
e) siarczanu(VI) kadmu.
22. Napisać równania reakcji roztwarzania:
a) siarczku manganu(II) w kwasie solnym,
b) siarczku żelaza(II) w kwasie siarkowym(VI),
c) węglanu baru w kwasie azotowym(V),
d) wodorotlenku chromu(III) w kwasie siarkowym(VI).
23. Fluorowodór reaguje ze szkłem przy czym powstają: fluorek krzemu, fluorek sodu, fluorek wapnia i woda. Napisać równanie reakcji przyjmując sumaryczny wzór szkła Na2CaSi6O14.
24. Bezwodny chloran(VII) magnezu, doskonały środek osuszający, otrzymuje się ogrze-wając mieszaninę węglanu magnezu z chloranem(VII) amonu. Napisać równanie reakcji.
25. Technologiczny proces otrzymywania sody (węglan sodu) metodą Solvay'a składa się z kilku etapów:
a) w reakcji termicznego rozkładu kamienia wapiennego (węglan wapnia) otrzymuje się ditlenek węgla,
b) ditlenek węgla w reakcji z amoniakiem i wodą tworzy wodorowęglan amonu,
c) wodorowęglan amonu w reakcji z roztworem chlorku sodu daje wodorowęglan sodu,
d) wodorowęglan sodu lekko prażony przechodzi w węglan sodu.
Napisać równania reakcji poszczególnych etapów tego procesu.
26. Trawienie oktatlenku triuranu kwasem azotowym(V) prowadzi do powstania heksawodnego azotanu(V) ditlenku uranu(VI). Metaliczny uran otrzymuje się w wyniku następujących procesów:
a) rozkład azotanu(V) ditlenku uranu(VI) z wydzieleniem tritlenku uranu,
b) redukcja tritlenku uranu wodorem do ditlenku uranu (w temp. ~1000ºC),
c) reakcja ditlenku uranu z bezwodnym fluorowodorem - otrzymuje się tetrafluorek uranu,
d) redukcja tetrafluorku uranu do metalicznego uranu przy pomocy metalicznego magnezu.
Napisać równania reakcji wszystkich etapów tego procesu.
27. Metaliczny wanad otrzymuje się z wanadynitu [triortowanadan(V) ołowiu(II) i chlorek ołowiu(II)] w następujących operacjach chemicznych:
a) minerał rozpuszcza się w kwasie solnym, przy czym powstają chlorek tlenek wanadu(V) i chlorek ołowiu(II),
b) chlorek tlenek wanadu(V) w reakcji z wodnym roztworem amoniaku tworzy meta-wanadan(V) amonu,
c) metawanadan(V) amonu podczas prażenia przechodzi w pentatlenek diwanadu,
d) pentatlenek diwanadu redukuje się do metalicznego wanadu za pomocą metalicznego wapnia lub glinu.
Napisać równania wszystkich etapów tego procesu.
28. Metaliczny beryl otrzymuje się z minerału o nazwie beryl (tritlenek berylu i tlenek glinu i sekstaditlenek krzemu) w wyniku następujących reakcji:
a) po stopieniu minerał zalewa się wodą ("gaszenie") i rozpuszcza w stężonym kwasie siarkowym(VI); metale w postaci siarczanów(VI) przechodzą do roztworu, ditlenek krzemu (krzemionka) pozostaje w osadzie,
b) działając stężonym roztworem siarczanu(VI) amonu wytrąca się trudno rozpuszczalny siarczan(VI) amonu i glinu,
c) działaniem roztworu amoniaku wytrąca się wodorotlenek berylu, który prażony przechodzi w tlenek berylu,
d) tlenek berylu ogrzewa się z węglem w strumieniu gazowego chloru otrzymując chlorek berylu,
e) stopiony chlorek berylu poddaje się elektrolizie.
Napisać równania wszystkich etapów tego procesu.
Odpowiedzi
I.
1. Zn + H2SO4(rozc.) = ZnSO4 + H2↑
2. 2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
3. 2 Al + 6 H2SO4(stęż.) = Al2(SO4)3 + 3 SO2 + 6 H2O
4. 2 Al + 3 H2SO4(rozc.) = Al2(SO4)3 + 3 H2↑
5. 3 Mg + 2 H3PO4 = Mg3(PO4)2 + 3 H2↑
6. 2 Cr + 6 HCl = 2 CrCl3 + 3 H2↑
7. 3 Fe + 8 HNO3(rozc.) = 3 Fe(NO3)2 + 2 NO + 4 H2O
8. Hg + 2 H2SO4(stęż.) = HgSO4 + SO2 + 2 H2O
9. Cd + 2 HCl = CdCl2 + H2↑
10. 3 Ag + 4 HNO3(rozc.) = 3 AgNO3 + NO + 2 H2O
11. 2 Ag + 2 H2SO4(stęż.) = Ag2SO4 + SO2 + 2 H2O
12. Ca + 4 HClO3 = Ca(ClO3)2 + 2 ClO2 + 2 H2O
13. Mg + H2SO4(rozc.) = MgSO4 + H2↑
14. Mn + H2SO4(rozc.) = MnSO4 + H2↑
15. 2 Fe + 2 H3PO4 = 2 FePO4 + 3 H2↑
16. Al + 4 HNO3(rozc.) = Al(NO3)3 + NO + 2 H2O
17. MgO + SO2 = MgSO3
18. FeO + N2O5 = Fe(NO3)2
19. SnO + Cl2O7 = Sn(ClO4)2
20. 3 CoO + P2O5 = Co3(PO4)2
21. CaO + CO2 = CaCO3
22. Na2O + SiO2 = Na2SiO3
23. BaO + CO2 = BaCO3
24. NiO + SO3 = NiSO4
25. FeO + Cl2O5 = Fe(ClO3)2
26. BaO + N2O3 = Ba(NO2)2
27. Cd(OH)2 + CO2 = CdCO3 + H2O
28. Mg(OH)2 + CrO3 = MgCrO4 + H2O
29. Ba(OH)2 + SiO2 = BaSiO3 + H2O
30. Sr(OH)2 + SO2 = SrSO3 + H2O
31. 3 CaO + 2 H3PO4 = Ca3(PO4)2 + 3 H2O
32. ZnO + 2 HClO4 = Zn(ClO4)2 + H2O
33. Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O
34. Cu2O + H2SO4 = Cu2SO4 + H2O
35. CuO + 2 HNO3 = Cu(NO3)2 + H2O
36. Ag2O + H2SO4 = Ag2SO4 + H2O
37. 3 MnO + 2 H3PO4 = Mn3(PO4)2 + 3 H2O
38. PbO + 2 HNO2 = Pb(NO2)2 + H2O
39. MgO + 2 HClO4 = Mg(ClO4)2 + H2O
40. NiO + 2 HClO3 = Ni(ClO3)2 + H2O
41. Al2O3 + 6 HNO3 = 2 Al(NO3)3 + 3 H2O
42. TiO2 + 2 H2SO4 = Ti(SO4)2 + 2 H2O
43. Cr2O3 + 6 HBr = 2 CrBr3 + 3 H2O
44. Bi2O3 + 6 HNO3 = 2 Bi(NO3)3 + 3 H2O
45. CuO + 2 HClO4 = Cu(ClO4)2 + H2O
46. HgO + 2 HNO3 = Hg(NO3)2 + H2O
47. Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O
48. Al(OH)3 + HClO4 = Al(OH)2ClO4 + H2O
Al(OH)2ClO4 + HClO4 = Al(OH)(ClO4)2 + H2O
Al(OH)(ClO4)2 + HClO4 = Al(ClO4)3 + H2O
49. Ni(OH)2 + HClO3 = Ni(OH)ClO3 + H2O
Ni(OH)ClO3 + HClO3 = Ni(ClO3)2 + H2O
50. Cr(OH)3 + HF = Cr(OH)2F + H2O
Cr(OH)2F + HF = Cr(OH)F2 + H2O
Cr(OH)F2 + HF = CrF3 + H2O
51. Cu(OH)2 + HNO3 = Cu(OH)NO3 + H2O
Cu(OH)NO3 + HNO3 = Cu(NO3)2 + H2O
52. Zn(OH)2 + HNO3 = Zn(OH)NO3 + H2O
Zn(OH)NO3 + HNO3 = Zn(NO3)2 + H2O
53. Cu(OH)2 + HCl = Cu(OH)Cl + H2O
Cu(OH)Cl + HCl = CuCl2 + H2O
54. 2 Fe(OH)3 + H2SO4 = (Fe(OH)2)2SO4 + 2 H2O
(Fe(OH)2)2SO4 + H2SO4 = 2 Fe(OH)SO4 + 2 H2O
2 Fe(OH)SO4 + H2SO4 = Fe2(SO4)3 + 2 H2O
55. Bi(OH)3 + HNO3 = Bi(OH)2NO3 + H2O
Bi(OH)2NO3 + HNO3 = Bi(OH)(NO3)2 + H2O
Bi(OH)(NO3)2 + HNO3 = Bi(NO3)3 + H2O
56. Ca(OH)2 + 2 H3PO4 = Ca(H2PO4)2 + 2 H2O
Ca(H2PO4)2 + Ca(OH)2 = 2 CaHPO4 + 2 H2O
2 CaHPO4 + Ca(OH)2 = Ca3PO4)2 + 2 H2O
57. KOH + H2S = KHS + H2O
KHS + KOH = K2S + H2O
58. NaOH + H3PO4 = NaH2PO4 + H2O
NaH2PO4 + NaOH = Na2HPO4 + H2O
Na2HPO4 + NaOH = Na3PO4 + H2O
59. LiOH + H2SO4 = LiHSO4 + H2O
LiHSO4 + LiOH = Li2SO4 + H2O
60. Ca(OH)2 + 2 H2SO4 = Ca(HSO4)2 + 2 H2O
Ca(HSO4)2 + Ca(OH)2 = 2 CaSO4 + 2 H2O
61. Ba(OH)2 + 2 H3PO4 = Ba(H2PO4)2 + 2 H2O
Ba(H2PO4)2 + Ba(OH)2 = 2 BaHPO4 + 2 H2O
2 BaHPO4 + Ba(OH)2 = Ba3PO4)2 + 2 H2O
62. Ca(OH)2 + 2 H2S = Ca(HS)2 + 2 H2O
Ca(HS)2 + Ca(OH)2 = 2 CaS + 2 H2O
63. NaOH + H2SO4 = NaHSO4 + H2O
NaHSO4 + NaOH = Na2SO4 + H2O
64. KOH + H2SO4 = KHSO4 + H2O
KHSO4 + KOH = K2SO4 + H2O
65. Sr(OH)2 + 2 H3PO4 = Sr(H2PO4)2 + 2 H2O
Sr(H2PO4)2 + Sr(OH)2 = 2 SrHPO4 + 2 H2O
2 SrHPO4 + Sr(OH)2 = Sr3(PO4)2 + 2 H2O
66. Zn(OH)2 + HBr = Zn(OH)Br + H2O
Zn(OH)Br + HBr = ZnBr2 + H2O
67. H3BO3 + KOH = KH2BO3 + H2O
KH2BO3 + KOH = K2HBO3 + H2O
K2HBO3 + KOH = K3BO3 + H2O
68. H3AsO4 + KOH = KH2AsO4 + H2O
KH2AsO4 + KOH = K2HAsO4 + H2O
K2HAsO4 + KOH = K3AsO4 + H2O
69. NH3 + H2SO4 = NH4HSO4
NH4HSO4 + NH3 = (NH4)2SO4
70. 2 MgSO4 + 2 NaOH = (MgOH)2SO4 + Na2SO4
(MgOH)2SO4 + 2 NaOH = 2 Mg(OH)2 + Na2SO4
71. Cu(NO3)2 + NaOH = (CuOH)NO3 + NaNO3
(CuOH)NO3 + NaOH = Cu(NO3)2 + NaNO3
72. NaOH + CrBr3 = Cr(OH)Br2 + NaBr
Cr(OH)Br2 + NaOH = Cr(OH)2Br + NaBr
Cr(OH)2Br + NaOH = Cr(OH)3 + NaBr
73. FeCl3 + 3 NH3 + 3 H2O = Fe(OH)3 + 3 NH4Cl
74. NiSO4 + 2 NaOH = Ni(OH)2 + Na2SO4
75. CdCl2 + 2 KOH = Cd(OH)2 + 2 KCl
76. 3 Pb(NO3)2 + 2 FeCl3 = 3 PbCl2 + 2 Fe(NO3)3
77. 2 Bi(NO3)3 + 3 K2S = Bi2S3 + 6 KNO3
78. CuSO4 + Na2S = CuS + Na2SO4
79. 2 KCN + H2SO4 = 2 HCN + K2SO4
80. Al2(SO4)3 + 3 BaBr2 = 2 AlBr3 + 3 BaSO4
81. 3 CaCO3 + 2 H3PO4 = Ca3(PO4)2 + 3 CO2 + 3 H2O
82. Na2SiO3 + H2SO4 = Na2SO4 + SiO2 + H2O
83. KCN + HCl = HCN + KCl
84. BaSO3 + 2 HCl = BaCl2 + SO2 + H2O
85. Zn(OH)2 + 2 KOH = K2ZnO2 + 2 H2O
86. Sn(OH)2 + 2 NaOH = Na2SnO2 + 2 H2O
87. Al(OH)3 + NaOH = NaAlO2 + 2 H2O
Al(OH)3 + 3 NaOH = Na3AlO3 + 3 H2O
88. Sn(OH)4 + 2 NaOH = Na2SnO3 + 2 H2O
Sn(OH)4 + 4 NaOH = Na4SnO4 + 4 H2O
89. Pb(OH)2 + 2 KOH = K2PbO2 + 2 H2O
90. Pb(OH)4 + 2 NaOH = Na2PbO3 + 2 H2O
Pb(OH)4 + 4 NaOH = Na4PbO4 + 4 H2O
II.
1. H2CO3 ![]()
CO2 + H2O; H2SO3 ![]()
SO2 + H2O
2. P2O5 + 3 H2O = 2 H3PO4; P2O5 + 2 H2O = H4P2O7
3. N2O5 + H2O = 2 HNO3; N2O3 + H2O = 2 HNO2
4. CH4 + 2 O2 = CO2 + 2 H2O
5. Al4C3 + 12 H2O = 3 CH4 + 4 Al(OH)3
6. Fe(OH)3 ![]()
Fe(OH)O + H2O↑
7. (CuOH)2CO3 ![]()
2 CuO + CO2 + H2O
8. 4 H3BO3 + Na2CO3 = Na2B4O7 + CO2 + 6 H2O
9. Zn + 2 NaOH = Na2ZnO2 + H2↑
2 Al + 6 NaOH = 2 Na3AlO3 + 3 H2↑
10. Na2SO3 + S = Na2S2O3
11. Ca3(PO4)2 + 4 H3PO4 = 3 Ca(H2PO4)2
12. P4O10 + 3 HCl = POCl3 + 3 HPO3
13. Mg3N2 + 6 H2O = 2 NH3 + 3 Mg(OH)2
14. BaO2 + H2SO4 = H2O2 + BaSO4
15. (NH4)2SO4 + CaCO3 = (NH4)2CO3 + CaSO4
16. Cd(NO3)2 + 4 NH3 = [Cd(NH3)4](NO3)2
17. Cu2+ + 2 CN- = Cu(CN)2↓
2 Cu(CN)2 ![]()
2 CuCN + (CN)2↑
CuCN + 3 KCN = K3[Cu(CN)4]
18. 2 Cu + O2 + CO2 + H2O = (CuOH)2CO3
19. CaC2 + 2 H2O = C2H2 + Ca(OH)2
20. 4 HF + Si = SiF4 + 2 H2↑
21. a) 3 H2S + 2 AsCl3 = As2S3 + 6 HCl
b) 5 H2S + 2 KAsCl6 = As2S5 + 2 KCl + 10 HCl
c) 2 H2S + Na2SnCl6 = SnS2 + 2 NaCl + 4 HCl
d) 3 H2S + 2 Bi(NO3)3 = Bi2S3 + 6 HNO3
e) H2S + CdSO4 = CdS + H2SO4
22. a) MnS + 2 HCl = MnCl2 + H2S
b) FeS + H2SO4 = FeSO4 + H2S
c) BaCO3 + 2 HNO3 = Ba(NO3)2 + CO2 + H2O
d) 2 Cr(OH)3 + 3 H2SO4 = Cr2(SO4)3 + 6 H2O
23. Na2CaSi6O14 + 28 HF = 6 SiF4 + 2 NaF + CaF2 + 14 H2O
24. MgCO3 + 2 NH4ClO4 = Mg(ClO4)2 + CO2 + 2 NH3 + H2O
25. a) CaCO3 ![]()
CaO + CO2
b) CO2 + NH3 + H2O = NH4HCO3
c) NH4HCO3 + NaCl = NaHCO3 + NH4Cl
d) 2 NaHCO3 ![]()
Na2CO3 + CO2 + H2O
26. a) UO2(NO3)2 ![]()
UO3 + N2O5
b) UO3 + H2 = UO2 + H2O
c) UO2 + 4 HF = UF4 + 2 H2O
d) UF4 + 2 Mg = U + 2 MgF2
27. a) 3 Pb3(VO4)2·PbCl2 + 36 HCl = 6 VOCl3 + 10 PbCl2 + 18 H2O
b) VOCl3 + NH3 + 2 H2O = NH4VO3 + 3 HCl
c) 2 NH4VO3 ![]()
V2O5 + 2 NH3 + H2O
d) V2O5 + 5 Ca = 2 V + 5 CaO
28. a) 3 BeO·Al2O3·6 SiO2 + 6 H2SO4 = 3 BeSO4 + Al2(SO4)3 + 6 SiO2 + 6 H2O
b) Al2(SO4)3 + (NH4)2SO4 = 2 NH4Al(SO4)2
c) BeSO4 + 2 NH3 + 2 H2O = Be(OH)2 + (NH4)2SO4
Be(OH)2 ![]()
BeO + H2O
d) BeO + C + Cl2 = BeCl2 + CO
e) K(+) ![]()
+ 2 ![]()
= Be
A(-) 2 ![]()
= Cl2 + 2 ![]()
1
Wyszukiwarka
Podobne podstrony:
Reakcje-red-oks, Inżynieria chemiczna i procesowa
Witaminy są związkami organicznymi, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa
zadanie1 3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, tran
pytania operacje, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 4
Stechiometria, Inżynieria chemiczna i procesowa
D III rokBiopreparatywykłady 1-3fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i pro
Staliwa węglowe i konstrukcyjne stopowe, Inżynieria chemiczna i procesowa, Materiało- i maszynoznaws
Przykładowa analiza AWZ, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, bez
mikro3, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikrobio
biotechnologia2, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III semestr 6
allbiochemia, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I semestr 2, bio
mikrokapsułkowanie aromatów, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok I
egz mikro, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr 3, mikro
Tabelka do zadania, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok II semestr
2012 - Pytania do kol wyk, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 2, d
Strona 1 cw2 tytulowa, politechnika łódzka, inżynieria chemiczna i procesowa, rok I semestr 1, dynam
zagadnienia fermenty, uniwersytet warmińsko-mazurski, inżynieria chemiczna i procesowa, rok III seme
więcej podobnych podstron