Technologia Żywności i Żywienie Człowieka
Sem. V gr. 3
Czwartek 1215-1600
Laboratorium z Biochemii
Ćwiczenie nr 8
Oksydoreduktazy
Wstęp teoretyczny
Oddychanie komórkowe - są to łączne procesy enzymatyczne przebiegające w każdej komórce żywego organizmu, w których wyniku cząsteczki węglowodanów, kwasów tłuszczowych i aminokwasów zostają ostatecznie rozłożone na dwutlenek węgla i wodę, a powstająca energia zostaje zachowana i zmagazynowana w postaci użytecznej biologicznie.
W utlenianiu biologicznym zachodzą różne typy reakcji oksydoredukcyjnych: przenoszenie tlenu, przenoszenie protonów i elektronów oraz przenoszenie samych elektronów.
Oksydoreduktazy (EC 1) -enzymy katalizujące reakcje utleniania i redukcji.
Wiele z tych enzymów znanych jest jako:
Dehydrogenazy to ogólna nazwa enzymów odczepiających atomy wodoru (łac. hydrogenium - wodór) z rozmaitych związków organicznych występujących w organizmach żywych. Przykładem może być kompleks dehydrogenazy kwasów tłuszczowych czy enzymy cyklu Krebsa. Odrywany atom wodoru nie występuje w postaci rodnika tylko jest wiązany z NADP i tak używany do hydrogenacji (uwadaraniania) albo spalany w kaskadzie oksydacyjnej mitochondrium produkując ATP~P~P.
Dehydrogenaza alkoholowa (EC 1.1.1.1) - enzym z grupy oksydoreduktaz przyspieszający przekształcanie się aldehydu octowego w etanol lub odwrotnie. Może także katalizować podobne przemiany innych alkoholi i odpowiadających im aldehydów i ketonów.
Enzym ten odgrywa podstawową rolę w fermentacji alkoholowej, która jest formą oddychania beztlenowego, a także w detoksykacji alkoholu.
Dehydrogenaza alkoholowa występuje bardzo powszechnie - w komórkach bakterii, grzybów, zwierząt i roślin. Współdziała z cząsteczką NAD+ lub NADH jako koenzymem. W reakcji syntezy etanolu z aldehydu octowego, zużywany jest NADH, a jako produkt uboczny powstaje NAD+):
![]()
Dyhydrogezana mleczanowa (EC 1.1.1.2) - enzym z klasy oksydoreduktaz, obecny w wątrobie. Katalizuje ostatni etap szlaku glikolitycznego - przejście pirogronianu w mleczan i odwrotnie.
![]()
Katalizuje utlenienie kwasu mlekowego, odgrywa ważną rolę w fermentacji mlekowej.
Reduktazy - to grupa enzymów obniżających energię aktywacji związku chemicznego dla reakcji redukcji. Pozwala to na przeprowadzenie reakcji przy doprowadzeniu mniejszej niż normalnie ilości energii.
Reduktazy katalizują przeniesienie protonów i elektronów lub samych elektonów pomiędzy przenośnikami np. wewnątrz łańcucha oddechowego. Enzymem tego typu jest reduktaza azotanowa, katalizująca redukcję azotanów do azotynów.
![]()
Wyróżniamy:
oksygenazy właściwe (dioksygenazy) -włączają dwa atomy tlenu do substratu;
![]()
- dioksygenazy wymagające udziału NAD(P)H, katalizujące reakcje hydroksylacji substratu;
- dioksygenazy niewymagające udziału NAD(P)H, katalizujące rozerwanie pierścienia;
b) oksygenazy mieszane (monoksygenazy) -katalizują włączenie jednego atomu tlenu do hydroksylowanego substratu, podczas gdy drugi atom tlenu wiązany jest w cząsteczkę wody z udziałem NAD(P)H.
![]()
Oksydazy - enzymy katalizujące przenoszenie wodoru na tlen w wyniku, czego powstaje woda lub nadtlenek wodoru.
Wyróżniamy:
Aktywują cząsteczkę tlenu czterema elektronami:
![]()
Oksydaza cytochromowa jest szeroko rozpowszechnioną w wielu tkankach hemoproteiną, zawierającą jako grupę prostetyczną typowy hem występujący w mioglobinię, hemoglobinie i innych cytochromach. Jest ona końcowym przenośnikiem elektronowym w mitochondrialnym łańcuchu oddechowym. Jest odpowiedzialny za reakcje przenoszenia elektronów pochodzących z utleniania cząsteczek substratów katalizowanych przez dehydrogenazy, na ich końcowy akceptor - tlen. Oksydaza traci aktywność w obecności tlenku węgla II, cyjanków lub siarkowodoru. Zawiera on dwie cząsteczki hemu, z których każdy posiada atom Fe, występujący w czasie utleniania i redukcji w formie Fe3+ i Fe2+. Po zatem enzym ten zawiera dwa atomy miedzi po jednym na jednostkę hemową.
oksydazy fenolowe (charakterystyczne dla roślin) - katalizujące utlenianie fenoli do chitonów.
Jest to enzym o małej specyficzności i działa na o-fenole, ale także na inne substraty fenolowe. Oksydaza o-difenolowa utlenia te związki do odpowiednich o-chinonów, które ulegają dalszym przemianom i polimeryzacji już bez udziału enzymów do tzw, melanin, charakteryzujących się barwą brunatną. Zmiany spowodowane przemianami polifenoli zapoczątkowane ich utlenieniem do chitonów w obecności oksydaz fenolowych noszą nazwę „enzymatycznego brunatnienia lub enzymatycznego brązowienia żywności”. Bogatym źródłem oksydazy o-difenolowej są niektóre owoce (jabłka, banany) i warzywa (ziemniaki).
Aktywują cząsteczkę tlenu dwoma elektronami:
![]()
Oksydaza glukozowa utlenia glukozę do kwasu glukozowego. Enzym ten wykazuje powinowactwo do β-D-glukopiranozy. Oksydazę glukozową stosuje się do ilościowego oznaczania glukozy w żywności, we krwi i w moczu, a także do usuwania glukozy z produktów spożywczych oraz do usuwania tlenu z puszek z konserwami, piwem czy też z opakowań foliowych.
Enzymy rozkładające nadtlenek wodoru
Nadtlenek wodoru tworzy się w wyniku aktywacji tlenu dwoma elektronami z udziałem oksydaz lawinowych. Ponieważ H2O2 jest silnym inhibitorem układów enzymatycznych, organizmy mają aktywne mechanizmy zdolne do jego rozkładu. Do enzymów czynnych przy usuwaniu H2O2 z komórki należą peroksydazy i katalazy. Enzymy te są żelazoproteinami i zawierają hem jako grupę prostetyczną.
Peroksydazy (np. EC 1.11.1.7) - grupa enzymów należących do klasy oksydoreduktaz katalizujących utlenianie nadtlenkiem wodoru różnych substratów. Choć reakcja katalizowana przez peroksydazę jest złożona można ją zapisać w następującej formie:
![]()
Peroksydaza glutationowa, jak i askorbinionowa wspomaga organizm w walce z wolnymi rodnikami. Peroksydaza glutationowa rozkłada nadtlenek wodoru (H2O2) do wody (H2O).
Katalaza - (EC 1.11.1.6) enzym z grupy oksydoreduktaz katalizujący proces rozkładu nadtlenku wodoru do wody i tlenu.
![]()
Otrzymana po raz pierwszy w postaci krystalicznej w 1937 roku przez J.B. Sumnera. Znaczne jej ilości występują w komórkach zwierzęcych np. w wątrobie, nerce, leukocytach i erytrocytach (krwinkach czerwonych), w bakteriach tlenowych oraz w peroksysomach komórek roślinnych fotosyntezujących. Jest dobrym enzymem markerowym dla peroksysomów. Jest bardzo aktywnym enzymem, którego grupę prostetyczną stanowi hemina.
Wykonanie doświadczenia:
Przygotowanie ekstraktu enzymatycznego.
Ziemniaka obrałyśmy ze skórki i starłyśmy na tarce. Naważkę 10g przygotowanego produktu roztarłyśmy w moździerzu z dodatkiem 1g CaCO3 do uzyskania jednorodnej masy. Próbę przeniosłyśmy ilościowo do cylindra o pojemności 200cm3, uzupełniłyśmy do kreski wodą destylowaną, wymieszałyśmy i po 5min przesączyłyśmy. Ekstrakt stosowałyśmy do dalszych doświadczeń.
Analiza jakościowa
Wykonanie oznaczenia:
Przygotowałyśmy 8 probówek:
Próba odniesienia (probówka 1):
Do 2cm3 ekstraktu enzymatycznego dodałyśmy 3cm3 wody destylowanej.
Oksydaza o-difenolowa (probówki 2 i 3):
Do obu probówek dodałyśmy 2cm3 ekstraktu enzymatycznego i 3cm3 wody destylowanej. Następnie do probówki 2 dodałyśmy 10 kropli 1% katecholu, a do probówki 3 dodałyśmy 10 kropli 1% pirogalolu.
Peroksydaza (probówki 4 i 5):
Do obu probówek dodałyśmy 2cm3 ekstraktu enzymatycznego i 3cm3 wody destylowanej. Następnie do probówki 4 dodałyśmy 10 kropli 1% katecholu i 10 kropli 1% H2O2, a do probówki 5 dodałyśmy 10 kropli 1% pirogalolu i 10 kropli 1% H2O2.
Katalaza (probówka 6):
Do 2cm3 ekstraktu enzymatycznego dodałyśmy 3cm3 wody destylowanej i 10 kropli 1% H2O2.
Próby odczynnikowe (probówki 7 i 8):
Do obu probówek wprowadziłyśmy 5cm3 wody destylowanej. Następnie do probówki 7 dodałyśmy 10 kropli 1% katecholu, a do probówki 8 dodałyśmy 10 kropli 1% pirogalolu.
Zawartość probówek wymieszałyśmy i obserwowałyśmy zachodzące zmiany w czasie 3 godzin.
Wyniki analizy jakościowej aktywności oksydazy o-difenolowej, peroksydazy, katalazy w badanym surowcu, zestawiłyśmy w tabeli:
Nr probówki |
Próba |
Oznaczany enzym |
Wynik analizy |
Opis próby |
1 |
Ekstrakt |
Próba odniesienia |
- |
Bezbarwny |
2 3 |
Ekstrakt + katechol Ekstrakt + pirogalol |
Oksydaza o-difenolowa |
++ ++ |
Pomarańczowy Jasnożółty |
4 5 |
Ekstrakt + katechol + H2O2 Ekstrakt + pirogalol + H2O2 |
Peroksydaza |
+++ +++ |
Jasnobrązowy + gaz Intensywny żółty + gaz |
6 |
Ekstrakt + H2O2 |
Katalaza |
+ |
Bezbarwny + gaz |
7 8 |
Woda + katechol Woda + pirogalol |
Próby odczynnikowe |
- - |
Bezbarwny Kremowy |
Wnioski: W ziemniakach występują następujące enzymy: oksydaza o-difenolowa, peroksydaza i katalaza. Peroksydaza wykazuje bardzo wysoką aktywność spośród analizowanych enzymów oksyredukcyjnych w ziemniaku. Oksydaza o-difenolowa wykazuje wysoką, a katalaza średnią aktywność.
Analiza ilościowa
Oznaczenie aktywności katalizy:
W dwóch kolbach stożkowych o pojemności 200cm3 umieściłyśmy 5cm3 ekstraktu enzymatycznego (z ziemniaka) i po 25cm3 wody destylowanej. Do jednej z kolb, służącej o przygotowania próby właściwej, dodałyśmy 3cm3 1% H2O2 i powadziłyśmy reakcję rozkładu nadtlenku wodoru pod wpływem katalazy dokładnie 30 minut w temperaturze pokojowej. Następnie do tej kolby dodałyśmy 5cm3 10% H2SO4, co spowodowało inaktywacje enzymów i przerwanie reakcji enzymatycznego rozkładu H2O2. Do drugiej kolby, służącej do przygotowania próby odniesienia, najpierw dodałyśmy 5cm3 10% H2SO4, celem inaktywacji enzymów, enzymów następnie dodałyśmy 3cm3 1% H2O2.
Obie próby zmiareczkowałyśmy 0,1M KMnO4.
Aktywność katalazy
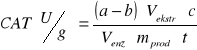
a - ilość 0,1M KMnO4 zużyta do miareczkowania próby odniesienia [cm3] = 31cm3
b - ilość 0,1M KMnO4 zużyta do miareczkowania próby właściwej [cm3] = 11cm3
Vekstr - całkowita objętość ekstraktu enzymatycznego [200cm3]
Venz - objętość ekstraktu enzymatycznego pobrana do oznaczenia [5cm3]
c - miano KMnO4, równe 250, gdyż 1cm3 0,1M KMnO4 odpowiada 250 µmoli H2O2
t - czas reakcji
m prod - naważka produktu (10g), z której uzyskano 200cm3 ekstraktu
![]()
Oznaczenie aktywności peroksydazy:
W probówkach umieściłyśmy:
Próba kontrolna:
5cm3 buforu fosforanowego
1cm3 roztworu gwajakolu
1cm3 ekstraktu enzymatycznego (z kapusty białej)
Próba właściwa:
5cm3 buforu fosforanowego
1cm3 roztworu gwajakolu
1cm3 ekstraktu enzymatycznego (z kapusty białej)
2 krople H2O2 12.3 mM
Zmierzyłyśmy absorbancję próby właściwej wobec kontrolnej przy λ = 436nm w czasie zerowym (A0) i po 1 minucie (A1min).
Aktywność peroksydazy:
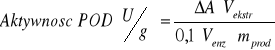
ΔA - przyrost absorbancji w czasie 1 minuty (A1min-A0 = 0,255-0,085 = 0,17)
Vekstr - całkowita objętość ekstraktu enzymatycznego (200cm3)
0,1 - współczynnik przeliczeniowy jednostki aktywności
Venz - objętość ekstraktu enzymatycznego pobrana do oznaczenia (1cm3)
m prod - naważka produktu (10g), z której uzyskano 200cm3 ekstraktu
![]()
Wyniki analizy ilościowej:
Aktywność katalazy i peroksydazy w badanych produktach zestawiłyśmy w tabeli:
L.p. |
Produkt |
Aktywność enzymu [U/g] |
|||
|
|
Katalaza |
Peroksydaza |
||
|
|
|
średnia |
|
średnia |
1 |
Brukselka |
566,7 596,7 |
587,1 |
90 102 |
96 |
2 |
Kapusta biała |
316,7 306,7 |
311,7 |
40
34 36 |
36,7 |
3 |
Ziemniak |
666,7 591,7 |
629,7 |
|
|
4 |
Pieczarka |
558,3 |
558,3 |
|
|
Wnioski: Najwyższa aktywność katalazy występuje w ziemniaku, a najniższa w kapuście białej. Najwyższa aktywność peroksydazy występuje w brukselce, a najniższa w kapuście białej. Ogólnie najwięcej enzymów rozkładających nadtlenek wodoru (katalazy i peroksydazy) jest w brukselce.
Wyszukiwarka
Podobne podstrony:
Biochemia sprawozdanie O, biochemia laboratorium, Biochemia - sprawozdania inne
Biochemia Sprawozdanie A, biochemia laboratorium, Biochemia - sprawozdania inne
biochemia sprawozdanie O (4), biochemia laboratorium, O (moje)
SprawkoA B, biochemia laboratorium, Biochemia - sprawozdania inne
G, biochemia laboratorium, Biochemia - sprawozdania inne
Sprawozdanie - aminokwasy, Technologia Żywności i Żywienie Człowieka, V semestr, Biochemia, Laborato
Biochemia Sprawozdanie K (topnienie DNA), biochemia laboratorium, Biochemia - sprawozdania inne
Wyznaczanie stałej siatki dyfrakcyjnej, Prz inf 2013, I Semestr Informatyka, Fizyka, SPRAWOZDANIA DU
II O- Biochemia cwiczenie 5, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
II O- Biochemia cwiczenie 1, Politechnika Wrocławska - ochrona środowiska, biochemia - laboratorium
fiele25, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, Lab
PUZON, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Laborki s
fiele15, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, Lab
SPRAWOZDANIE Z ĆWICZEŃ LABORATORYJNYCII
sprawozdanie z pierwszego laboratorium (1)
Sprawozdanie z zajęć laboratoryjnych z mikrobiologii nr 6
pp25, Mechanika i Budowa Maszyn PWR MiBM, Semestr I, Fizyka, laborki, sprawozdania z fizykii, Labora
WICZENIE8 12 F, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
więcej podobnych podstron