Biochemia I Laboratorium
Ćwiczenie A
WYZNACZANIE STAŁEJ MICHAELISA
I SZYBKOŚCI MAKSYMALNEJ
Prowadzący:
Mgr inż. Agnieszka Szamborska
Data wykonania ćwiczenia: 7 marca 2008
Data wykonania sprawozdania: 8 marca 2008
Piątek 12:15
Justyna Budzicz 152049
Olga Mielczarek 153881
1. CEL ĆWICZENIA
Wyznaczenie stałej Michaelisa i szybkości maksymalnej dla reakcji fosfatazy kwaśniej z ziemniaka dla reakcji:
H2O
p-nitrofenylofosforan p-nitrofenol + H3PO4
fosfataza
Metoda:
Szybkość określono na podstawie spektrofotometrycznego oznaczenia ilości produktu.
Odczynniki:
Roztwór fosfatazy w buforze
Roztwór p-nitrofenolu w buforze (standard)
5.0mM Roztwór p-nitrofenylofosforanu
0.25M bufor octanowy o pH 5.0
0.5M NaOH
Szkło laboratoryjne i aparatura:
29 probówek chemicznych
Pipety miarowe
Kuwety szklane
Łaźnia wodna 37°C
Spektrofotometr
2. PRZEBIEG ĆWICZENIA
1) Pomiar szybkości reakcji w funkcji substratu 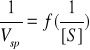
a) Roztwór fosfatazy przeniesiono na lód.
b) Do probówek 1-11 dodano zgodnie z tabelą 2:
- 0.25M buforu octanowego o pH 5.0
- 5.0mM p-nitrofenolofosforanu (substrat).
c) Inkubowano mieszaniny 1-11 przez 5 minut w łaźni wodnej 37°C, aby stworzyć warunki optymalne dla dodania fosfatazy.
d) Po wyjęciu probówek z łaźni, do nieprimowanych probówek dodano po 0.10ml fosfatazy.
e) Probówki 1-11 inkubowano przez 25 minut w łaźni 37°C w celu zapewnienia fosfatazie optymalnych warunków do przeprowadzenia reakcji enzymatycznej dla uzyskania maksymalnych ilości produktu w każdej z probówek.
f) W tym czasie wyznaczono krzywą standardową (punkt 2).
g) Po 25 minutach do probówek 1-11 dodano po 2ml 0.5M NaOH w celu przerwania reakcji. (NaOH powoduje denaturację enzymu, wprowadzając alkaliczne pH).
h) Zmierzono absorbancję roztworów 1-10 przy długości fali 410nm używając próby 11 jako odnośnika, a wyniki zamieszczono w tabeli 2.
2) Wyznaczenia krzywej standardowej
a) 200μl 5.0mM roztwory p-nitrofenolu przeniesiono do kolbki i dopełniono do 10ml buforem octanowym o pH 5.0. Dokładnie wymieszano roztwór w kolbie.
b) Do probówek 1-8 dodano zgodnie z tabelą 1:
- 0.25M buforu octanowego o pH 5.0
- 0.1mM p-nitrofenolu w buforze (standard)
- 0.5M NaOH
c) Zmierzono absorbancję prób 1-7 przy długości fali 410nm, używając próby 8 jako odnośnika.
3. OBLICZENIA
Stężenie fosfatazy w mieszaninie reakcyjnej:
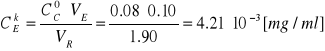
Stężenie p-nitrofenolu, którego użyto do sporządzenia krzywej standardowej:
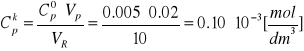
Obliczono stężenia p-nitrofenolofosforanu [S] oraz 1/[S]
Przykładowe obliczenia dla próbki nr 1:
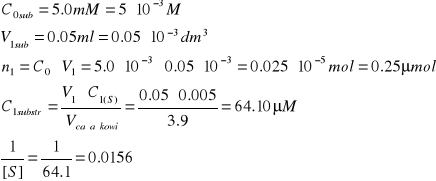
Na podstawie krzywej standardowej obliczono V (liczność powstającego produktu (w μmol) w czasie 25min)
podstawiając kolejne wartości Akor do równania krzywej standardowej
y=Akor
x=V
y=4.4643x+0.02
Przykładowe obliczenia dla próbki nr 1:
y=0.095
![]()
![]()
Obliczono szybkość reakcji, czyli ilość p-nitrofenolu powstałego w czasie 1min (Vc):
Przykładowe obliczenia dla próbki nr 1:
![]()
![]()
Obliczono ilość mikromoli produktu przekonwertowanego przez 1mg enzymu w czasie 1 minuty (Vsp), a następnie 1/Vsp
Przykładowe obliczenia dla próbki nr 1:
![]()
![]()
Krzywa 1/Vsp = f(1/S) jest opisana równaniem y = 368.44x + 0,2384 (y=ax+b)
Miejsce zerowe funkcji 1/Vsp = f(1/S) (punkt przecięcia się krzywej z osią OX), czyli wartość 1/[S] dla którego 1/Vsp=0, wynosi 1/[S]= -0,0006471 [1/μmol]
Vmax to punkt przecięcia się krzywej z osią OY, czyli punkt dla którego 1/S=0)
![]()
![]()
Obliczono Vmax i Km:
Vmax=![]()
![]()
![]()
![]()
Km= 1545 [μM]
4. WYNIKI
Tabela 1.
Próbka (nr) |
Bufor [ml] |
p-nitrofenol [ml] |
p-nitrofenol [μmol] |
NaOH [ml] |
A410 |
1 |
1.700 |
0.200 |
0.020 |
2 |
0.090 |
2 |
1.500 |
0.400 |
0.040 |
2 |
0.210 |
3 |
1.300 |
0.600 |
0.060 |
2 |
0.300 |
4 |
1.100 |
0.800 |
0.080 |
2 |
0.380 |
5 |
0.900 |
1.000 |
0.100 |
2 |
0.470 |
6 |
0.700 |
1.200 |
0.120 |
2 |
0.550 |
7 |
0.500 |
1.400 |
0.140 |
2 |
0.640 |
8 |
1.900 |
0.000 |
0.000 |
2 |
odnośnik |
Wykres 1.
Krzywa standardowa została opisana równaniem y=4.4643x+0.02
Tabela 2.
Probówka (nr) |
Bufor [ml] |
Substrat |
Enzym [ml] |
NaOH [ml] |
A410 |
ΔA410(kor) |
1 |
1.750 |
0.050 |
0.100 |
2 |
0.095 |
0.095 |
1' |
1.850 |
0.050 |
- |
2 |
0.000 |
|
2 |
1.700 |
0.100 |
0.100 |
2 |
0.200 |
0.190 |
2' |
1.800 |
0.100 |
- |
2 |
0.010 |
|
3 |
1.650 |
0.150 |
0.100 |
2 |
0.270 |
0.266 |
3' |
1.750 |
0.150 |
- |
2 |
0.004 |
|
4 |
1.600 |
0.200 |
0.100 |
2 |
0.330 |
0.325 |
4' |
1.700 |
0.200 |
- |
2 |
0.005 |
|
5 |
1.500 |
0.300 |
0.100 |
2 |
0.480 |
0.470 |
5' |
1.600 |
0.300 |
- |
2 |
0.010 |
|
6 |
1.350 |
0.450 |
0.100 |
2 |
0.590 |
0.575 |
6' |
1.450 |
0.450 |
- |
2 |
0.015 |
|
7 |
1.200 |
0.600 |
0.100 |
2 |
0.575 |
0.555 |
7' |
1.300 |
0.600 |
- |
2 |
0.020 |
|
8 |
1.050 |
0.750 |
0.100 |
2 |
0.630 |
0.605 |
8' |
1.150 |
0.750 |
- |
2 |
0.025 |
|
9 |
0.800 |
1.000 |
0.100 |
2 |
0.790 |
0.760 |
9' |
0.900 |
1.000 |
- |
2 |
0.030 |
|
10 |
0.500 |
1.300 |
0.100 |
2 |
0.80 |
0.759 |
10' |
0.600 |
1.300 |
- |
2 |
0.0410 |
|
11 |
1.800 |
- |
0.100 |
2 |
odnośnik |
|
A/kor/ = A410 - A'410
Tabela 3.
Probówka (nr) |
ΔA410 (kor) |
[S] [μM] |
1/[S] [1/μM] |
V [μmol/25min] |
Vc [μmol/min] |
Vsp [μmol/mgb⋅min] |
1/Vsp [min⋅mgb/μmol] |
1 |
0.095 |
64.100 |
0.01560 |
0.01679 |
0.000672 |
0.1596 |
6.2656 |
2 |
0.190 |
128.200 |
0.00780 |
0.03808 |
0.001523 |
0.3617 |
2.7647 |
3 |
0.266 |
192.300 |
0.00520 |
0.05510 |
0.002204 |
0.5235 |
1.9102 |
4 |
0.325 |
256.400 |
0.00390 |
0.06832 |
0.002733 |
0.6492 |
1.5404 |
5 |
0.470 |
384.500 |
0.00260 |
0.10079 |
0.004032 |
0.9577 |
1.0442 |
6 |
0.575 |
576.900 |
0.00173 |
0.12432 |
0.004972 |
1.1809 |
0.8468 |
7 |
0.555 |
769.200 |
0.00130 |
0.11984 |
0.004794 |
1.1387 |
0.8782 |
8 |
0.605 |
961.500 |
0.00104 |
0.13104 |
0.005242 |
1.2451 |
0.8031 |
9 |
0.760 |
1282.100 |
0.00078 |
0.16576 |
0.006630 |
1.5748 |
0.6350 |
10 |
0.759 |
1666.600 |
0.00060 |
0.16554 |
0.006622 |
1.5729 |
0.6357 |
Wykres 2.
Wykres 3.
Krzywa 1/Vsp = f(1/S) jest opisana równaniem y = 368.44x + 0,2384 (y=ax+b)
5. WNIOSKI
Cel ćwiczenia został zrealizowany w 100%, gdyż doświadczenie to pozwoliło na wyznaczenie szukanych Vmax oraz Km dla reakcji hydrolizy p-nitrofenylofosforanu do p-nitrofenol prowadzonej przez fosfatazę kwaśną z ziemniaka.
W warunkach optymalnych fosfataza kwaśna z ziemniaka konwertuje p-nitrofenylofosforan do p-nitrofenolu z szybkością maksymalną równą 4.1946 [μmol/mgbiałka⋅min]
Stała Km dla tego enzymu w warunkach optymalnych wynosi 1545 [μM], czyli przy stężeniu substratu równym 1545 [μM] szybkość reakcji enzymatycznej równa się połowie szybkość maksymalnej. Km jest miarą powinowactwa enzymu do substratu, dlatego też można obliczyć szybkość maksymalną reakcji przy określonej ilości enzymu i nadmiarze substratu, obserwując wysycanie całego enzymu substratem.
Enzym ten jest enzymem zachowującym się zgodnie z modelem Michaelisa-Menten, ponieważ, jak wynika z wykresu 2 i 3 szybkość reakcji przez niego prowadzonej osiąga wartość maksymalną po całkowitym wysyceniu enzymu substratem.
Reakcję prowadzono w warunkach optymalnych dla fosfatazy, co pozwoliło zaobserwować maksymalną wydajność reakcji przez nią katalizowanej.
9
Wyszukiwarka
Podobne podstrony:
SprawkoA B, biochemia laboratorium, Biochemia - sprawozdania inne
G, biochemia laboratorium, Biochemia - sprawozdania inne
Biochemia sprawozdanie O, biochemia laboratorium, Biochemia - sprawozdania inne
Biochemia Sprawozdanie K (topnienie DNA), biochemia laboratorium, Biochemia - sprawozdania inne
CYKLE BIOCHEMICZNE 5 STR , Inne
cykle biochemiczne (5 str), INNE KIERUNKI, biologia
Biochemia-Kolos2(inne), AWF FIZJOTERAPIA (3 LATA), biochemia
CYKLE BIOCHEMICZNE 5 STR , Inne
tech mech, Sprawozdania, Inne
SPRAWOZDANIA INNE, zmywarki, DZIENNE
SPRAWOZDANIA INNE, zmywarki sprawko, DZIENNE
SPRAWOZDANIA INNE, zmywarki sprawko, DZIENNE
Smarowanie jest to doprowadzenie smaru stałego, Sprawozdania, Inne
Obróbka plastyczna, Sprawozdania, Inne
sprawko z UT2, Na uczelnie, Spawalnictwo, sprawozdania i inne
Sprawko M21, biologia uj, biologia II, fizyka, jakies sprawozdania i inne
StablizatorySprawozdanie, Elektrotechnika AGH, Semestr IV letni 2013-2014, Podstawy Elektroniki, Pod
KluczSprawozdanie, Elektrotechnika AGH, Semestr IV letni 2013-2014, Podstawy Elektroniki, Podstawy e
StabilizatoryKospektKLIM, Elektrotechnika AGH, Semestr IV letni 2013-2014, Podstawy Elektroniki, Pod
więcej podobnych podstron