Marcin Menke |
Kierunek: Technologie ochrony środowiska |
Wydział: Technologii chemicznej |
|||
Prowadząca: dr Agnieszka Zgoła-Grześkowiak |
Ocena: |
Grupa laboratoryjna: 5 |
22.04.2006r. |
||
Temat: Rozkład przez strącenie.
Wykonanie ćwiczenia:
1) Strącanie soli jako funkcja Ir.
1.![]()
po dodaniu ![]()
wytrącił się biały osad
2.![]()
żółto mleczny roztwór, z wolno wytrącającym się osadem
![]()
jasno żółty roztwór, wytrąca się jasno żółty osad
Podobne doświadczenie wykonaliśmy dla 0,01 M roztworu ![]()
. W pierwszej próbówce obserwujemy pomarańczowy kolor do góry i bezbarwny na dole, osad nie wytrącił się z powodu obecności kwasu octowego w roztworze. W drugiej próbówce otrzymaliśmy natomiast jasno żółty roztwór i wytrącił się osad.
![]()
Iloczyn rozpuszczalności ![]()
wynosi 9,67, natomiast ![]()
jest równy 4,65.
3. Przygotowaliśmy dwie próbówki z ok.. 2 cm³ bezbarwnego roztworu jonów ![]()
. Dodaliśmy do nich kolejno:
I) białe kryształki stałego ![]()
roztwór pozostał bezbarwny wytrącił się biały osad.
![]()
Węglan sodu i węglan potasu tworzą ze wszystkimi kationami grup analitycznych trudno rozpuszczalne osady. Ponieważ roztwory węglany sodu i potasu są silnie alkaiczne, niektóre z powstających osadów stanowią mieszaniny węglanów, hydroksywęglanów i wodorotlenków.
II) bezbarwnego roztworu ![]()
roztwór pozostał bezbarwny.
![]()
W analizie chemicznej reakcje kompleksowania często współdziałają z reakcjami strącenia trudno rozpuszczalnych osadów. Najważniejsze są trzy kierunki tej współpracy: strącenie jonu w obecności czynnika kompleksującego, rozpuszczenie trudno rozpuszczalnego osadu za pomocą czynnika kompleksującego oraz zapobieganie strąceniu składnika towarzyszącego temu, który należy strącić(czyli maskowanie).
2) Reakcje kompleksowania a strącenie osadów.
1.kompleksy amoniakalne.
![]()
osad brunatny (miedziany)
![]()
roztwór gęstnieje, kolor maślany, lekki osad
![]()
osad mleczno pomarańczowy
![]()
roztwór bezbarwny z białym osadem
![]()
roztwór gęstnieje z niebieskim osadem
![]()
niebieska zawiesina
3) Amfoteryczność a reakcje strącenia.
Po dodaniu do ![]()
małej ilości ![]()
wytrącił się osad, w miarę dodawania rozpuszcza się. Identycznie reagują metale: ![]()
4) Zmiana stopnia utlenienia a strącanie osadów.
1. Strącenie osadów ![]()
w wyniku reakcji redoks.
![]()
- po dodaniu NaOH osad mleczno pomarańczowy, roztwór zgęstniał, po dodaniu ![]()
no powierzchni pojawiła się brązowa zawiesina.
![]()
roztwór staje się klarowny i wytrąca się ciemno brązowy osad.
2. Do próbówki wprowadziliśmy roztwór ![]()
, a następnie dodaliśmy parę kropli roztworu 2M HCl i brązowego roztworu ![]()
. Otrzymaliśmy roztwór o czarnym zabarwieniu na dole próbówki i bardzo ciemno niebieskim na jej górze. Jest to trudno rozpuszczalny związek zwany błękitem pruskim.
![]()
Następnie do otrzymanej mieszaniny dodaliśmy świeżo przygotowany roztwór soli cynowej. Otrzymaliśmy roztwór o barwie ciemnoniebieskiej, prawie granatowej na górze i bardzo ciemno zielonej na dole. Do góry utworzył się błękit pruski z kolei na dole próbówki żelazocyjanki utworzyły barwny osad z jonami cyny (II).
![]()
Reakcje barwne dla ![]()
i ![]()
siarczki tworzą z żelazem czarne siarczki żelaza II i III; po rozcięczeniu przechodzą w zielony koloidy roztworu siarczku żelaza II i brunatny wodorotlenek żelaza III.
W roztworach wodnych bez dostępu powietrza tworzy się biały osad wodorotlenku żelaza II; pod wpływem powietrza osad zielenieje , przechodząc po czasie w brunatny osad
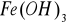
.W reakcjach z amoniakiem tworzy się zielono brunatny kompleks
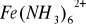
Węglany metali alkaicznych tworzą biały osad węglanu żelaza III.
W reakcjach z fosforanami żelazo II tworzy biały bez postaciowy osad, stanowiący mieszaninę
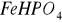
: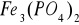
, który z czasem przyjmuje zabarwienie niebieskozielone, żelazo III tworzy żółtawy osad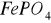
Żelazo II w reakcjach z cyjankami tworzy żółtobrunatny osad
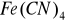
, który przy nadmiarze jonów cyjankowych przechodzi w kompleks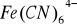
; żelazocyjanki można utlenić do żelazo cyjanków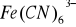
.Rodanki reagują z jonami żelaza III tworzą krwistoczerwono zabarwione kompleksy
żelazocyjanki tworzą z żelazem ciemno niebieski związek zwany błękitem pruskim.
Fenoloftaleina tworzy z jonami żelaza II pomarańczowo czerwony kompleks
Dimetylogliksyn z jonami żelaza II twoży czerwony kompeks.
Kwas sulfosalicylowy tworzy z jonami żelaza III, fioletowo czerwony kompleks, który ze wzrostem pH przechodzi przez pomarańczowo-czerwony, do żółtego kompleksu.
Jony
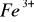
można redukować do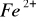
w środowisku kwaśnym za pomocą siarkowodoru, chlorku cyny II, siarczków, tiosiarczanów.
Wyszukiwarka
Podobne podstrony:
sprawozdaniw zad.13, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
Protokół z ćwiczenia 12, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.labork
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
sprawozdanie cwiczenia 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Odczyn roztworów wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
Hydroliza soli i pH roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.
więcej podobnych podstron