Właściwości bioelektryczne
tkanki nerwowej
i
tkanki mięśniowej
Wydział Nauk Medycznych
Zaoczna Fizjoterapia
Grupa BB7
Katarzyna Batóg
Marta Zielińska
Martyna Cebera
Anna Pękacka
Agnieszka Sieniawska
Aldona Wróbel
Małgorzata Urbaś
Bogusława Zalewicz
Małgorzata Rzepecka
Rafał Pacholik
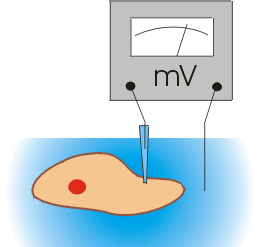
Wszystkie komórki organizmu mają potencjał błonowy.
Potencjałem błonowym lub membranowym nazywamy różnicę potencjałów pomiędzy wnętrzem komórki i jej otoczeniem. Wygodnie jest przyjąć (i taka jest obowiązująca konwencja), że potencjał po zewnętrznej stronie błony wynosi zero. W takim razie napięcie pomiędzy obu stronami błony jest po prostu potencjałem wnętrza komórki mierzonym względem jej otoczenia. Zasada pomiaru wartości potencjału membranowego jest bardzo prosta.
Przykład układu pomiarowego, jaki może być użyty w tym celu jest przedstawiony na rysunku obok. Jak widać układ ten składa się z miliwoltomierza oraz pary elektrod, z których jedna jest zanurzona w roztworze otaczającym badaną komórkę, druga natomiast, umieszczona w pipecie szklanej przebijającej błonę komórkową, ma dostęp do wnętrza komórki. Błona komórki przylega szczelnie do szkła, z którego jest zrobiona pipeta i nie dochodzi dzięki temu do bezpośredniego elektrycznego kontaktu pomiędzy wnętrzem i otoczeniem komórki. Miliwoltomierz mierzy różnicę potencjałów pomiędzy wnętrzem i otoczeniem komórki, czyli potencjał błonowy.
Wyróżnić można;
potencjał równowagi
potencjał spoczynkowy
potencjał czynnościowy
POTENCJAŁ RÓWNOWAGII
Jeśli po dwóch stronach przegrody przepuszczalnej dla jonów wytworzy się różnicę stężeń tych jonów, to na skutek dyfuzji będą one przechodziły z przedziału o stężeniu wyższym do przedziału o stężeniu niższym.
Przepływ jonów pomiędzy przedziałami można zatrzymać wytwarzając pomiędzy nimi odpowiednią różnicę potencjałów. Pole elektryczne będzie powodowało ruch jonów (migrację) w stronę przeciwną do kierunku ich ruchu związanego z dyfuzją. W ten sposób może dojść do równowagi pomiędzy strumieniem dyfuzyjnym i migracyjnym. Tym samym całkowity strumień przez przegrodę będzie równy zero i stężenia jonów w obu przedziałach przestaną się zmieniać.
POTENCJAŁ SPOCZYNKOWY
Z doświadczenia wiadomo, że większość żywych komórek utrzymuje stałą wartość różnicy potencjałów pomiędzy swym wnętrzem a otoczeniem. Ten stały potencjał wnętrza komórki względem jej otoczenia nazywamy potencjałem spoczynkowym.
Zdolność komórki do utrzymywania stałej wartości potencjału spoczynkowego związana jest bezpośrednio z istnieniem różnicy stężeń niektórych jonów pomiędzy wnętrzem i otoczeniem komórki. Dla większości komórek jonami "najważniejszymi" z punktu widzenia potencjału spoczynkowego są jony sodu, potasu oraz chlorkowe.
Typowy czyli najczęściej spotykany rozkład stężeń jonów jest taki, że na zewnątrz komórki stężenie jonów sodowych i chlorkowych jest większe niż wewnątrz komórki, natomiast stężenie jonów potasu jest większe wewnątrz komórki.
Stała wartość potencjału błonowego może być utrzymana jedynie wtedy, gdy całkowity ładunek przepływający przez błonę jest równy zeru (w przeciwnym razie następowałaby zmiana ładunku błony i związana z tym zmiana potencjału).
Błona komórki jest przepuszczalna dla jonów - w stanie spoczynku najlepiej przepuszczane są jony potasu, gorzej chlorkowe, najgorzej zaś sodowe.
Wobec istniejących różnic stężeń indywidualne strumienie każdego z jonów nie są równe zero.
W związku z tym potencjał spoczynkowy może być utrzymany, gdy suma ładunków przenoszonych przez jony w jednostce czasu (suma prądów jonowych) jest równa zero. INa + IK + ICl = 0.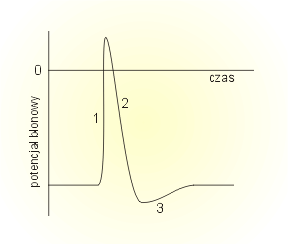
POTENCJAŁ CZYNNOŚCIOWY
Niektóre z komórek, oprócz utrzymywania potencjału spoczynkowego są zdolne dodatkowo do szybkiej i krótkotrwałej zmiany potencjału błonowego- będziemy je nazywali komórkami pobudliwymi.
Komórki nie posiadające tej zdolności nazywamy niepobudliwymi. Chwilową, impulsową zmianę potencjału błony komórkowej będziemy nazywali potencjałem czynnościowym.
Potencjał czynnościowy powstaje w komórce pobudliwej, gdy potencjał jej błony przekroczy pewną graniczną wartość nazywaną progiem pobudzenia. Warto zauważyć, że wielkość bodźca pobudzającego ma znaczenie jedynie dla powstania pojedynczego potencjału czynnościowego- nie ma ona natomiast wpływu na jego przebieg.
Zmiany potencjału błonowego podczas trwania potencjału czynnościowego w przykładowej komórce nerwowej przedstawione są na rysunku obok.
Jak widać "klasyczny" potencjał czynnościowy składa się z kilku faz:
1. gwałtownego wzrostu potencjału błonowego (depolaryzacji)
2. nieco powolniejszego spadku potencjału błony (repolaryzacji)
3. okresu, gdy potencjał błony jest niższy od potencjału spoczynkowego (hiperpolaryzacji)
Z rozważań dotyczących potencjału spoczynkowego wynika, że aby doszło do zmiany potencjału błonowego to musi przez błonę popłynąć niezrównoważony prąd jonowy.
Biorąc pod uwagę przedstawiony powyżej przebieg zmian potencjału błony jest jasne, że kształtujące go prądy jonowe muszą zmieniać się w czasie.
W fazie depolaryzacji wzrost potencjału błony jest związany z napływem do wnętrza komórki dodatnich jonów (w komórce nerwowej są to jony sodowe).
W czasie repolaryzacji ustaje dokomórkowy prąd sodowy, wzrasta natomiast odkomórkowy prąd potasowy.
Wypływ ładunków dodatnich powoduje zmniejszanie się potencjału błony. Prąd potasowy płynie również wówczas, gdy potencjał błony osiąga wartość potencjału spoczynkowego- powoduje to, że komórka wchodzi w fazę hiperpolaryzacji.
Dopiero gdy ustanie prąd potasowy potencjał błony powraca do wartości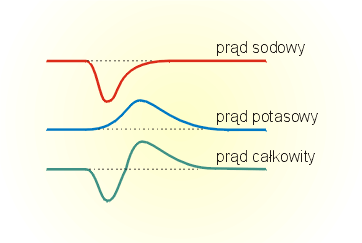
spoczynkowej.
Przebieg zmian prądów: sodowego i potasowego w trakcie potencjału czynnościowego przedstawiony jest na rysunku obok.
komórki glejowe izolujące, odbierające i odżywiające neurony
mięsień gładki
miesień sercowy
Włókna wolnokurczące zawierają wiele mitochondriów i duże stężenie mioglobiny (stąd zwane są też czerwonymi), co jest istotne, gdyż energię do skurczu czerpią z procesów tlenowych. Charakteryzują się one powolnym narastaniem siły skurczu i dużą wytrzymałością na zmęczenie.
Włókna szybkokurczące się (białe) zawierają mniejsze stężenie mioglobiny, kurczą się szybciej, ale są mniej wytrzymałe
izotoniczny - gdy zmienia się jego długość przy stałym poziomie napięcia mięśniowego
izometryczny - wzrasta napięcie mięśnia przy stałej długości (np. odkręcanie mocno przykręconych śrub, stanie, trzymanie ciężarów)
tężcowy - skurcze mięśni żwaczy (szczękościsk), skurcz mięśni twarzy (uśmiech sardoniczny), napadowe skurcze tężcowe mięśni karku
auksotoniczny - zmiana długości i napięcia mięśni (np. przy chodzeniu, bieganiu).
JON |
STĘŻENIE (mmol/l) |
POTENCJAŁ NERNSTA (mV) |
|
|
WEWNĄTRZKOMÓRKOWY |
ZEWNĄTRZKOMÓRKOWY |
|
Na+ |
15 |
140 |
+58 |
K+ |
135 |
4 |
-92 |
Ca2+ |
10-4 |
2 |
+129 |
H+ |
10-4 |
40x10-6 |
-24 |
Cl- |
4 |
120 |
-89 |
HCO3- |
10 |
24 |
-23 |
Wartość różnicy potencjałów przy której dochodzi do takiej równowagi nazywamy potencjałem równowagi (Nernsta).
TABELA: Potencjał Ernsta dla jonów zwykle obecnych w komórkach nerwowych i mięśniowych
Rodzaj jonu |
Stężenie zewnątrzkomórkowe |
Stężenie wewnątrzkomórkowe |
K+ |
4 mM |
140 mM |
Na+ |
144 mM |
ok 10 mM |
Cl- |
114mM |
ok 4 mM |
Oznacza to, że w stanie spoczynku, każdy z prądów jonowych ma różną od zera, stałą wartość, ich suma zaś wynosi zero. Stan spoczynku na błonie nie jest zatem stanem równowagi lecz stanem stacjonarnym, czyli takim w którym mimo braku równowagi termodynamicznej wartości parametrów opisujących stan układu nie zmieniają się.
Im większa jest przepuszczalność błony dla danego typu jonu, tym bardziej wartość potencjału spoczynkowego będzie zbliżona do potencjału Nernsta dla tego typu jonu. W związku z tym potencjał spoczynkowy jest zbliżony do potencjału Nernsta dla jonów potasowych, gdyż właśnie dla tych jonów błona jest najbardziej przepuszczalna w stanie spoczynku.
Mimo że prądy jonowe płynące przez błonę komórki w stanie spoczynku mają małe wartości, to jednak po pewnym czasie doprowadzałyby one do wyrównania wewnątrzkomórkowych i zewnątrzkomórkowych stężeń jonów.
Utrzymanie stałej różnicy stężeń jonów pomiędzy wnętrzem i otoczeniem komórki jest możliwe dzięki aktywnemu (tzn. wymagającego nakładu energii) transportowi zachodzącemu w przeciwnym - niż dyfuzja - kierunku. Klasycznym przykładem takiego aktywnego mechanizmu transportu jest pompa sodowo-potasowa.
Zmiany przepuszczalności błony dla poszczególnych typów jonów są możliwe dzięki obecności w błonie białek posiadających zdolność do regulacji przepływu przez nie jonów (kanałów jonowych). Otwieranie się lub zamykanie tych kanałów (selektywnie przepuszczających dany typ jonów) umożliwia komórce kontrolę nad przepływem prądów poszczególnych jonów.
Wyjaśnić tu jednocześnie należy, że wielokrotna generacja potencjałów czynnościowych- umożliwiająca przepływ jonów sodu i potasu w kierunku zgodnym z różnicą stężeń- w konsekwencji prowadziłaby do wyrównania zewnątrzkomórkowych i wewnątrzkomórkowych stężeń tych jonów. We wszystkich komórkach pobudliwych istnieje jednak mechanizm aktywnego transportu pompujący te jony wbrew różnicy stężeń i utrzymujący w ten sposób stężenia jonów na stałym poziomie.
Tkanka nerwowa
Przewodzi ona impulsy z neuronu do efektorów, od receptorów, przetwarza impulsy w adekwatne odpowiedzi, przewodzi impulsy z neuronu do innego neuronu, wytwarza substancje przekaźnikowe. Komórki nerwowe umożliwiają organizmowi normalne funkcjonowanie w danym środowisku, adekwatną odpowiedź w zależności od sytuacji w środowisku zarówno wewnętrznym jak i zewnętrznym. Tkanka nerwowa odbiera, przekazuje i reaguje na impulsy środowiska takie jak dotyk, temperatura czy światło. Neurony stale rejestrują i analizują informacje o stanie wewnętrznym organizmu i zewnętrznym stanie otoczenia, i przygotowuje organizm do reakcji. Do neuronów należy również koordynacja aktywności intelektualnej, świadomości, podświadomości, aktywności ruchowej czy też czynności gruczołów dokrewnych.
W skład tkanki nerwowej wchodzą:
Tkanka nerwowa ma bardzo słabe możliwości regeneracyjne. Narządami zbudowanymi z tkanki nerwowej jest ośrodkowy układ nerwowy czyli rdzeń kręgowy i mózg(mózgowie) oraz obwodowy układ nerwowy. Komórka nerwowa zbudowana jest z ciała komórki zawierającego jądro od niej odchodzą krótkie wypustki zwane dendrytami oraz jedna długa i rozgałęziona na końcu wypustka zwana neurytem. Dendryty odbierają bodźce i przekazują je do ciała komórki nerwowej, a stąd przez neuryt informacja trafia do następnej komórki nerwowej. Dzięki dendrytom i neurytom komórki nerwowe mogą spełniać swoje funkcje, czyli odbierać i przekazywać bodźce ze środowiska zewnętrznego i wewnętrznego do centralnego układu nerwowego- mózgu i rdzenia kręgowego.
Schemat budowy komórki nerwowej
Tkanka mięśniowa
Składa się z włókien mięśniowych, zbudowanych z miocytów (zespołów komórek mięśniowych), posiadających zdolność do aktywnego kurczenia się. Tkanka mięśniowa nie ma własnej substancji międzykomórkowej, a elementy mięśniowe połączone są ze sobą za pomocą tkanki łącznej wiotkiej. Pomimo obecności w komórkach mięśniowych jądra komórkowego oraz pewnej zdolności do podziału, ubytki w tkance mięśniowej tylko w niewielkim stopniu są uzupełniane.
Mięsień poprzecznie prążkowany szkieletowy - elementami strukturalnymi, z których zbudowany jest ten typ tkanki, są komórki wielojądrzaste, nazwane włóknami mięśniowymi. Dlatego też w każdym włóknie występuje od kilkudziesięciu do kilkuset jąder, które są położone na obwodzie komórki, pod błoną sarkoplazmatyczną. Włókna mięśniowe mają kształt walcowaty, długość ich sięga od 1 do 5 cm, niekiedy zaś nawet do kilkunastu centymetrów.
Mięsień gładki - działa niezależnie od woli i świadomości człowieka. Jest zdolny do ciągłego lecz bardzo powolnego kurczenia się. Jest elementem budowy naczyń, ścian przewodu pokarmowego, ścian moczowodów, pęcherza moczowego, cewki moczowej.
Mięsień sercowy - występuje tylko w mięśniu sercowym i choć przypomina budową mięśnia szkieletowego to wykorzystuje przede wszystkim procesy tlenowe i dzięki dobremu ukrwieniu jest zdolny do ciągłego wysiłku (okres odpoczynku tej tkanki to okres rozkurczu serca).
Tkanki mięśniowe, poprzecznie prążkowana serca i gładka unerwione są przez układ współczulny i działają niezależnie od woli człowieka. Natomiast mięśnie poprzecznie prążkowane, unerwione somatycznie, kurczą się zgodnie z wolą człowieka.
Wnętrze włókna wypełniają miofibryle czyli włókienka kurczliwe które biegną równolegle do siebie, wzdłuż osi długiej włókna, zebrane w pęczki oddzielone od siebie sarkoplazmą, która zawiera miglobinę i znaczne ilości ziaren glikogenu.
W komórkach tkanki mięśniowej znajdują się liczne mitochondria, słabo rozwinięty układ Golgiego, zlokalizowany w pobliżu jądra oraz siateczka środplazmatyczna gładka. Siateczka śródplazmatyczna występuje w bezpośrednim sąsiedztwie włókien kurczliwych, tworząc bardzo regularny i skomplikowany układ kanalików podłużnych i poprzecznych. Kanaliki podłużne są elementami sieci sarkoplazmatycznej i noszą nazwę sarkotubul. Sarkotubule rozszerzają się na obu końcach sarkomeru tworząc cysterny, które sąsiadują z poprzecznie leżącymi kanalikami utworzonymi w wyniku wypuklenia się sarkolemmy- są to tzw. kanaliki pośrednie T. Do kanalików T przylegają cysterny sąsiadujących kanalików siateczki śródplazmatycznej tworząc tzw. triady. Za pośrednictwem tego systemu kanalików odbywa się wymiana substancji między miofibrylami a środowiskiem zewnętrznym, przewodzenie bodźców skurczowych oraz transport jonów wapnia, niezbędnych do skurczu włókien mięśniowych.
Włókna mięśniowe dzieli się pod względem morfologicznym i czynnościowym na :
Mięśnie człowieka zawierają oba rodzaje włókien, a ich wzajemny stosunek jest różny u różnych ludzi. U sportowców uprawiających dyscypliny siłowe przeważają włókna typu białego. Trening wytrzymałościowy powoduje zwiększenie potencjału tlenowego mięśni przez zwiększenie liczby naczyń kapilarnych w mięśniach.
Budowa włókienek kurczliwych - miofibryli jest bardzo złożona. Nie mają one jednorodnej struktury, lecz składają się z jaśniejszych i ciemniejszych odcinków, leżących na przemian. Jaśniejsze odcinki zbudowane są z substancji pojedynczo załamującej światło - są to tzw. prążki izotropowe I, prążki ciemniejsze izotropowe jak i anizotropowe leżą we wszystkich miofibrylach na długiej osi włókna mięśniowego, wskutek czego powstaje wrażenie poprzecznego prążkowania całego włókna. Wykonanie skurczu następuje dzięki występowaniu w nich miofibryli, czyli włókienek kurczliwych zbudowanych z łańcuchów polipeptydowych. Efektywność ruchu w mięśniach jest możliwa dzięki ścisłemu ułożeniu włókien mięśniowych, pomiędzy którymi nie występuje żadna inna tkanka. Mechanizm działania miofybryli jest aktualnie przedmiotem dyskusji naukowej i istnieją na ten temat dwie rozbieżne teorie.
Fragment miofibryli (jest znacznie dłuższa) z Układ miofilamentów cienkich i grubych
widocznymi prążkami ciemnymi i jasnymi w sarkomerze w fazie rozkurczu (A) i w
wynikającymi z regularnego układu miofilamentów fazie skurczu (B)
tworzących sarkomery (granice między sarkomerami
wskazane strzałkami)
Skurcz mięśnia jest to proces skracania się włókien mięśniowych. Poruszanie się organizmu możliwe jest dzięki synchronizowanemu skurczowi różnych grup mięśniowych. W przypadku mięśni szkieletowych skurcz jest efektem potencjałów powstałych w mózgu w korze ruchowej. Skurcz mięśni gładkich oraz mięśnia sercowego odbywa się bez udziału woli, jednak niższe elementy ośrodkowego układu nerwowego wywierają znaczny wpływ na powstawanie i modyfikację siły skurczu. Skurcz mięśnia jest to zmiana długości lub napięcia mięśnia, wywierająca siłę mechaniczną na miejsca przyczepu mięśnia lub wokół narządu otoczonego przez mięsień okrężny (np. jamy ustnej)
Skurcze mięśni dzielimy na:
Skurcz mięśni szkieletowych
Potencjał czynnościowy osiąga akson neuronu ruchowego, który powoduje wnikanie jonów wapnia do wnętrza komórki poprzez napięcie błony komórkowej i aktywację kanałów wapniowych. Potencjał czynnościowy aktywuje kanały wapniowe zależne od napięcia Pod wpływem zwiększonego stężenia wapnia, pęcherzyki zawierające acetylocholinę łączą się z błoną komórkową uwalniając neurotransmiter do szczeliny złącza nerwowo- mięśniowego. Acetylocholina dyfunduje przez szczelinę, łącząc się na jej drugim końcu z receptorami nikotynowi, co powoduje otwarcie kanałów sodowych i potasowych zlokalizowanych w błonie komórkowej miocytu. Przewaga jonów sodu powoduje polaryzację błony komórkowej i powstanie dodatniego potencjału czynnościowego. Retikulum endoplazmatyczne komórki mięśniowej uwalnia jony wapnia, które łączą się z białkiem troponiną połączoną z aktyną i tropomiozyną. Troponina zmienia konfigurację przestrzenną tropomiozyny, co doprowadza do odsłonięcia miejsc kontaktu znajdujących się na włóknie aktynowym, umożliwiając przyłączenie się miozyny. Główki miozyny po połączeniu z aktyną, pod wpływem ATP przesuwają się, doprowadzając do przemieszczenia się włókienek względem siebie i odłączają się od aktyny jest możliwe dzięki obecności jonów wapnia. Wapń jest aktywnie wpompowywany z powrotem do zbiorników retikulum endoplazmatycznego. Tropomiozyna wraca do pierwotnej konfiguracji, blokując miejsca wiązania miozyny na aktynie.
Skurcz mięśni gładkich
Skurcz inicjowany jest przez napływ jonów wapnia do wnętrza komórki, które następnie łączą się z białkiem kalmoduliną. Kompleks wapń-kalmodulina łączy się i aktywuje kinazę lekkich łańcuchów miozyny. Kinaza lekkich łańcuchów miozyny dokonuje fosforylacji lekkich łańcuchów miozyny, przez co zmienia ich konfigurację przestrzenną, umożliwiając przyłączenia się filamentów aktynowych. Następuje skurcz.
Wyszukiwarka
Podobne podstrony:
Tkanki zwierzęce 1 nablonkowa 2 nerwowa 3 mięśniowa 4łączna
Złącze nerwowo mięśniowe
Choroby nerwowo-mięsniowe(1), fizjoterapia
metody oceny AUN, choroby nerwowo-mięśniowe
Zmiany wyglądu twarzy po uszkodzeniu nerwów i mięśni twarzy
Choroby nerwowo miesniowe
priopercepcja i kontrola nerwowo mięśniowa w fizjoterapii ortopedycznej
Choroby nerwowo mięśniowe
Psychologia ogólna - Biologiczne Mechanizmy Człowieka - Móżg, Mózg (mózgowie) - największe skupienie
Choroby nerwowo mięśniowe
choroby nerwowo mięśniowe
Choroby nerwowo mięśniowe
ŚRODKI BLOKUJĄCE PRZEWODNICTWO NERWOWO MIĘŚNIOWE
więcej podobnych podstron