laboratoria z fizyki
WYZNACZANIE CIEPŁA TOPNIENIA I PAROWANIA
Otaczająca nas materia może występować w trzech stanach skupienia : stałym, ciekłym i gazowym. Stan skupienia ciała zależy od tego, jaką energię kinetyczną posiadają drobiny ciała. Średnia energia kinetyczna ruchu drobin jest miarą temperatury bezwzględnej. W przypadku gazu doskonałego, średnia energia kinetyczna drobin wyraża się zależnością :
![]()
gdzie: k - stała Boltzmana (k = 1,38 . 10-23 J/K)
T - temperatura w skali bezwzględnej
Dostarczając energię z zewnątrz powodujemy wzrost temperatury ciała, jak również doprowadzamy do przejść fazowych. Przebieg tych procesów pokazano na wykresie
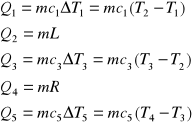
Na wykresie przedstawiono również zapisane pod nim równania określające wartości ilości ciepła Q pobranego lub oddanego w poszczególnych etapach przejść substancji o masie m od temperatury T1 do temperatury T4 . W równaniach tych występują ciepła właściwe c1, c3, c5 oraz ciepło topnienia (krzepnięcia) L i ciepło parowania (skraplania) R, gdzie
![]()
![]()
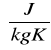
Jeżeli stykające się ze sobą ciała mają różne temperatury to następuje między nimi wyrównanie energii prowadzące do wyrównania średniej energii kinetycznej drobin (czyli do wyrównania temperatur). Ilość przekazanej energii nazywamy ilością dostarczonego lub pobranego Q.
Do pomiaru ilości ciepła używamy kalorymetru. Typowy kalorymetr składa się z dwóch naczyń metalowych. Wewnętrznie naczynie Nw ustawione jest na izolacyjnej podstawce J, co zapobiega wymianie ciepła między naczyniami.
KALORYMETR
Nw - naczynie wewnętrzne
Nz - naczynie zewnętrzne
A - izolatory
M - mieszadełko
T - termometr
Ciepło topnienia wyznaczamy korzystając z równania bilansu cieplnego. Równanie to układamy na podstawie wykresu na którym widać, że pewne ciała oddają ciepło, a inne taką samą ilość ciepła pobierają. W przypadku układu zawierającego kalorymetr, wodę i lód można zbudować następujący wykres bilansu
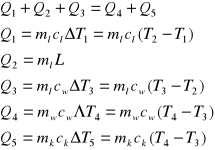
Z wykresu widać, że pewną ilość ciepła pobierają: lód na podniesienie temperatury (Q1), lód na stopnienie (Q2) oraz woda uzyskana z lodu na podniesienie temperatury do temperatury końcowej (Q3). Oddaje ciepło woda w kalorymetrze (Q4) oraz wewnętrzne naczynie kalorymetru z mieszadełkiem (Q5). Korzystające z równania bilansu, możemy wyznaczyć ciepło Q2 :
![]()
a wstępnie L:
![]()
Ponownie jest proces przejścia ze stanu ciekłego w stan gazowy i zachodzi w każdej temperaturze, ale tylko ze swobodnej powierzchni cieczy. Szybkość parowania zależy od rodzaju cieczy, wielkości jej powierzchni, temperatury. Im wyższa temperatura tym większa liczbą liczbę drobin uzyskuje energię kinetyczną, która pozwala na pokonanie sił spójności i opuszczenie ściany. Pomiar ciepła parowania realizujemy w ten sposób, że do naczynia nabieramy ilość wody określonego poziomem. Przeprowadzamy doświadczenie zgodnie z instrukcją i na podstawie wskazanych wyników pomiarów oraz wykresu bilansu możemy ułożyć równanie bilansu cieplnego, a następnie wyznaczamy wartość ciepła parowania R:
Q = L mpR=Vit
![]()
![]()
SPRAWOZDANIE
PPRZYRZĄDY
dwa kalorymetry
grzałka
woltomierz
amperomierz
waga laboratoryjna
termometr
A) CIEPŁO PAROWANIA
Tabela pomiarowa I
mw+k [kg] |
mw+k' [kg] |
mp [kg] |
t [s] |
U [V] |
I [A] |
R [J/kg] |
R [cal/g] |
1,4078 |
1,2090 |
0,1988 |
600 |
225 |
3,6 |
2444668 |
584,01 |
1.układamy równanie bilansu cieplnego i obliczamy ciepło parowania wody
objaśnienia:
mw+k - masa wody i kalorymetru przed podgrzaniem
mw+k' - masa wody i kalorymetru po podgrzaniu
mp - masa pary wodnej
R - ciepło parowania wody
U - napięcie prądu w układzie
I - natężenie prądu w układzie
mp = mw+k - mw+k' = 1,4078 - 1,2090 = 0,1988 [kg]
ciepło oddane Q0 = Qp ciepło pobrane
Q0 = UIt
Qp = mpR
Jut = mpr
![]()
![]()
![]()
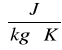
1 cal . g-1 . oC-1 = 4186 J . kg-1 . K-1 R = 584,01 [cal/g]
2.obliczamy błąd pomiaru metodą różniczki zupełnej
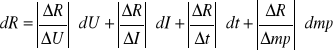
dU = 1V
dI = 0,1A
dt = 1s
dmp = 0,0001kg
![]()
![]()
![]()
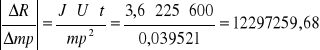
dR = 10865,1911 . 1 + 679074,4467 . 0,1 + 4074,4466 . 1 + 12297259,68 . 0,0001
dR = 84076,8
![]()
%
B) CIEPŁO TOPNIENIA
Tabela pomiarowa II
mk [kg] |
mk+w [kg] |
mk+w+l [kg] |
mw [kg] |
ml [kg] |
T4 [s] |
T1 [s] |
T3 [s] |
L [J/kg] |
L [cal/g] |
0,3140 |
1,3647 |
1,3914 |
1,0507 |
0,0267 |
34,3 |
-21 |
30,4 |
530213,8 |
126,6 |
objaśnienia:
mk - masa kalorymetru
mk+w - masa kalorymetru i wody
mw - masa wody
ml - masa lodu
T5 = T4 - temperatura początkowa kalorymetru i wody
T1 - temperatura początkowa wody (lodówki)
T3 - temperatura końcowa
T2 = 0oC
ck = 896 [J . kg-1 . K-1]
cw = 4190 [J . kg-1 . K-1]
cl = 2100 [J . kg-1 . K-1]
Q1 - ciepło pobrane przez lód w trakcie jego ogrzewania
Q2 - ciepło pobrane przez lód w trakcie jego topnienia
Q3 - ciepło pobrane przez wodę powstałą z lodu w trakcie jej ogrzewania
Q4 - ciepło oddane przez wodę
Q5 - ciepło oddane przez kalorymetr
1.układamy równanie bilansu cieplnego i wyznaczamy ciepło topnienia lodu L
![]()
![]()
![]()
![]()
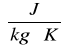
1 cal . g-1 . oC-1 = 4186 J . kg-1 . K-1 L = 126,6 [cal/g]
2.Obliczamy błąd pomiaru metodą różniczki zupełnej
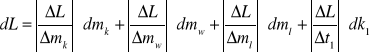
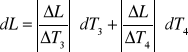
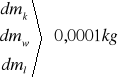
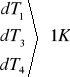
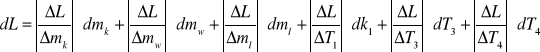
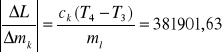
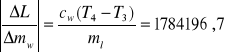
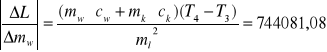
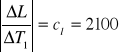
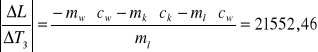
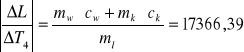
dL = 1784196,7 . 0,0001 + 38190,63 . 0,0001 + 2100 . 1 + 21662,46 . 1 +
+ 17366,39 . 1 + 744081,08 . 0,0001 = 41385,49
![]()
wyznaczanie ciepłą topnienia i parowania
8
topnienie
krzepnięcie
parowanie
skraplanie
sublimacja
resublimacja
T
T1
T2
T3
T4
Q1
Q2
Q3
Q4
Q5
Q
WYKRES PRZEJŚĆ FAZOWYCH ORAZ ZMIAN TERMICZNYCH CIAŁA PRZY DOSTARCZENIU ENERGII LUB JEJ ODEBRANIU
T
M
Nw
Nz
A
T1
T2
T3
T4 = T5
Q1
Q2
Q3
Q4
Q5
WYKRES ORAZ RÓWNANIA BILANSU CIEPLNEGO
Q5 = 1125,376
Q4 = 17609,732
Q3 = 3400,93
Q2 = 14156,7
Q1 = 1177,47
T4 = T5 = 34,3
T3 = 30,4
T2 = 0
T1 = -21
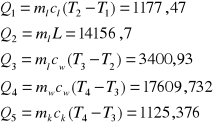
Wyszukiwarka
Podobne podstrony:
Przedstawić graficznie i omówić oddziaływania międzyatomowe w ciele stałym, Akademia Morska Szczecin
Badanie zależnosci oporu metalu i polprzewod od temp, Akademia Morska Szczecin Nawigacja, uczelnia,
jos5, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ściśle tajne, Zoo
ratownictwo-poprawione, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!,
Wzmacniacz Operacyjny 2.5, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!
EURPOEJSKIE PROCESY INTEGRACYJNE, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować
Rezonans szeregowy 1, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ś
Kwity-Łączność-EPECJA, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!,
MF-HF Z PRZYSTAWKĄ DSC- 9+11, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego
RATOWANIE ŻUCIA NA MORZUst, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!
NAWIGACJA, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ściśle tajne
BiS - sem 1 - wykład 12, Akademia Morska Szczecin Nawigacja, uczelnia, AM, BISSy, I sem, Bissy wykła
manewrowanie, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ściśle ta
OCHRONA ŚRODOWISKA MORSKIEGO, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego
koło II sem v.3.0, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ściś
PORADA-ZAL, Akademia Morska Szczecin Nawigacja, uczelnia, AM, AM, nie kasować tego!!!!!, Ściśle tajn
Bis - sem 1 - wykład 4, Akademia Morska Szczecin Nawigacja, uczelnia, AM, BISSy, I sem, Bissy wykład
BiS - sem 1 - wykład 8, Akademia Morska Szczecin Nawigacja, uczelnia, AM, BISSy, I sem, Bissy wykład
więcej podobnych podstron