Kolokwium 2. Magdalena Pawełkiewicz 30.11.2010 r.
Transformacja - (definicja mikrobiologiczna wg Griffitha 1929) zmiana fenotypu organizmu przez wprowadzenie obcego DNA do jego genomu;
- zmiana genetycznych właściwości komórki (organizmu) spowodowana pobraniem DNA wyizolowanego z innej komórki i włączeniem go do aparatu genetycznego
Metody transformacji:
bezwektorowe:
- elektroporacja (transformacja protoplastów)
- PEG (transformacja protoplastów)
- mikrowstrzeliwanie
- mikroinekcja
- wytrząsanie zawiesiny komórek z włóknami szklanymi
- wprowadzanie DNA zamkniętego w liposomach
wektorowe:
- Agrobacterium tumefaciens
- Agrobacterium rhizogenes
Agrobacterium tumefaciens:
Gramm (-), wolnożyjąca bakteria glebowa nalężąca do rodziny Rhizobiaceae
Polifag
Wywołuje chorobę określaną jako rak szyjki korzeniowej (crown gall disease)
Infekuje rośliny dwuliścienne oraz kilka roślin jednoliściennych np. Asparagus officinalis, Z. mays, T. aestivum
Plazmid Ti (tumor inducing plasmid) zawierający fragment T-DNA
Agrobacterium rhizogenes:
Gramm (-), wolnożyjąca bakteria glebowa nalężąca do rodziny Rhizobiaceae
Wywołuje chorobę przerostów korzeniowych - włośnikowatość
Plazmid Ri (Rootinducing plasmid) zawierający fragment T-DNA
Plazmid Ti:
Plazmid indukujący tumory (ang. Tumor inducing plasmid)
Wlk. Ok. 200 kpz
Występuje w komórce w małej liczbie kopi (1-2)
Replikuje niezależnie od chromosomu bakteryjnego
Może być przenoszony między komórkami Agrobacterium na drodze koniugacji
T-DNA:
Obszar przenoszony do komórek roślinnych w postaci ssDNA
Wyznaczony przez specyficzne 25 nukleotydowe sekwencje graniczne (RB-right border, LB-left border)
Geny obszaru T-DNA nie ulegają ekspresji w komórkach Agrobacterium
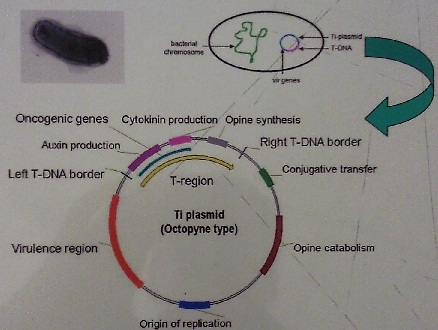
W obszarze T-DNA znajdują się:
Geny syntezy opin
Geny syntezy hormonów roślinnych (auksyn i cytokinin)
Opiny - pochodne aminokwasów głównie argininy, żródło C i N dla bakterii; 3 klasy opin: -oktopina, - nopalina, -agropina
Onkogeny - geny syntezy fitohormonów:
Auksyn
IaaM (monooksygenaza tryptofanu)
IaaH (hydrolaza indoloacetamidowa)
Cytokinin
ipt (transferaza izopentylowa)
Transfer T-DNA:
Przyczepienie się Agrobacterium do komórek roślinnych
- geny chromosomalne: chvA, chvB, pscA, att
Zranione komórki produkują związki fenolowe chemoatraktanty - np. Acetosyringon (stymulacja genów vir)
Przeniesienie T-DNA do komórki roślinnej
- geny wirulencji (vir; 24 geny zgrupowane w 8-u operonach: A, B, C, D, E, F, G, H)
Model przeniesienia i integracji T-DNA
Nić T przenoszona jest w postaci kompleksu DNA-białko
Białko na końcu 5' T-DNA wchodzi w interakcję z roślinnym DNA i nacina je
Jednoniciowe T-DNA jest przyłączane do jednej nici DNA a powstałe napięcia rozrywają drugą nić
Końce nici T ligowane z DNA i dosyntetyzowana jest 2 nić komplementarna do nici T
Często dochodzi do rearanżacji w obszarze
Wprowadzenie DNA do komórki Agrobacterium
Klonowanie i modyfikowanie DNA dokonuje się w plazmidach E.coli
Plazmid ze skonstruowanym genem jest przenoszony do Agrobacterium za pomocą:
- koniugacji
- rekombinacji homologicznej
Konstrukcja integrowanego DNA
Organizacja i orientacja sekwencji DNA (transgenu), która ma być wprowadzona do genomu roślinnego, zależy od tego jakich zmian oczekuje się w roślinie transgenicznej np.: nadekspresja, represja, tkankowo- swoista ekspresja, ekspresja regulowana warunkami środowiska
Sekwencja DNA musi mieć odpowiednią organizację sekwencji kodującej i regulatorowej
Konstrukcje zawierają fragmenty genów różnych organizmów i tworzy się je poprzez cięcie specyficznymi enzymami restrykcyjnymi i ligację
Budowa konstrukcji genomowej
Promotory - sekwencje DNA nieodczytywane, sygnalizujące gdzie trzeba zacząc odczytywanie kodu DNA. Do nich przyłącza się bardzo ważne białko enzymatyczne - polimeraza RNA. To właśnie ono dokonuje syntezy mRNA. Konstytutywne, tkankowo specyficzne, indukowane: chemiczne określonymi warunkami środowiskowymi
Terminatory - sekwencje DNA nieodczytywane, które dają znak polimerazie RNA w którym miejscu ma zakończyć transkrypcję
Agrobacterium tumefaciens - narzędzie inżynierii genetycznej
Opracowano metody wprowadzenia dowolnego genu do obszaru T-DNA A.tumefaciens, tak aby gen został wprowadzony do komórek roślinnych.
Aby obce geny wprowadzić do obszaru T-DNA należało przekonstruować plazmid Ti.
Analiza procesu integracji T-DNA i wiele innych eksperymentów pozwoliły ostatecznie opracować konstrukcję dwóch wektorów:
Kointergarcyjnego - sekwencje wprowadzane do genomu roślin są na samym plazmidzie co geny vir (czyli jest to plazmid Ti po rekombinacji z plazmidem pośrednim)
Binarnego - sekwencje wprowadzane genomu roślin i geny vir są na różnych plazmidach (A.tumefaciens posiada rozbrojony plazmid Ti z obszarem wirulencji i plazmid binarny z obszarem T-DNA)
Przygotowanie pożywek
Dla bakterii
Dla roślin
Regeneracyjne
Selekcyjne z antybiotykami
Antybiotyki są wrażliwe na wysoką temperaturę i dodajemy je do pożywki po sterylizacji - antybiotyki sterylizuje się przez filtrowanie
Otrzymanie roślin do transformacji
Sterylizacja i wysiew nasion
- dla każdego materiału roślinnego należy dobrać najbardziej właściwe warunki sterylizacji rodzaj, stężenie, czas działania subst sterylizującej. Kompromis: sterylność a uszkodzenie
Podchloryn - w celu zapewnienia lepszej penetracji czynnika sterylizującego:
- moczenie w alkoholu etylowym; dodanie detergentu
Kiełkowanie
Nasiona po sterylizacji są umieszczane w płytkach Petriego lub słoikach na pożywkach umożliwiających ukorzenienie się tych roślin
Wzrost siewek i roślin w kontrolowanych warunkach w fitotronie
Prekultura (kondycjonowanie)
Kompetencjędo regeneracji i transformacji można zwiększyć w wyniku prekultury na pożywkach.
Przez co stres spowodowany uszkodzeniem tkanek nie nakłada się na stres wynikający z kokultury.
Nie zawsze jest korzystne.
Cięcie eksplantatów
Eksplantaty = materiał roślinny, z którego inicjowana jest kultura.
Najczęściej są to fragmenty jakiegoś organu.
Eksplantaty są pobierane z liści i fragmentowane na kawałki o wielkości ok. 5x5 mm.
Cięcie może odbywać się na szalce w cienkiej warstwie pożywki MS.
Przygotowanie Agrobacterium
Przeprowadzamy pasaż na płytkach z pożywką YEB i prowadzimy hodowlę w 28oC.
Po 2 dniach zakładamy płynną kulturę bakterii.
Wirujemy bakterie.
Osad bakterii rozpuszczamy w pożywce do inokulacji, którą zalejemy przygotowane i pocięte eksplantaty.
Inokulum z bakteriami musi mieć odpowiednią gęstość.
Inokulacja - kokultura
Eksplantaty zalewa się przygotowaną pożywką z bakteriami.
Czas i zagęszczenie?
Do zranionych krawędzi „przyczepia” się Agrobacterium i następuje transfer T-DNA do możliwie dużej liczby komórek.
Im dłuższy czas kokultury tym trudniej wyeliminować bakterie i dłużej trwa stres rośliny.
Inokulacja i kokultura wzmacniają procesy stresowe eksplantatu.
Elimanacja Agrobacterium
Po stresie kokultury bakterie powinny zostać jak najszybciej wyeleminowane (potencjał regeneracyjny).
Stosuje się płukanie eksplantatów w antybiotyku i dodawanie go do pożywki regeneracyjnej.
Skuteczne stężenia antybiotyków nie są neutralne dla tkanek roślinnych.
Mimo podawania antybiotyków w kolejnych pasażach, bakterie mogą przetrwać przez cały okres kultury.
Wykładanie eksplantatów na pożywki regeneracyjne i selekcyjne
Stosowanie czynnika selekcyjnego zaraz po zakończeniu kokultury może zahamować regenerację.
Selekcja powinna:
- wyeliminować lub osłabić komórki, które nie uległy transformacji
- komórki transgeniczne mają aktywne geny
I nie powinny negatywnie reagować na antybiotyk ,
Wybór strategii selekcji zależy od promotora i genu markerowego, reakcji tkanek i sposobu regeneracji.
Regeneracja roślin
Po 2-3 tygodniach pojawia się kalus na eksplantatach w miejscu zranienia
Po 6 tygodniach pojawiają się pędy, które są odcinane od kalusa
Ukorzenianie
Po zregenerowaniu pędów rośliny są gotowe do ukorzeniania i przekłada się je na pożywki do ukorzeniania po 9 tygodniach
Rośliny transgeniczne
W pełni zregenerowane rośliny, które wyrosły na pożywkach selekcyjnych
Otrzymuje się je po ok. 12 tygodniach
Z pożywki do ziemi
Ukorzenia się rośliny po selekcji przenosi się do doniczek z ziemią
Ok. 13 tygodnia
Efektywność transformacji - wyrażana jest najczęściej procentem eksplantatów, z których zregenerowano transgeniczny pęd
Czynniki wpływające na efektywność transformacji (można podzielić na związane z):
Rośliną - gatunek, genotyp, eksplantat, pożywki regeneracyjne, zmienność somaklonalna układu regeneracyjnego
Agrobacterium - szczep (geny wirulencji: pAL4404 i pSB131), stabilność konstrukcji genowej, przygotowanie Agrobacterium (acetosyringon, gęstość, pożywka)
Interakcją Agrobacterium - roślina - reakcja na stres zranienia i stres spowodowany przez inokulację, reakcja na antybiotyki, kompetencja komórek do transformacji
Transformacja - wprowadzenie pożądanych cech dzięki wprowadzeniu jednego lub kilku genów
Transfer genów do roślin uprawnych:
Stosunkowo precyzyjny i przewidywalny
Zmiany są subtelne
Pozwala na dowolność sterowania
Korzystne cechy
Otrzymanie roślin transgenicznych jest możliwe tylko w przypadku integracji transgenu z genomem takiej komórki, która posiada lub nabierze kompetencji do regeneracji.
Wysoka kompetencja do transformacji nie jest równoznaczna z wysoką kompetencją do regeneracji i odwrotnie (wiek, organy, genotyp).
Korzystnie jest używać eksplantatów z kultur in-vitro.
Cechy rośliny transgenicznej (Potrykus 1990):
Transgen trwale zintegrowany z genomem
Jedna kopia transgenu
Ulega poprawnej ekspresji
Dziedziczy się w sposób mendlowski
Jak się robi GMO - wykorzystanie naturalnego sposobu transformacji - wprowadzania genów (konstrukcji genowych) przez Agrobacterium tumefaciens, wywołującą raka bakteryjnego.
Jak sprawić żeby odtwarzane rośliny powstawały wyłącznie z transformowanych komórek?\
Wprowadzenie odpowiednich genów:
- odporności na różne substancje chemiczne
- dających łatwo zauważalny i jednoznaczny efekt
Testowanie otrzymywanych roślin
Dlaczego używa się genów markerowych podczas transformacji roślin?
Wyselekcjonowanie transgenicznych komórek/roślin - marker selekcyjny
Wizualizacja ekspresji transgenu geny reporterowe.
Określenie ilościowe poziomu ekspresji genów
Markery selekcyjne
Markery nadające zdolność do przeżycia w warunkach selekcyjnych
- odporność na sntybiotyki
- odporność na herbicydy
- odporność na fitotoksyny
Markery letalne
- np. selekcja mutantów supresorów ekspresji genu
Geny reporterowe - pozwalają na wizualizację ekspresji genu
Histologiczne - pozwalają określić fenotyp na potraktowaniu substratem lub podczas obserwacji w specjalnych warunkach
Morfologiczne - zmiany w morfologii roślin np. brak włosków
Związane z pigmentacją - związane z produkcją antocjanów
oznaczenie ilościowe poziomu produktu genu:
Acetylotransferaza chloramfenikolu CAT
B-D-glukuronidaza GUS
Lucyferaza luc, luxA/B
Fosfotransferaza neomycyny NPTII
Odporność na antybiotyki |
|||
Marker selekcyjny |
Czynnik selekcyjny |
Mechanizm działania |
Pochodzenie |
Fosfotransferaza neomycyny (npt) |
Kanamycyna Genetycyna /G418 (inhibicja translacji) |
Detoksyfikacja czynnika selekcyjnego |
E.coli |
Fosfotransferaza higromycyny (hpt) |
Higromycyna B (inhibicja translacji) |
Detoksyfikacja czynnika selekcyjnego |
E.coli |
Tolerancja na herbicydy |
|||
Syntaza glutaminowa (GS) |
Dialafos, Glufosinat (prekursory BASTY) (inhibicja syntazy glutaminowej) |
Nadprodukcja zmutowanego białka (niewrażliwego) |
Medicago sativo |
Acetylotransferaza fosfinotriciny (bar, PAT) |
Fosfinotricina BASTA (jak wyżej) |
Detoksyfikacja |
Streptomyces hygroscopicus |
Syntaza EPSPS (aroA) |
Glyfosat ROUNDUP (inhibicja syntazy EPSPS) |
Nadprodukcja zmutowanego białka (niewrażliwego) w chloroplastach |
Arabidopsis thallana, Escherichia coli, Petunia hybrida, Salmonella typhimurium |
Najpowszechniej używane geny reporterowe |
|||
Nazwa |
Substrat pozwalający na wizualizację |
Fenotyp |
Pochodzenie |
B-D-glukuronidaza gus, uidA |
X-glue |
zabarwienie w kolorze indygo |
E.coli |
Białko zielonej fluoroscencji gfp5-ER |
światło: 395 lub 465 nm |
zielona fluoroscencja 509 nm |
Meduza |
Charakterystyka roślin transgenicznych:
PCR: eliminacja pędów nie posiadających insertu
Southern - blot: stwierdzenie poprawności integracji i liczby kopii transgenu, przypadki wprowadzenia od 1 do 6 kopii transgenu, lokalizacja w genomie jest losowa
Northern - blot: analiza ekspresji transgenu na poziomie mRNA
Western - blot lub test ELISA: gdy wprowadzony gen determinuje powstawanie białka
Integracja transgenów w genomie roślinnym
Do komórki roślinnej może przykleić się do 200 komórek Agrobacterium - zwykle jedna bakteria wytwarza jeden kompleks T-DNA
Genom roślinny - jest złożony (zróżnicowany) zmienia swą strukturę zależnie od fazy cyklu życiowego komórki (pętle i matrix)
Na poziomie chromatyny
Heterochromatyna
Euchromatyna
Na poziomie chromosomu
Obszary telomerowe i centromer
Obszary sekwencji powtórzonych
Obszary zawierające geny sekwencji MAR
Miejsce integracji T-DNA w genomie jest losowe (AT)
Może dochodzić do rearanżacji w obszarze T-DNA podczas lub po integracji
Agrobacterium - precyzyjne wycięcie ściśle zdefiniowanego obszaru T-DNA, ale
Dokładne wycięcie T-DNA w pobliżu prawej sekwencji granicznej mniej dokładne a czasami brak przecięcia nici T-DNA w pobliżu lewej sekwencji granicznej
Tak więc:
Są przykłady zintegrowania całego plazmidu Ti w genomie roślinnym lub fragmentów różnice w precyzji wycinania T-DNA pomiędzy szczepami.
Rośliny transgeniczne na rynku
Rośliny z genem Bt są chronione przed atakiem owadów, zmniejszają zużycie pestycydów. Rośliny wytwarzają białka toksyczne dla niektórych owadów.
Kukurydza, bawełna, ziemniaki
plany: słonecznik, soja, rzepak, pszenica, pomidory
Rośliny tolerancyjne na herbicydy, rolnicy mogą stosować specyficzne herbicydy do walki z chwastami, bez uszkodzenia uprawy.
Soja, bawełna, kukurydza, rzepak, ryż
plany: pszenica, buraki cukrowe
Rośliny odporne na choroby, uzbrojone do walki z chorobami wirusowymi.
Słodkie ziemniaki, maniok, ryż, kukurydza, dynia, papaja
plany: pomidory, banany
Oleje spożywcze, redukcja obróbki przed sprzedażą, zdrowsza żywność.
słonecznik, orzeszki ziemne, soja
Opóźnione dojrzewanie owoców i warzyw i zwiększenie zawartości części stałych do produkcji past i sosów. Pomidory - lepszy smak, kolor, lepsze do transportu, dłuższa świeżość.
plany: porzeczki, truskawki, wiśnie, banany, ananasy
Ulepszona żywność o podwyższonym poziomie związków mineralnych, witamin, antyoksydantów i innych związkach pochodzenia roślinnego. Walka z głodem krajów rozwijających się, chorobami i zdrowa żywność.
Grupy roślin uprawnych, u których wartość linii/odmian transgenicznych sprawdzono w warunkach polowych (OECD Product Database)
Rośliny warzywne - cebula, szparagi, kapusta, brokuły, papryka, cykoria, arbuz, melon, ogórek, cukinia, marchew, bataty, sałata, pomidor, oberżyna
Motylkowe - soja, łubin, lucerna, groch
Rośliny sadownicze - kiwi, papaja, kasztanowiec, truskawka, orzech włoski, jabłoń, śliwa, winorośl, żurawina
Rośliny oleiste - orzech ziemny, gorczyca, rzepik, rzepak, słonecznik, gorczyca biała
Rośliny zbożowe - jęczmień, ryż, kukurydza, pszenica
Rośliny ozdobne - goździk, mieczyk, pelargonia, róża
Drzewa leśne i ozdobne - świerk, sosna, topola, brzoza, eukaliptus
Inne - burak cukrowy, bawełna, len, tytoń, trzcina cukrowa, ziemniak
Korzyści płynące z biotechnologii:
Dostarczanie właściwych mikroelementów - np. ryż o większej zawartości wit. A, żelaza aby zwiększyć zawartość wit. E w oleju roślinnym
Pomoc w ochronie przeciw chorobom człowieka - np. soja i rzepak o zwiększonej zawartości zdrowszych nienasyconych tłuszczy, ziemniaki o zwiększonej zawartości skrobi
Redukcja toksyn - np. kukurydza odporna na owady ma mniejszy poziom mykotoksyn w kolbach
Jadalne szczepionki - np. ziemniaki zawierające szczepionkę przeciwko wirusowi żółtaczki B
Redukcja alergenów w pożywieniu - np. rozwinięcie technik pozwalających na identyfikację i neutralizację czynników alergennych w materiale genetycznym ryżu, pszenicy, orzeszków ziemnych i innych pokarmach
Zmniejszenie alergii nie związanych z jedzeniem - np. zmodyfikowanie rośliny produkującej latex, który powoduje alergie a dodatkowo potania to koszty z porównaniu z tradycyjną metodą produkcji (brazylijskie drzewa kauczukowe)
Biotechnologia a globalne rolnictwo - korzyści!
Czynnik środowiskowy - zmniejszenie zużycia pestycydów
Zmniejszenie strat powodowanych przez choroby i szkodniki
Poprawa jakości produktów
Nowe produkty
Poprawa produktywności
Jakość po zbiorach - wydłużone przechowywanie owoców, warzyw i kwiatów
Zwiększona liczba odmian (czasu ich uprawy)
Tolerancja na stresy - susza, zakwaszenie, zasolenie, wysoka temp.
Bardziej wartościowa żywność i zdrowa żywność - mniej toksyn
Białka dla przemysłu farmaceutycznego
Biotechnologia - ćwiczenia 2010/2011
12
Wyszukiwarka
Podobne podstrony:
biotechnologia wykład pytania, Ogrodnictwo, Semestr VII, Biotechnologia
BIOTECHNOLOGIA wyklady przepisane, Ogrodnictwo, Semestr VII, Biotechnologia
biotechnologia wykład test - pytania nie powtarzajace sie, Ogrodnictwo, Semestr VII, Biotechnologia
Biot pyt rozwiazania, Ogrodnictwo, Semestr VII, Biotechnologia
Ekonomika. Wersja dobra. Mały projekt, Ogrodnictwo, Semestr VII, Ekonomika
sciaga na ekonomike, Ogrodnictwo, Semestr VII, Ekonomika, Ekonomika
Dendrologia opracowane pytania na kolokwium 1, Ogrodnictwo, Semestr II, Dendrologia
Praca dyplomowa - czcionki itd, Ogrodnictwo, Semestr VII, Seminarium
maly projekt , Ogrodnictwo, Semestr VII, Ekonomika, Ekonomika
Ekonomia wyklady, Ogrodnictwo, Semestr VII, Ekonomika, Ekonomika, Ekonomika
Dzialy specjalne produkcji rolnej, Ogrodnictwo, Semestr VII, Ekonomika
odpowiedzi (1)2004, Ogrodnictwo, Semestr VII, Ekonomika, Ekonomika, Ekonomika
ekon, Ogrodnictwo, Semestr VII, Ekonomika, Ekonomika, Ekonomika
Przechowalnictwo sadow, Ogrodnictwo, Semestr VII, Przechowalnictwo
chryzantemy 2, Ogrodnictwo, Semestr VII, Nowoczesne metody uprawy
chryzantemy 1, Ogrodnictwo, Semestr VII, Nowoczesne metody uprawy
więcej podobnych podstron