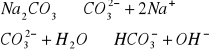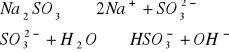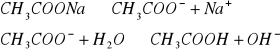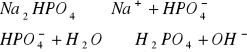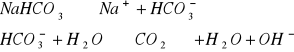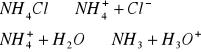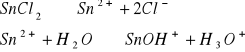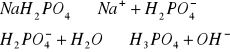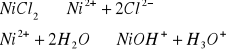nr cwicz. 3 |
data
|
Krzysztof Pittner |
Wydzial Technologii chemicznej |
Semestr I |
grupa IPC |
|
przygotowanie |
wykonanie |
ocena ostatecz. |
||
Odczyn roztworów wodnych soli
Zgodznie z definicją kwasów i zasad według Bronsteda kwasem jest substancja zdolna do oddania protonów a zasadą substancja do przyłączenia protonu i związane są zależnością:
![]()
gdzie HA to kwas a ![]()
sprzężona z nim zasad. Reakcja odszczepienia protonu może przebiegać tylko wtedy gdy w środowisku reakcji znajduje się zasada zdolna te proton przyjąć. To między nimi może dojść do reakcji zgodnej ze schematem:
![]()
gdzie HA oraz ![]()
to kwas B i ![]()
to zasada. W myśl tej zasady możemy sformułować twierdzenia ,że kationy mogą być kwasami a aniony zasadami.
Amfolity są to związki które w zależności od sytuacji mogą być albo kwasem albo zasadą. Przykładem amfolitów jest woda oraz etanol:
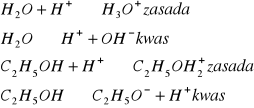
Wykonanie ćwiczenia
Odczyn środowiska w roztworach różnych soli.
W zlewce o pojemności 25 cm3 kolejno rozpuścić łyżeczkę wskazanych przez prowadzącego 5 soli, następnie zmierzyć pH roztworu ( napisać równania kationu jako kwasu lub anionu jako zasady). Wyniki zastawić w tabeli. Wskazać jon niewywierający wpływu na pH.
Wyznaczanie stałej kwasowej.
Przenieść do zlewki na 20 cm3 0,2 M r-ru ZnCl2 i zmierzyć jego pH.
Wpływ stężenia soli na pH roztworu.
Zmierzyć pH 0,1 M i 0,01 M r-ru NH4Cl oraz 0,2 M i 0,02 M r-ru Na2CO3
Opracowanie wyników
L.p |
sól |
pH |
Równanie kationu jako kwasu lub anionu jako zasady |
1 |
|
10,65 |
|
2 |
|
9,66 |
|
3 |
|
7,3 |
|
4 |
|
9,2 |
|
5 |
|
8,54 |
|
6 |
|
7,1 |
|
7 |
|
7,2 |
|
8 |
|
6,2 |
|
9 |
|
2 |
|
10 |
|
4,5 |
|
11 |
|
5,5 |
|
Wyznaczanie stałej kwasowej 0,2 M r-ru ZnCl2:
C ZnCl2- 0,2mol/dm3 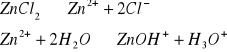
pH=6,54
Korzystamy ze wzoru na pH słabego kwasu: ![]()
Następnie przekształcamy wzór tak aby wyznaczyć pka
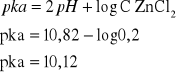
Sprawdzenie wpływu stężenia soli na pH:
0,1 M i 0,01 M r-ru NH4Cl
a) C= 0,1mol/dm3 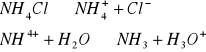
pka=9,2 ![]()
pH=5,1
b) C= 0,01mol/dm3 Do obliczenia używam wzoru podanego powyżej
pH=5,6
2 a) 0,2 M i 0,02 M r-ru Na2CO3
C Na2CO3=0,2 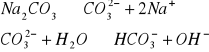
![]()
pH=11,8
b) C Na2CO3=0,02mol/dm3 do obliczania pH korzystam ze wzoru podanego powyżej:
pH=11,3
Wnioski: Jak widać w punkcie 1 na pH roztworów soli wpływają jony pochodzące ze słabego kwasu lub słabej zasady, których ilość decyduje o stężeniu kwasu ![]()
.
W punkcie 2 wyznaczaliśmy stałą kwasową. Obliczony wynik różni się od wartości podanej w tabelach, która wynosi: pka=9. Nie dokładność wyników może być spowodowana błędnym działaniem phmetru, z którym mieliśmy częste problemy podczas pomiarów.
W toku obliczeń dokonanych w punkcie 3 widać, że stężenie roztworów ma znaczący wpływ na pH roztworu.
Wyszukiwarka
Podobne podstrony:
Cw3 Odczyn roztworow wodnych soli, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia o
Hydroliza soli i pH roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.
Przewodnictwo roztworow, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, Przewodnictwo rozt
Przewodnictwo roztworów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.labork
kationy, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Chemia mat. bud, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemi
sciaga na egzmin, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki
sprawko z osadów, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organic
6!!!!!!!!!, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
hydroliza, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.chemia.laborki, Chemia - I
sprawko cw1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
sprawozdanie z cw 4, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie orga
redoksy part1, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie organiczna
Badanie substancji błonotwórczych, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, 1sem.che
Cw12 Rozdzial przez stracanie, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogoln
ćw.5 Ania, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki
Cw10 Reakcje utleniania i redukcji, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia
więcej podobnych podstron