Leki p/b*lowe (analgetyczne) - są to leki przeznaczone do walki z b*lem. B*l jest to subjektywne odczucie powstaj*ce na skutek podra*nienia wolnych zako*cze* do*rodkowych neuron*w czuciowych. Zako*czenia te reaguj* na bod*ce fizyczne, mechaniczne (ucisk) i chemiczne powstaj*ce w procesie uszkodznia tkanek (wzrost st**enia jon*w wodorowych, zewn*trzkom*rkowy wzrost stężenia jon*w potasu, uwolnienie histaminy, bradykininy, serotoniny i acetylocholiny). Bod*ce te generuj* w zako*czeniach nerwowych impuls b*lowy. Obecno** prostaglandyn zwi*ksza wra*liwo** zako*cze* czuciowych na dzia*anie „zwyczajnych” bod*c*w b*lowych typu mechanicznego, termicznego i chemicznego.
Impulsy b*lowe przekazywane s* neuronami do*rodkowymi do synaps znajduj*cych si* w rogach tylnich istoty szarej rdzenia kr*gowego, sk*d przekazywane s* na neurony wst*puj*ce szlaku rdzeniowo-wzg*rzowego do wzg*rza. Tam impuls przekazywany jest na trzeci neuron (pasmo wzg*rzowo-korowe), kt*rym biegnie on do pola czuciowego kory m*zgowej, znajduj*cego si* w p*atach ciemieniowych, które odpowiedzialne jest za powstanie czucia b*lu.
B*l towarzyszy wielu chorobom zar*wno o przebiegu ostrym jak i przewlek*ym. Ma tak*e znaczenie alarmowe, poniewa* ostrzega przed bod*cami uszkadzaj*cymi tkanki. Je*eli b*l nie ustaje po usuni*ciu jego przyczyny, to mo*e on sta* si* przyczyn* wstrz*su zagra*aj*cego *yciu.
W zwalczaniu b*lu ogromne znaczenie ma leczenie farmakologiczne polegaj*ce na podawaniu lek*w p/b*lowych (analgetica).
Leki analgetyczne ze wzgl*du na si** i mechanizm dzia*ania oraz ze wzgl*du na budow* chemiczn* dzielimy na dwie podstawowe grupy:
1). Narkotyczne leki p/b*lowe - opioidy (opiaty) - charakteryzuj* si* bardzo silnym dzia*aniem p/b*lowym; w du*ych dawkach powoduj* g**boki, bezodruchowy, narkotyczny sen, co jest wynikiem depresyjnego wp*ywu opioid*w na o*rodkowy uk*ad nerwowy. Wi*kszo** z nich dzia*a euforyzuj*co i uzale*niaj*co.
2). Nienarkotyczne leki p/b*lowe - charakteryzuj* si* stosunkowo s*abym dzia*aniem p/b*lowym (w por*wnaniu z opioidami). Nie dzia*aj* euforyzuj*co i nawet w bardzo du*ych dawkach nie wywo*uj* snu narkotycznego. Nie s* one obdarzone dzia*aniem swoistym, ponieważ opr*cz w*a*ciwo*ci p/b*lowych wykazuj* one dzia*anie p/gor*czkowe i cz*sto p/zapalne.
W celu z*agodzenia b*lu stosuje si* niekiedy tr*jpier*cieniowe leki psychotropowe o w*a*ciwo*ciach p/depresyjnych takie jak: Amitriptylina, Clomipramina, Imipramina.
NARKOTYCZNE LEKI P/BÓLOWE
Opioidy dzia*aj* za pomoc* swoistych receptor*w, kt*re to nazwano receptorami opioidowymi (ich istnienie zosta*o potwierdzone w roku 1973). Istnieje sze** typ*w receptor*w opioidowych, wśród których wyr**nia si* trzy zasadnicze grupy:
∗ receptory μ (mi);
∗ receptory δ (delta);
∗ receptory κ (kappa);
Receptory te zlokalizowane s* w r**nych okolicach m*zgu, rdzenia kr*gowego, a tak*e w splocie *r*d*ciennym odpowiedzialnym za regulacj* czynno*ci uk*adu pokarmowego i układu moczowo-p*ciowego. Endogennymi agonistami receptor*w opioidowych s* aktywne biologicznie peptydy o budowie zbliżonej do morfiny. Wyr**nia si* trzy rodzaje endogennych opioid*w: enkefaliny, endorfiny, dynorfiny. Peptydy te powstaj* na skutek rozpadu odpowiednich bia*ek prekursorowych i r**ni* si* mi*dzy sob* liczb* i sekwencj* aminokwas*w w *a*cuchu peptydowym.
Endogenne opioidy (podobnie zreszt* jak i opioidy egzogenne) wykazuj* powinowactwa do okre*lonego typu receptora opioidowego:
Enkefaliny - zawieraj*ce pi** aminokwas*w w *a*cuchu peptydowym s* agonistami g**wnie receptor*w δ i w niewielkim tylko stopniu receptor*w μ.
Endorfiny - r**ni* si* mi*dzy sob* liczb* aminokwas*w w *a*cuchu, w zwi*zku z czym wyr**niamy endorfiny α, β, i γ. Endorfina β sk*adaj*ca si* z 31 aminokwas*w i wykazuje du*e powinowactwo do receptor*w μ i δ. Wykazuje najsilniejsze działanie p/b*lowe wśród endorfin (3 - 4 razy silniej od morfiny).
Dynorfiny - pierwsz* odkryt* dynorfin* by*a dynorfina A, kt*ra jest 17-aminokwasowym peptydem wykazuj*cym najwi*ksz* selektywno** wzgl*dem receptora κ i tylko nieznaczne powinowactwo do receptor*w μ i δ. Dynorfina A dzia*a silniej p/b*lowo od morfiny i od β-endorfiny.
PODZIAŁ OPIOIDÓW
ZE WZGLĘDU NA POCHODZENIE I CHEMIZM
1. Naturalne pochodne epoksy-morfanu;
2. P**syntetyczne pochodne epoksy-morfanu
- p**syntetyczne pochodne morfiny
- p**syntetyczne pochodne kodeiny
- p**syntetyczne pochodne orypawiny
3. P**syntetyczne pochodne epoksy-morfanu o dzia*aniu antagonistycznym stosowane jako antidotum przy zatruciu opioidami;
4. Syntetyczne pochodne morfinanu;
5. Syntetyczne pochodne benzomorfanu;
6. Syntetyczne pochodne piperydyny;
- pochodne 4-fenylopiperydyny
- pochodne piperydynopropionanilidu
7. Pochodne 3,3-difenylopropyloaminy oraz ich analogi strukturalne;
PODZIAŁU OPIOIDÓW
WEDŁUG TYPU DZIAŁANIA NA RECEPTOR
opioidy o działaniu czysto agonistycznym
Wyr**niamy tutaj Morfin*, Fentanyl, Petydyn*; zwi*zki te działaj* na wszystkie typy receptor*w opioidowych, ale najwi*ksze powinowactwo wykazuj* w stosunku do receptor*w μ. Charakteryzuj* si* wysok* aktywno*ci* wewn*trzn*, szczeg*lnie tego typu aktywno*ci*, kt*ra daje efekt analgezji i depresji o*rodka oddechowego.
opioidy o działaniu czysto antagonistycznym
Do tej podgrupy nale*y Naloxon. Zwi*zki te nie wykazuj* aktywno*ci wewn*trznej, ale charakteryzuj* si* silnym powinowactwem do receptor*w opioidowych typu μ, δ i κ, przy czym najsilniej dzia*aj* na receptory μ. W zwi*zku z tym powinowactwem konkuruj* one z agonistami o miejsce wi***ce receptora i blokuj* go. Zwi*zki te s* stosowane jako odtrutka przy zatruciu opioidami oraz w diagnostyce uzale*nie* opioidowych.
opioidy o działaniu agonistycznym
ze względnie silnym działaniem antagonistycznym
Do tej grupy tej należą Butorfanol, Nalbufine, Ibuprenorfine. Środki te dzia*aj* p/b*lowo silniej od morfiny, wykazuj* natomiast s*absze w*a*ciwo*ci narkotyczne i maj* tak*e mniejszy od niej potencja* uzale*niaj*cy.
opioidy o działaniu antagonistycznym
z komponentą działania agonistycznego
Mo*emy tutaj zaliczy* Nalorfine, która dzia*a silnie antagonistycznie na receptory μ, wykazuje s*abe powinowactwo w stosunku do receptor*w κ (dzia*a na nie jako cz**ciowy antagonista), natomiast w stosunku do receptor*w δ zachowuje si* jako agonista (selektywno** Nalorfiny wobec tego receptora jest tak*e niewielka). Nalorfina stosowana jest jako antidotum i jako lek p/b*lowy.
opioidy o działaniu agonistyczno-antagonistycznym
*rodkiem zaliczanym do tej grupy jest np. Pentazocyna, która dzia*a na ka*dy typ receptora, przy czym to dzia*anie mo*e przybiera* r**ne formy, od dzia*nia agonistycznego, poprzez dzia*anie cz**ciowo agonistyczne, a* do dzia*ania antagonistycznego.
opioidy o działaniu częściowo agonistycznym
Lekiem należącym do tej grupy jest Tramadol, który stymuluje receptory opioidowe, ale charakteryzuje si* bardzo małą aktywno*ci* wewn*trzn*. W por*wnaniu z pe*nymi agonistami leki tej grupy dzia*aj* s*abo p/b*lowo i to dzia*anie nie pot*guje si* mimo zwi*kszania dawek.
Wzgl*dna si*a dzia*ania analgetycznego - stosunek dawki morfiny do dawki innego okre*lonego opioidu, potrzebnej do wywo*ania podobnego efektu analgetycznego jak przy u*yciu morfiny (w tym celu si*a dzia*ania analgetycznego morfiny przyj*ta zosta*a za standart i jest r*wna jedno*ci).
∗ analgetyki bardzo silnie dzia*aj*ce: Fentanyl (100-300); Alfentyl (40-50);
∗ analgetyki s*abo dzia*aj*ce: Pentazocyna (0,3); Kodeina (0,2); Petydyna (0,1);
∗ analgetyki s*abo dzia*aj*ce: Naloxon (0,001);
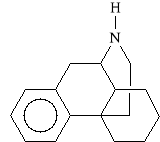
Struktura i właściwości morfiny
jako leku modelowego
UKŁAD MORFINIANU |
MORFINA |
|
4,5-epoksy-17-metylomorfin-7-en-3,6-diol |
Morfina pod wzgl*dem chemicznym jest pochodn* oktahydrofenantrenu (wzgl*dnie pochodn* oktahydroizochinoliny lub piperydyny). Z uwagi na obecno** grupy hydroksylowej w pozycji 6 mo*e ona by* traktowana jako drugorz*dowy alkohol, przy czym uk*ad morfiny wykazuje w*a*ciwo*ci amfoteryczne (o w*a*ciwo*ciach kwasowych decyduje obecno** ugrupowania fenylowego, natomiast o w*a*ciwo*ciach zasadowych decyduje ugrupowanie N-metylowe).
Morfina, podobnie jak fenole, *atwo si* utlenia. Jest zwi*zkiem optycznie czynnym, posiada aż pi** asymetrycznych atom*w w*gla (pozycje: 5, 6, 9, 13 i 15).
Pod wzgl*dem farmakologicznym morfina nale*y do czystych agonist*w receptorów μ oraz do cz**ciowych agonist*w receptora δ i κ. Dzia*a zar*wno o*rodkowo jak i obwodowo.
d z i a * a n i e o * r o d k o w e m o r f i n y
∗ dzia*a p/b*lowo na poziomie wzg*rza, kory m*zgowej i rdzenia kr*gowego, hamuj*c przewodzenie bod*c*w b*lowych i percepcj* b*lu;
∗ dzia*a uspokajaj*co, powoduje senno**, spowalnia procesy my*lowe;
∗ po podaniu do*ylnym poprawia nastr*j, dzia*a euforyzuj*co;
∗ hamuje o*rodek kaszlu (dzia*a wi*c p/kaszlowo);
∗ pobudza o*rodek wymiotny (przy dłuższym podawaniu dzia*a p/wymiotnie);
∗ w du*ych dawkach wywo*uje sen narkotyczny; dawki te s* bliskie dawkom przy kt*rych nast*puje pora*enie o*rodka oddechowego, dlatego te* morfina nie jest u*ywana jako narkotyk chirurgiczny;
d z i a * a n i e o b w o d o w e m o r f i n y
∗ hamuje perystaltyk* jelit powoduj*c zaparcia spastyczne w obr*bie przewodu pokarmowego;
∗ utrudnia wydzielanie ***ci i moczu na skutek skurczu g*adkomi**niowych zwieraczy w przewodach ***ciowych i drogach moczowych (morfina nie mo*e wi*c by* stosowana w celu z*agodzenia b*lu w kolce w*trobowej i nerkowej);
∗ hamuje czynno** skurczow* macicy (z tego te* wzgl*du nie mo*e by* ona stosowana do łagodzenia b*li porodowych);
∗ obkurcza *renice oczu;
Wi*kszo** opioid*w dzia*a podobnie, a r**nice dotycz* tylko si*y i czasu dzia*ania. Niekt*re opioidy dzia*aj* silniej kurcz*co na mi**nie g*adkie np. Buprenorfina, Pentazocyna, inne z kolei dzia*aj* spazmolitycznie jak np. Petydyna. W przeciwie*stwie do morfiny, Petydyna i Pentazocyna nie hamuj* akcji porodowej - mog* by* zatem u*yte do *agodzenia b*li oko*oporodowych.
Morfina jest silnym opioidem ale dzia*a stosunkowo kr*tko. Stosowana jest w b*lach ostrych i przewlek*ych, ma szczeg*lne znaczenie w znoszeniu b*lu towarzysz*cego chorobie nowotworowej. Morfina nie tylko wp*ywa na percepcj* b*lu, ale tak*e zmienia reakcj* psychiczn*.
W lecznictwie morfina stosowana jest w postaci chlorowodorku (Morphini hydrochloridum) oraz siarczanu (Morphini sulfas). Podawana jest doustnie, do*ylnie, podsk*rnie i doodbytniczo.
W zej*ciowych stanach choroby nowotworowej morfin* stosuje si* zazwyczaj doustnie - podaje si* j* wtedy co 4 godziny (w postaci wodnego roztworu chlorowodorku morfiny) lub co 12 godzin (w postaci tabletek zawierających siarczan morfiny o kontrolowanym wydzielaniu substancji czynnej). Dawki doustne musz* by* wi*ksze ni* dawki podawane pozajelitowo, poniewa* morfina nie ca*kowicie wch*ania się z przewodu pokarmowego, a ponadto wch*oni*ta ju* morfina ulega szybkiemu metabolizmowi.
D*u*sze stosowanie morfiny wywo*uje tolerancj* i uzale*nienie psychofizyczne, kt*re po odstawieniu leku objawia się ostrym stanem abstynencji, wymagaj*cym leczenia szpitalnego. Stosowanie morfiny wi**e si* ponadto z niebezpiecze*stwem przedawkowania i *mierci na skutek pora*enia o*rodka oddechowego.
zależność budowy od działania opioidów
* aktywność farmakologiczną wykazują tylko izomery lewoskrętne;
* estryfikacja lub eteryfikacja grupy alkoholowej w pozycji 6 zwiększa siłę działania opioidów;
* utlenianie grupy alkoholowej do ketonowej zwiększa sześć razy siłę działania p/bólowego;
* obecność podwójnego wiązania między C7 a C8 nie ma większego znaczenia dla działania leków;
* podstawnik przy azocie w pozycji 17 jest istotnym elementem wpływającym na siłę działania i toksyczność opioidów:
- N-metylowe pochodne działają p/bólowo i p/kaszlowo;
- zastąpienia grupy metylowej podstawnikiem alkilowym lub fenylowym nie ma wpływu na siłę działania, zaś usunięcie grupy metylowej powoduje spadek siły działania i wzrost toksyczności;
- obecność przy azocie podstawnika allilowego, cyklopropylometylowego lub cyklobutylometylowego zmienia działanie z agonistycznego na antagonistyczne;
* mostek epoksydowy nie ma wpływu na działanie leku;
elementy strukturalne warunkujące działanie p/bólowe opioidów
* trzeciorzędowy atom azotu z małym podstawnikiem alkilowym;
* centralny czwartorzędowy atom węgla (w morfinie C13);
* obecność przy centralnym IV-rzędowym atomie węgla rodnika fenylowego;
* obecność elektroujemnego ugrupowania zawierającego tlen w sąsiedztwie centralnego IV-rzędowego atomu węgla (-OH; -CO-, -COO-);
* wymagana jest odpowiednia odległość między III-rzędowym atomem azotu a IV-rzędowym atomem węgla (odległość ta równa się łańcuchowi zawierającemu dwa atomy węgla);
1. Naturalne pochodne morfiny:
Codeini phosphas
fosforan 3-metoksy-6-hydroksy-4,5-epoksy-17-metylo-7-morfinianu
Kodeina działa silnie p/kaszlowo, słabo uspokajająco (10 razy słabiej od morfiny). Posiada minimalny potencjał uzależniający - należy do wykazu B. Bardzo rzadko wywołuje euforię. W organiźmie ulega metabolizmowi (w 10 % metabolizuje do morfiny).
Wchodzi w skład preparatów p/kaszlowych. Jest także stosowana do znoszenia słabych i umiarkowanych bóli nowotworowych. Dawka 15 - 30 mg powoduje wystąpienie działania p/kaszlowe przy braku działania p/bólowego.
2. Pochodne półsyntetyczne morfiny:
Ethylmorphini hydrochloridum (synonim: Dionina)
chlorowodorek 3-etoksy-6-hydroksy-4,5-epoksy-17-metylo-7-morfinianu
Lek wykazuje działanie p/bólowe 5 razy słabsze od morfiny, ale silniejsze od kodeiny. Działa także p/kaszlowo, ale słabiej od kodeiny. Wykazuje działanie uspokajające. Należy do wykazu B.
Nalbuphini hydrochloridum (synonim: Nubain)
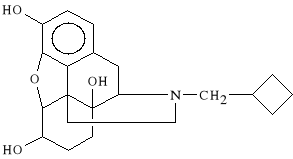
chlorowodorek 17-cyklobutylometylo-4,5-etoksy-3,6,14-trihydroksymorfinianu
Nubain wykazuje działanie p/bólowe zbliżone do morfiny. Wykazuje jednak mniejszą tendencję do zaparć oraz mniejszy potencjał uzależniający. Działa szybko i długo - około 6 h. Jest to lek stosowany w bólach pourazowych, porodowych, pooperacyjnych i w bólach zawałowych.
3. Półsyntetyczne pochodne kodeiny:
Dihydrocodeini bitartras (synonim: Paracodin)
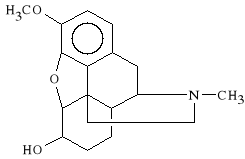
winian 3-metoksy-6-hydroksy-4,5-epoksy-17-metylomorfinianu
Paracodin należy do wykazu B. Działa p/kaszlowo silniej od kodeiny, a także uspokajająco i p/bólowo. Lek jest stosowany w suchym kaszlu. W przeciwieństwie do kodeiny działa zapierająco i powoduje zależność.
Oxycodoni hydrochloridum (synonim: Eucodalum)
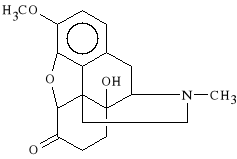
chlorowodorek 3-metoksy-6-okso-14-hydroksy-4,5-epoksy-17-metylomorfinianu
Powstaje z kodeiny na skutek redukcji wiązania podwójnego przy C7 i utlenienia grupy alkoholowej. Lek ten jest stosowany w injekcji w anestezjologii. Jest podawany przy wprowadzeniu do znieczulenia ogólnego. Stosuje się go jako lek p/bólowy przy zmienie opatrunków, a także w małych zabiegach chirurgicznych. Łatwo wywołuje uzależnienie.
SCOPHEDAL - oksykodon (p/bólowo), efedryna (p/depresyjnie), skopolamina (p/bólowo).
4. Półsyntetyczne pochodne orypawiny:
Buprenorphini hydrochloridum (synonim: Bunondol, Temgesic)
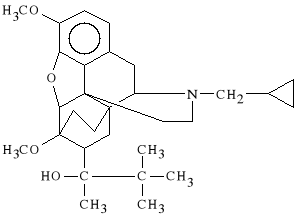
chlorowodorek 21-cyklopropylo-7-(1-hydroksy-1,22-trimetylopropylo)-
-6,14-endoetano-6,7,8,14-tetrahydroksyoripaniny
Bunondol wykazuje działanie analgetyczne silniejsze od morfiny. Posiada natomiast mniejszy od niej potencjał uzależniający; nie wywołuje stanów euforycznych. Stosuje się go jako lek p/bólowy przy braku skuteczności innych słabiej działających opioidów.
Dawkowanie: domięśniowo - działa 25 razy silniej od morfiny;
podjęzykowo - 60 - 70 razy silniej od morfiny;
5. Pochodne epoksymorfinianu:
Nalorphini hydrobromidum (synonim: Nalorphin)
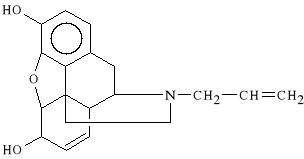
bromowodorek 3,6-dihydroksy-4,5-epoksy-17-allilo-7-morfinenu
Nalorphin działa p/bólowo na równi z morfiną; działa także p/kaszlowo. Znosi depresję ośrodka oddechowego. Jest lekiem stosowanym w położnictwie w depresji oddechowej u noworodków.
Naloxoni hydrochloridum (synonim: Naloxon, Narcan)
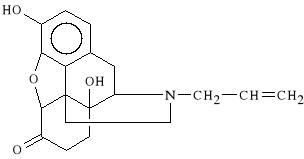
chlorowodorek 3,14-dihydroksy-6-okso-4,5-epoksy-17-N-allilomorfinianu
Jest czystym antagonistą receptorów opioidowych. Jest stosowany w celu zmniejszenia depresji oddechowej u noworodków. U osób uzależnionych od opioidów wywołuje zespół abstynencyjny.
6. Syntetyczne pochodne morfinianu:
Butorphanoli tartras (synonim: Moradol, Beforal)
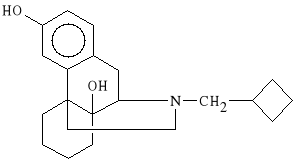
winian 17-cyklobutylometylo-3,14-dihydroksymorfinianu
Wykazuje właściwości agonistyczne z komponentem antagonistycznym (jest agonistą receptorów i antagonistą receptorów ). Działa 5 razy silniej od morfiny. Jest to lek stosowany w anestezjologii do premedykacji (wprowadzenie do znieczulenia ogólnego), a także do znoszenia bóli pooperacyjnych.
Levorphanoli tartras (synonim: Dromoran)
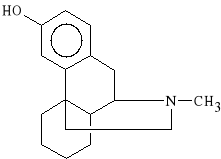
winian (-) 3-hydroksy-17-metylomorfinianu
Lek dobrze wchłania się z przewodu pokarmowego (efekt podania drogą pokarmową jest taki sam jak drogą podjęzykową). Izomer prawoskrętny jest nieczynny farmakologicznie. Lek stosuje się w ostrych bólach i w premedykacji.
7. Syntetyczne pochodne benzomorfanu:
Pentazocini hydrochloridum (synonim: Fortral, Dolapent)
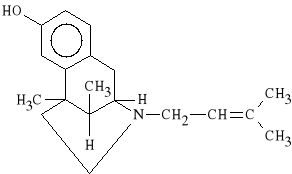
chlorowodorek 6,11-dimetylo-3-(3-metylo-2-butenylo)-2,6-dimetano-
-1,2,3,4,5,6-heksahydro-3-benzazocyn-8-ol
Działa 3 razy słabiej od morfiny (3 - 4 h). Lek jest stosowany w umiarkowanych bólach, w tym w bólach pooperacyjnych. Nie zwiększa napięcia mięśni gładkich, nie hamuje akcji porodowej. Cechuje go działanie psychomimetyczne (drażliwość, halucynacje, omamy).
8. Syntetyczne pochodne piperydyny:
Pethidini hydrochloridum (synonim: Dolargan, Dolcontral)
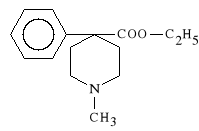
chlorowodorek estru etylowego kwasu N-metylo-4-fenylo-
-4-piperydyno-karboksylowego
Jest czystym antagonistą receptorów opioidowych o działaniu podobnym do morfiny. Działa jednak od niej słabiej. Nie wykazuje działania spastycznego na przewód pokarmowy i drogi żółciowe, jak również nie zwęża źrenic oczu. Nie hamuje także akcji porodowej.
Lek stosuje się w anestezjologii do znieczuleń (działa szybko i krótko), w kolce nerkowej i żółciowej. Służy do łagodzenia bólów porodowych.
Fentanyli citras (synonim: Fentanyl)
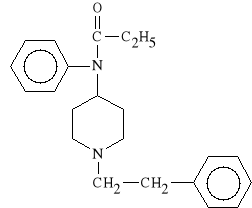
cytrynian N-(1-fenetylo-4-piperydylo)-propionanilidu
Lek działa p/bólowo 80 - 100 razy silniej od morfiny, ale znacznie krócej (około pół godziny). Jest stosowany w zawale mięśnia sercowego oraz w anestezjologii do premedykacji. Podawany przez skórę (w postaci plastrów) służy do zwalczania ostrych lub przewlekłych bólów, np. bóli stawowych.
9. Pochodne 3,3-difenylopropyloaminy:
Methadoni hydrochloridum (synonim: Ketalgin)
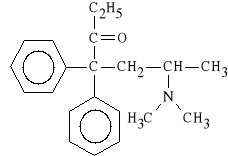
chlorowodorek 4,4-difenylo-6-dimetyloamino-heptan-3-onu
Lek ten jest silnym agonistą receptorów opioidowych. Stosuje się go w formie racematu. Izomer lewoskrętny działa kilkanaście razy silniej od prawoskrętnego. Izomer prawoskrętny wykazuje natomiast działanie p/kaszlowe. Racemat działa od 6 do 12 godzin, 2 - 4 razy silniej od morfiny.
Lek jest stosowany w anestezjologii do premedykacji, jak również do znoszenia bólów nowotworowych.
Dextromoramidi bitartras (synonim: Palfium)
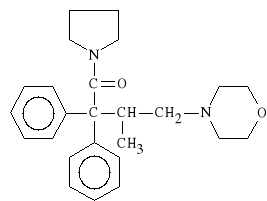
kwaśny winian 1-(2,2-difenylo-3-metylo-4-morfolinobutynylo)-pirolidyny
Działa szybciej i silniej od morfiny. Jest lekiem uzależniającym, wywołuje stany euforii. Wywołuje skurcz mięśni gładkich i słaby efekt depresyjny. Rzadko stosowany w terapii chorób nowotworowych.
NIENARKOTYCZNE LEKI P/BÓLOWE
Nienarkotyczne leki p/bólowe dzia*aj* znaczne s*abiej p/b*lowo ni* narkotyczne leki p/b*lowe. Stosowane s* g**wnie w *agodzeniu b*l*w migrenowych i neuralgii. Charakteryzuj* si* zmniejszon* selektywno*ci* i wybi*rczo*ci* dzia*ania, wiele z nich dzia*a tak*e p/gor*czkowo, p/zapalnie i p/reumatycznie. Dzia*anie p/gor*czkowe tych lek*w wynika z ich depresyjnego wp*ywu na o*rodek termoregulacji znajduj*cy si* w podwzg*rzu.
Nienarkotyczne leki p/b*lowe nie dzia*aj* euforyzuj*co, nie znosz* b*l*w trzewiowych, prawid*owo stosowane nie powoduj* lekozale*no*ci.
PODZIAŁ FARMAKOLOGICZNY
NIENARKOTYCZNYCH LEKÓW P/BÓLOWYCH
a). leki wykazuj*ce tak*e dzia*anie p/zapalne (niesteroidowe leki p/zapalne);
b). leki pozbawione dzia*ania p/zapalnego;
PODZIAŁ CHEMICZNY
NIENARKOTYCZNYCH LEKÓW P/BÓLOWYCH
I. Pochodne aromatycznych i heterocyklicznych kwasów karboksylowych:
1. Pochodne kwasu salicylowego;
2. Pochodne kwasu fenyloantralinowego i jego azaanalogi;
3. Pochodne heterocyklicznych endo- i okso- kwas*w karboksylowych:
a). oksykamy;
b). pochodne pirydopirymidonu;
II. Pochodne kwasów aryloalkanokarboksylowych:
1. Pochodne kwasu arylooctowego;
2. Pochodne kwasu arylopropionowego (profeny);
III. Oksopochodne pirazoliny i pirazolidyny:
1. Pochodne pirazolin-5-onu;
2. Pochodne pirazolidyno-3,5-dionu;
IV. Pochodne p-aminofenolu;
V. Zwi*zki heterocykliczne o charakterze zasadowym (stosowane w postaci soli addycyjnych z kwasami);
VI. Niesteroidowe środki p/zapalne o dzia*aniu swoistym - stosowane są jako leki drugiego rzutu w reumatoidalnym zapaleniu stawów;
1. Pochodne chinoliny;
2. Merkaptopochodne waliny;
3. Zwi*zki z*ota;
budowa niesteroidowych lek*w p/zapalnych (NSLP)
Leki te maj* kwa*ny charakter - s* to kwasy *redniej mocy (pKA=3-5). Wszystkie posiadaj* dwa charakterystyczne ugrupowania:
∗ ugrupowanie hydrofilowe: grupa karboksylowa lub enolowa;
∗ ugrupowanie lipofilowe: pier*cie* aromatyczny lub heterocykliczny;
Ugrupowanie hydrofilowe i lipofilowe nie powinny le*e* w jednej p*aszczy*nie. Je*eli do uk*adu aromatycznego wprowadzony zostanie podstawnik hydrofilowy to obserwowany b*dzie spadek dzia*ania p/zapalnego. Je*eli natomiast wprowadzony zostanie podstawnik lipofilowy np. heteroaryl lub fenyl to obserwowany b*dzie wzrost si*y dzia*ania p/zapalnego.
mechanizm dzia*ania niesteroidowych lek*w p/zapalnych (NSLP)
NSLP s* inhibitorami cyklooksygenazy COX (zar*wno COX1 jak i COX2) - enzymu katalizuj*cego utlenianie kwasu arachidonowego. Kwas arachidonowy pod wp*ywem COX przy**cza dwa atomy tlenu daj*c nietrwa*y endonadtlenek PGG2, kt*ry pod wp*ywem hydroperoksydazy daje nietrwa*y endonadtlenek PGH2 (T1/2 = 5 min.). PGH2 jest substratem do syntezy prostaglandyn, prostacykliny (PGI2) oraz tromboksanu (TXA2)
PGI2 - powstaje pod wp*ywem syntetazy prostacyklinowej; prostacyklina ta odpowiedzialna jest za hamowanie agregacji p*ytek krwi i rozkurcz naczyń.
TXA2 - powstaje pod wp*ywem syntetazy tromboksanowej; powoduje agregacj* p*ytek krwi oraz kurczy naczynia.
Prostaglandyny - s* mediatorami stanu zapalnego.
Niesteroidowe leki p/zapalne hamuj* syntez* prostanoid*w w r**nym stopniu. Wyr**niamy tutaj dwa typy dzia*ania inhibicyjnego:
∗ kompetencyjna interakcja z centrum aktywnym enzymu (COX)
∗ nieodwracalna inhibicja COX; w ten spos*b dzia*aj* np. salicylany, kt*re acyluj* grup* hydroksylow* seryny - aminokwasu obecnego w centrum aktywnym cyklooksygenazy. Niesteroidowe leki p/zapalne blokuja tak*e aktywno** innych enzym*w (proteaz, dekarboksylaz) odpowiedzialnych za tworzenie innych, endogennych mediator*w stanu zapalnego (histaminy, serotoniny, bradykininy). Poza tym leki te hamuj* aktywno** enzym*w lizosomalnych, kt*re tak*e bior* udzia* w powstawaniu stanu zapalnego.
Zahamowanie syntezy prostaglandyn mo*e wywo*a* lub nasili* objawy choroby wrzodowej *o**dka, poniewa* niekt*re prostaglandyny dzia**j* os*aniaj*co na *luz*wk* *o**dka.
POCHODNE AROMATYCZNYCH I HETEROCYKLICZNYCH
KWASÓW KARBOKSYLOWYCH
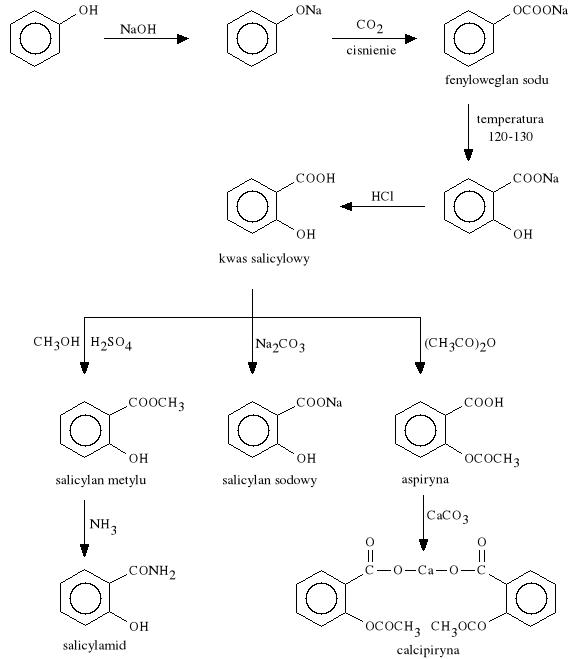
ad. 1. Pochodne kwasu salicylowego:
Acidum salicylicum
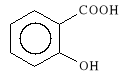
kwas 2-hydroksybenzoesowy
Podany doustnie silnie dra*ni b*on* *luzow* *o**dka, cz**ciej jest wi*c stosowany w postaci soli, estr*w i amid*w.
Wykazuje w*a*ciwo*ci p/zapalne i p/gor*czkowe tak*e p/b*lowe, hamuje procesy zapalne i zmniejsza obrz*k zapalny; obwodowo i o*rodkowo rozszerza naczynia krwiono*ne; jest tak*e s*abym lekiem bakteriob*jczym i grzybob*jczym.
Kwas salicylowy stosowany jest tak*e zewn*trznie w dermatologii. Dzia*a bowiem keratoplastycznie (rozmi*kczaj*co - ma** 1-2 %), keratolitycznie (z*uszczaj*co - ma** 20 %). Wykazuje r*wnie* w*a*ciwo*ci miejscowo - znieczulaj*ce.
Kwas salicylowy znalaz* zastosowanie g**wnie w leczeniu gor*czki reumatoidalnej.
Natrii salicylas (synonim: Natrium salicylicum)
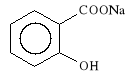
2-hydroksybenzoesan sodu
Lek szybko wch*ania si* z przewodu pokarmowego, dzia*a p/b*lowo, p/gor*czkowo i p/zapalnie.
PYRENOL - zawiera salicylan sodu, benzoesan sodu, tymol, kwas benzoesowy; preparat ten stosowany jest w ostrych i przewlek*ych stanach zapalnych oskrzeli i g*rnych dr*g oddechowych.
Cholini salicylas (synonim: Cholinex, Otinum, Sachol)
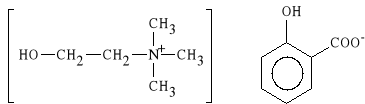
salicylan choliny
Lek wykazuje w*a*ciwo*ci p/b*lowe, p/zapalne i p/gor*czkowe, dzia*a tak*e miejscowo odka*aj*co. Jest dobrze tolerowany przez organizm.
Jest stosowany w pediatrii, w d*ugotrwa*ej terapii miejscowych stan*w zapalnych w obr*bie jamy ustnej, uszu i nosa, jak r*wnie* po ekstrakcji z*b*w oraz w chorobach reumatycznych.
Salicylan choliny jest dobrze rozpuszczalny w wodzie i alkoholu. Poniewa* jest sol* higroskopijn* nie jest stosowany w postaci tabletek tylko pastylek.
Diethylamini salicylas (synonim: Saldiam - krem)
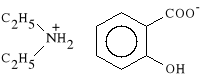
salicylan dietyloaminy
Lek wykazuje w*a*ciwo*ci p/b*lowe i p/zapalne. Jest stosowany miejscowo w postaci ma*ci i krem*w. Znalaz* zastosowanie w leczeniu miejscowych stan*w zapalnych, b*li mi**niowych spowodowanych przykurczami spastycznymi mi**ni, b*li reumatycznych oraz nerwob*li.
Ethylenoglycolis salicylas
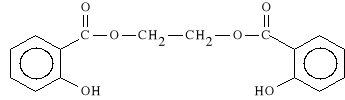
disalicylan glikolu
Stosowany jest miejscowo w postaci ma*ci, dzia*a p/zapalnie i p/b*lowo.
Methylis salicylas (synonim: Methylum salicylicum)
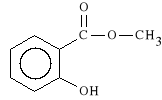
salicylan metylu
Lek dzia*a p/b*lowo, p/zapalnie, miejscowo dra*ni sk*r* i rozszerza naczynia krwiono*ne. Stosowany jest w b*lach stawowych, mi**niowych, reumatycznych i przezi*bieniowych; *agodzi tak*e nerwob*le.
Jest to g*sta, oleista, lipofilna ciecz, *atwo przenikaj*ca przez sk*r* - powoduje miejscowe rozszerzenie naczy* krwiono*nych i przekrwienie sk*ry.
*rodek ten jest stosowany zar*wno w postaci preparat*w prostych jak i z*o*onych:
∗ preparat prosty: Unguentum Menthyli salicylici;
∗ preparat z*o*ony: ANALGOLAN - zawiera salicylan metylu, kamfor*, olejek sosnowy i olejek terpentynowy. Analgolan jest preparatem o nieprzyjemnym zapachu i piek*cym smaku, *atwo przenikaj*cym przez sk*r* (wywo*uje miejscowe przekrwienie i rozgrzanie), dzia*a p/b*lowo i p/zapalnie; stosowany jest w chorobach reumatycznych, b*lach stawowych i mi**niowych, nerwob*lach np. rwie kulszowej, lumbago.
Phenylis salicylas (synonim: Salolum)
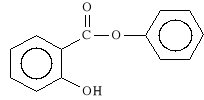
salicylan fenylu
Salol dzia*a p/b*lowo, p/gor*czkowo i p/bakteryjnie. Stosowany jest w nie*ytach jelit, w stanach zapalnych p*cherza moczowego, dr*g moczowych i ***ciowych oraz jelit. Wchodzi tak*e w sk*ad preparat*w do u*ytku zewn*trznego chroni*cych przed szkodliwym dzia*aniem s*o*ca.
Salicylamidum
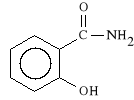
salicylamid (amid kwasu 2-hydroksybenzoesowego)
Jako amid jest wolniej metabolizowany do kwasu salicylowego ni* estry. Dzia*a p/zapalnie, p/gor*czkowo i p/b*lowo.
Stosowany jest w chorobach reumatycznych, go**cu stawowym, w zapaleniu korzonk*w stawowych.
SCORBOLAMID - zawiera salicylamid, kwas askorbowy, rutynozyd; preparat ten dzia*a p/wysi*kowo i p/b*lowo i stosowany jest w b*lach g*owy, grypie, w stanach przezi*bieniowych.
ISOCHIN - zawiera salicylamid, chlorowodorek chininy i kofein*; stosowany jest w stanach zapalnych g*rnych dr*g oddechowych.
Ethenzamidum (synonim: Euffekt)
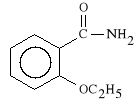
2-etoksybenzamid
Lek dzia*a p/b*lowo, p/zapalnie i s*abo p/gor*czkowo, w wi*kszych dawkach powoduje zwiotczenie mi**ni. Stosowany jest w leczeniu chor*b, kt*rym towarzyszy podwy*szona temperatura i b*l, a tak*e w b*lach g*owy, staw*w oraz w b*lach reumatycznych.
ETOPIRYNA - etenzamid, kwas acetylosalicylowy, kofeina; preparat ten stosowany jest w b*lach g*owy, w bólach go**cowych, przezi*bieniowych i reumatycznych (zamiast tabletek z krzy*ykiem).
ANTINEURALGIAE E - etenzamid, kwas acetylosalicylowy, karbromal; stosowany jest w stanach b*lowych na tle nerwowym.
Acidum aminosalicylicum (synonim: Mesalzinum, Salofalk)
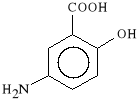
kwas 5-aminosalicylowy (5-ASA)
*rodek ten dzia*a g**wnie p/zapalnie. Stosowany jest w przewlek*ych chorobach zapalnych jelit, we wrzodziej*cym zapaleniu jelita grubego oraz w krwotocznym zapaleniu jelit.
Acidum acetylosalicylicum (synonim: Acesal, Polopiryna, Aspiryna, Rhonal)
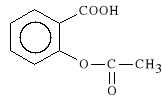
kwas 2-acetoksybenzoesowy
Kwas acetylosalicylowy w *rodowisku kwa*nym wyst*puje w formie niezjonizowanej, dlatego *atwo wch*ania si* z *o**dka. Nieodwracalnie wi**ąc cyklooksygenaz*, poprzez acetylacj* grup hydroksylowych seryny, hamuje syntez* prostaglandyn (w tym tak*e *o**dkowej prostaglandyny E, odpowiedzialnej za ochron* b*ony *luzowej *o**dka). Hamuje agregacj* p*ytek krwi w surowicy.
Lek ten dzia*a p/gor*czkowo, p/b*lowo, p/zapalnie, p/reumatycznie oraz napotnie. Stosowany jest w chorobach przezi*bieniowych, w gor*czce, oraz w reumatoidalnym zapaleniu staw*w, w b*lach g*owy, nerwob*lach, w b*lach zwi*zanych ze zmianami zwyrodnieniowymi staw*w, a tak*e w profilaktyce zawa*u mi**nia sercowego (w terapii przed i pozawa*owej wykorzystuje si* mniejsze dawki aspiryny np. preparaty Cardiopirin i Aspirin-Cardio zawieraj* 100 mg kwasu acetylosalicylowego).
Przeciwwskazaniem dla stosowania kwasu acetylosalicylowego jest choroba wrzodowa *o**dka i dwunastnicy, zaburzenia r*wnowagi kwasowo-zasadowej, skazy krwotoczne. U wrzodowc*w aspiryn* mo*na podawa* w postaci preparat*w, z kt*rych uwalnianie substancji czynnej odbywa si* w jelitach, a nie w *o**dku - preparat Rhonal wystepuje w postaci granulek pokrytych otoczk* odporn* na dzia*anie kwas*w. Otoczka ta spowalnia także proces uwalniania kwasu acetylosalicylowego. Aspiryna nie jest zalecana u dzieci.
Dawka dzienna aspiryny (dosis pro die) - 10,0
Dawka *miertelna aspiryny (dosis letalis) - 30,0 - 40,0
Preparaty z*o*one kwasu acetylosalicylowego zawieraj* zazwyczaj dodatki u*atwiaj*ce jego rozpuszczanie i wch*anianie lub zmniejszaj*ce w*a*ciwo*ci dra*ni*ce, niekt*re tak*e pot*guj* jego dzia*anie.
POLOPIRYNA C - kwas acetylosalicylowy, kwas askorbowy, kwas aminooctowy, kwas cytrynowy, wodorow*glan sodu.
POLOPIRYNA S - kwas acetylosalicylowy, kwas cytrynowy, w*glan wapnia, skrobia ziemniaczana.
ALKA-PRIM - kwas acetylosalicylowy, kwas aminooctowy, kwas cytrynowy, wodorow*glan sodu.
CALCIPIRYNA - kwas acetylosalicylowy, w*glan wapnia.
Metabolizm kwasu acetylosalicylowego i amidu kwasu salicylowego
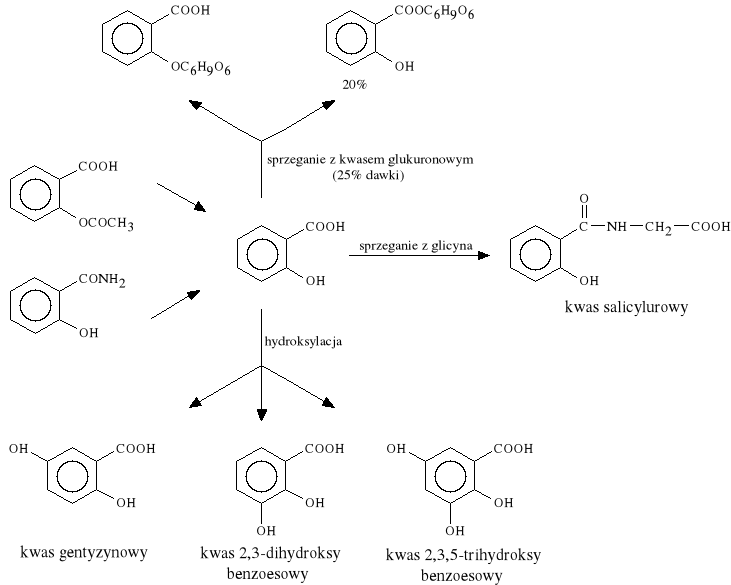
Synteza kwasu salicylowego i jego pochodnych
(metoda Kolbego i Schmidta)
ad. 2. Pochodne kwasu fenyloantralinowego i ich azaanalogi:
Acidum mefenamicum (synonim: Mefacit)
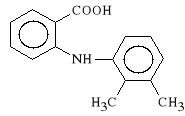
kwas 2-[(2,3-dimetylofenylo)-amino]-benzoesowy
Kwas mefenamowy dzia*a p/zapalnie, p/gor*czkowo i p/b*lowo. Jest inhibitorem cyklooksygenazy prostaglandynowej. Hamuje także aktywno** bradykininy oraz zapobiega agregacji p*ytek krwi. W organi*mie ulega biotransformacji tworz*c 3-hydroksypodstawion* pochodn*, czyli kwas N-(2,3-dimetylofenylo)-3-hydroksyantralinowy. Za wzrost si*y dzia*ania kwasu mefenamowego odpowiedzialny jest lipofilowy podstawnik dimetylofenylowy.
Mefacit jest stosowany w b*lach reumatycznych, w reumatoidalnym zapaleniu staw*w, w zapaleniu korzonk*w nerwowych, w chorobie zwyrodnieniowej staw*w, a tak*e w b*lach r**nego pochodzenia (b*le urazowe, mi**niowe, bolesne miesi*czkowanie).
Acidum niflumicum (synonim: Donalgin)
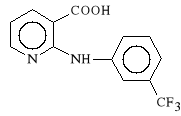
kwas 2-[(3-trifluorometylofenylo)-amino]-3-pirydynokarboksylowy
Kwas niflumowy dzia*a szybko i silnie p/b*lowo oraz p/zapalnie. Jest inhibitorem cyklooksygenazy, hamuje ponadto aktywno** bradykinin.
Stosowany jest w chorobach go**cowych, w reumatoidalnym zapaleniu staw*w, w zesztywniaj*cym zapaleniu staw*w kr*gos*upa oraz w rwie kulszowej.
ad. 3. Pochodne heterocykicznych endo- i okso- kwas*w karboksylowych:
a. oksykamy:
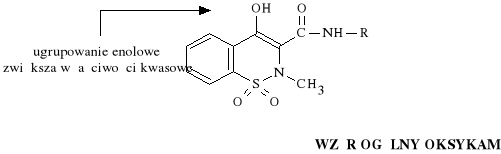
N-podstawione amidy 1,1-ditlenku
kwasu 4-hydroksy-2-metylobenzo-1,2-tiazyno-3-karboksylowego
Piroxicamum (synonim: Piroxicam, Feldene)
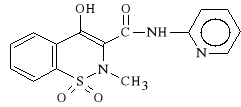
1,1-ditlenek-4-hydroksy-2-metylo-N-(2-pirydylo)-2H-benzo-1,2-tiazyno-
-3-karboksamidu
Piroxicam nale*y do najd*u*ej dzia*aj*cych niesteroidowych lek*w przeciwzapalnych (jego T1/2 = 42 - 48 h). Dzia*a p/zapalnie, p/gor*czkowo i p/b*lowo. Zwi*ksza wydzielanie kwasu moczowego z organizmu i zapobiega odk*adaniu si* z*og*w moczanowych w stawach. *atwo przenika do staw*w. Si*a dzia*ania p/zapalnego Piroxicamu jest por*wnywalna z si** dzia*ania Indometacyny. Piroxicam cechuje si* ponadto mniejsz* toksyczno*ci* od Indometacyny oraz Fenylobutazonu, dlatego te* jest do** dobrze tolerowany przez organizm i tylko sporadycznie dzia*a wrzodotw*rczo.
Piroxicam nale*y do wybi*rczych i odwracalnych inhibitor*w cyklooksygenazy prostaglandynowej. Hamuje r*wnie* migracj* granulocyt*w obojetnoch*onnych do ogniska zapalnego, nawet w obecno*ci prostaglandyn. W w*trobie ulega biotransformacji do nieczynnych farmakologicznie metabolit*w.
Piroxicam jest stosowany w chorobach reumatycznych i go**cowych, w reumatoidalnym zapaleniu staw*w (u m*odzie*y i doros*ych), w zapaleniu korzonk*w nerwowych, nerwob*li, b*li kr*gos*upa, a tak*e w *agodzeniu b*li zwyrodnieniowych, mi**niowych i pooperacyjnych.
b. pochodne pirydopirymidonu:
Rimazolii methylsulfas (synonim: Probon)
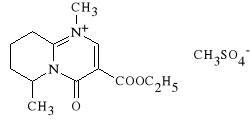
metylosiarczan 3-etoksykarbonylo-4,5,6,7,8,9-heksahydro-1,6-dimetylo-
-4-oksopirydo [1,2-a] pirynidyny
Lek dzia*a g**wnie p/b*lowo i s*abo p/zapalnie. Stosowany jest w b*lach kostnostawowych, mi**niowych, a także w innych b*lach, r**nego pochodzenia, o charakterze ostrym i przewlek*ym.
POCHODNE KWASÓW ARYLO-ALKANO-KARBOKSYLOWYCH
ad. 1. Pochodne kwasu arylooctowego:
Indometacinum (synonim: Metindol, Metindonium, Indocid)
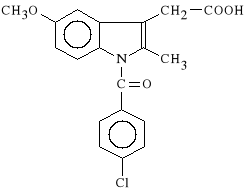
kwas 1-(4-chlorobenzoilo)-5-metoksy-2-metylo-3-indolilooctowy
Indometacyna jest jednym z najsilniej dzia*aj*cych lek*w p/zapalnych z grupy NSLP, charakteryzuje si* te* najwi*ksz* toksyczno*ci*. Dzia*a bardzo silnie p/zapalnie, silnie p/b*lowo i s*abo p/gor*czkowo.
Indometacyna silnie hamuje aktywno** cyklooksygenazy, zwi*ksza wydalanie kwasu moczowego z organizmu, hamuje migrację granulocyt*w do m*zgu i syntez* mukopolisacharyd*w a także zaburza procesy fosforylacji i oksydacji.
Jest to lek skuteczny ale toksyczny, powoduje wyst*pienie wielu niepo**danych objaw*w. S* to g**wnie zaburzenia ze strony uk*adu pokarmowego (owrzodzenia, krwawienia), uk*adu krwiotw*rczego (agranulocytoza, niedokrwisto**) oraz ze strony o*rodkowego uk*adu nerwowego (Indometacyna bezpo*rednio wp*ywa na struktury podkorowe powoduj*c ospa*o**, depresj* i drgawki). Przeciwwskazaniem dla stosowania Indometacyny jest choroba wrzodowa i skaza krwotoczna.
Indometacyna stosowana jest w chorobach reumatycznych, w reumatoidalnym zapaleniu staw*w, zesztywniaj*cym zapaleniu staw*w kr*gos*upa, w chorobach go**cowych narz*du ruchu, w napadach dny moczanowej, a tak*e w okulistyce miejscowo na oko po operacji usuni*cia za*my.
Sulindacum (synonim: Clinoril, Aflodac)
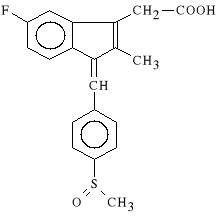
kwas 5-fluoro-2-metylo-1-[4-(metylosulfinylo)-benzylideno]-indeno-3-octowy
Zwi*zek ten jest prolekiem, kt*ry w w*trobie ulega biotransformacji do czynnego farmakologicznie metabolitu (tioeteru alkilo-aromatycznego):
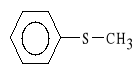
tioetermetylo-fenylowy
Aktywny farmakologicznie metylotiobenzen charakteryzuje si* d*ugotrwa*ym dzia*aniem (T1/2 = 18 h) p/b*lowym, p/zapalnym i p/goraczkowym. Zwi*ksza wydalanie kwasu moczowego z organizmu. Dzia*a o po*ow* s*abiej od Indometacyny, ale jest od niej znacznie mniej toksyczny.
Lek ten jest stosowany w reumatoidalnym zapaleniu staw*w, zesztywniaj*cym zapaleniu staw*w kr*gos*upa, w zapaleniu torebki stawowej i zapaleniu oko*ostawowym. Stosuje się go również w dnie moczanowej.
Diclofenacum Natricum (synonim: Voltaren, Majamil, Feloran, Revodina)
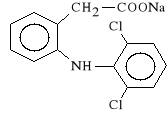
s*l sodowa kwasu 2-[(2,6-dichlorofenylo)-amino]-fenylooctowego
Voltaren charakteryzuje si* silnym dzia*aniem p/zapalnym, a tak*e p/b*lowym i p/gor*czkowym. Nale*y do najaktywniejszych inhibitor*w COX. Dzia*a silniej od salicylan*w, fenamat*w i profen*w oraz nieco s*abiej od Indometacyny, ale znacznie kr*cej (T1/2 = 1 - 2 h). Zwi*ksza wydalanie kwasu moczowego z organizmu.
Lek dobrze wch*ania si* z przewodu pokarmowego, podawany jest doustnie i doodbytniczo, *atwo kumuluje si* w przestrzeni stawowej. Jego toksyczno** jest po*rednia mi*dzy salicylanami i Indometacyn*. Powoduje wrzodziej*ce zmiany *luz*wki przewodu pokarmowego, nadżerki, a także wywo*uje reakcje uczuleniowe.
Voltaren stosowany jest og*lnoustrojowo i miejscowo w nerwob*lach, w zespole bolesnego barku, w chorobach reumatycznych, w reumatoidalnym zapaleniu staw*w, w zesztywniaj*cym zapaleniu staw*w kr*gos*upa, w zapaleniu wi*zade* mi**ni i staw*w, a tak*e w okulistyce miejscowo na oko po operacji usuni*cia za*my.
Tolmetinum natricum dihydratum (synonim: Tolectin)
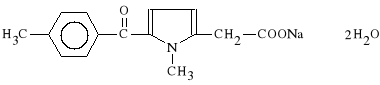
s*l sodowa kwasu 1-metylo-5-(p-metylobenzoilo)-1H-2-pirolilooctowego
Tolmetyna dzia*a p/zapalnie, p/b*lowo, p/gor*czkowo. Jej si*a dzia*ania jest por*wnywalna z si** dzia*ania kwasu acetylosalicylowego, ale s*absza ni* Indometacyny. Nie kumuluje si* w organi*mie i nie leczy dny moczanowej. Stosowana jest tak jak leki wyżej wymienione.
ad. 2. Pochodne kwasu arylopropionowego:
Ibuprofenum (synonim: Ibuprofen, Brufen)
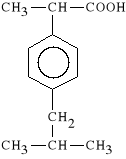
kwas 2-(p-izobutylofenylo)-propionowy
Ibuprofen jest inhibitorem COX, dzia*a p/zapalnie, p/b*lowo, p/gor*czkowo. Dzia*a nieco s*abiej od kwasu acetylosalicylowego. Jest od niego mniej toksyczny i mo*e by* stosowany u pacjentów z chorob* wrzodow*. Jego czas półtrwania wynosi T1/2 = 2,5 h.
Jest stosowany w chorobach reumatycznych, m. in. w reumatoidalnym zapaleniu staw*w. Rzadziej podawany jest w innych stanach b*lowych. Wskazaniem do stosowania Ibuprofenu jest z*a tolerancja organizmu na kwas acetylosalicylowy.
Ketoprofenum (synonim: Profenid, Profenid prolongatum)
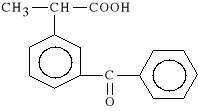
kwas 2-(m-benzoilofenylo)-propionowy
Lek dzia*a silnie p/b*lowo, p/zapalnie i p/gor*czkowo. Hamuje aktywno** cyklooksygenazy oraz bradykininy. Ketoprofen stosowany jest w r**nych postaciach choroby reumatycznej, g**wnie w reumatoidalnym zapaleniu staw*w ale tak*e w umiarkowanych i silnych b*lach pochodzenia niereumatoidalnego (urazy, st*uczenia, skr*cenia staw*w).
Flurbiprofenum (synonim: Flugalin)
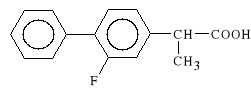
kwas 2-(2-fluoro-4-bifenylilo)-propionowy
Lek dzia*a p/zapalnie, p/b*lowo i p/gor*czkowo. Si*a dzia*ania oraz toksyczno** Flurbiprofenu jest po*rednia pomi*dzy Ibuprofenem a Fenbufenem. W ma*ych dawkach lek hamuje agregacj* p*ytek krwi. Stosowany jest podobnie jak Ibuprofen tj. w chorobach reumatycznych m.in. w reumatoidalnym zapaleniu staw*w.
Fenbufenum (synonim: Conopal)
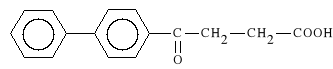
kwas 3-[(4-bifenylilo)-karbonylo]-propionowy
Fenbufen dzia*a p/zapalnie i p/b*lowo podobnie do Ibuprofenu, ale ma d*u*szy okres trwania efektu terapeutycznego (mo*e by* podawany co 12 godzin). Jest dobrze tolerowany przez organizm.
Fenbufen stosowany jest, podobnie jak poprzednie leki z tej grupy, g**wnie w r**nych postaciach choroby reumatycznej.
Naproxenum natricum (synonim: Naprosyn)
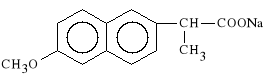
s*l sodowa kwasu D-2-(6-metoksy-2-fenylo)-propionowego
Naproxen działa najsilniej p/zapalnie ze wszystkich pochodnych kwasu propionowego (jest tak*e najbardziej toksyczny). Wykazuje równie* w*a*ciwo*ci p/b*lowe i p/gor*czkowe.
W organi*mie ulega w ca*o*ci biotransformacji; ca*kowicie wi**e si* z bia*kami surowicy krwi. Dzia*a d*ugotrwale (T1/2 = 14 h) poprzez hamowanie aktywno*ci cyklooksygenazy prostaglandynowej.
Lek ten powoduje wyst*pienie wielu dzia*a* nieporz*danych, przy czym sa to g**wnie zaburzenia ze strony przewodu pokarmowego (owrzodzenia, krwawienia).
Naproxen stosowany jest w ostrych i przewlek*ych stanach zapalnych ko*ci i tkanek, w napadach dny moczanowej, a tak*e w zwalczaniu b*lu o *rednim nat**eniu i r**nym pochodzeniu.
Nabumetonum (synonim: Relifex)
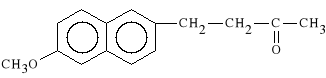
4-(6-metoksy-2-naftylo)-2-butanon
Zwi*zek powy*szy jest prolekiem, ulegaj*cym w w*trobie biotransformacji do czynnego farmakologicznie metabolitu:
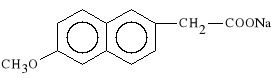
kwas 6-metoksy-2-naftylooctowy
Nabumeton, w formie proleku, bardzo s*abo hamuje aktywno** COX, natomiast jego aktywny metabolit charakteryzuje si* siln* inhibicj* cyklooksygenazy prostaglandynowej. Dzia*a silnie i d*ugotrwale p/zapalnie oraz p/b*lowo (T1/2 = 24 h).
Nabumeton podawany jest w chorobie reumatycznej, przy reumatoidalnym zapaleniu staw*w oraz w chorobie zwyrodnieniowej staw*w.
Acidum tiaprofenicum (synonim: Surgam)
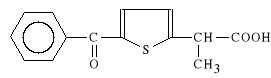
kwas 2-(5-benzoilo-2-tienylo)-propionowego
Lek ten dzia*a silnie p/b*lowo, a tak*e p/obrz*kowo, p/zapalnie, i p/gor*czkowo. Si*a dzia*ania tego leku jest podobna do Naproxenu.
Stosowany jest g**wnie w reumatologii - w zapaleniu torebki stawowej, w reumatoidalnym zapaleniu staw*w, w rwie kulszowej. Jest r*wnie* podawany przy z*amaniach, st*uczeniach, w b*lach pooperacyjnych (zabiegi ortopedyczne, chirurgia plastyczna), w zapaleniu *y* i po ekstrakcji z*b*w.
OKSOPOCHODNE PIRAZOLINY I PIRAZOLIDYNY
ad. 1. Pochodne pirazolin-5-onu:
wykazuj* g**wnie dzia*anie p/b*lowe i p/zapalne, nie wykazuj* zaś w*a*ciwo*ci p/zapalnych;
niekt*re z nich dzia*aj* spazmolitycznie;
Jest to starsza grupa lek*w wprowadzona do lecznictwa pod koniec ubieg*ego wieku. Charakteryzuja si* du** toksyczno*ci* - uszkadzaj* szpik, dzia*aj* kancerogennie, powoduj* tak*e agranulocytoz*, owrzodzenia gard*a i jamy ustnej, uszkadzaj* narz*dy mi**szowe (nerki, w*troba) oraz wywo*uja reakcje uczuleniowe.
Zwi*zki będ*ce pochodnymi pirazolino-5-onu hamuj* aktywno** COX tylko w o*rodkowym uk*adzie nerwowym, nie dzia*aj* zaś na obwodzie i tym samym nie dzia*aj* p/zapalnie.
zale*no** dzia*ania od budowy pochodnych pirazoliny
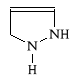
∗ niepodstawina pirazolina nie wykazuje w*a*ciwo*ci farmakologicznych;
∗ aktywo** farmakologiczn* wyk*zuj* zar*wno 3-okso- jak i 5-okso-pochodne pirazoliny, ale 5-oksopochodne charakteryzują si* silniejszym dzia*aniem leczniczym;
∗ dla wyst*pienia efektu farmakologicznego konieczna jest r*wnie* obecno** podstawnik*w przy atomach azotu:
- N1 - zazwyczaj fenyl;
- N2 - zazwyczaj grupa metylowa, ale korzystne jest wprowadzenie podstawnika rozga**zionego;
∗ obecno** atom*w wodoru przy w*glu C4, sprawia *e pochodne te s* bardzo aktywne chemicznie - w organi*mie ulegaj* r**norodnym przemianom metabolicznym;
∗ optymalnym dzia*aniem p/b*lowym i p/gor*czkowym charakteryzuj* si* pochodne zawieraj*ce grup* aminow* przy C4; jednocze*nie s* one bardzo niebezpieczne, ponieważ ulegaj* przemian* do zwiazk*w kancerogennych (np. Aminophenazonum)
Phenazonum (synonim: Antypiryna, Fenazon)
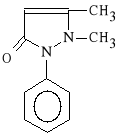
2,3-dimetylo-1-fenylo-3-pirazolin-5-on
Fenazon dzia*a p/b*lowo, p/gor*czkowo i spazmolitycznie. Jest lekiem bardzo toksycznym - ju* w ma*ych dawkach powoduje obrz*k b*on *luzowych, wzmo*one pocenie si*, senno** i zawroty g*owy.
*atwo wch*ania si* z przewodu pokarmowego, szybko osi*gając maksymalne st**enie we krwi. W organi*mie metabolizowany jest m. in. do 4-hydroksyantypiryny i w postacj glukuronian*w wydalany jest z moczem. Fenazon, z uwagi na niepodstawione atomy wodoru przy C4, jest zwi*zkiem bardzo reaktywnym.
Obecnie fenazon stosowany jest wy**cznie w mieszankach recepturowych przy nerwob*lach, b*lach staw*w i mi**ni, w migrenie, przy bolesnym miesi*czkowaniu oraz w przezi*bieniach. Nie mo*e by* podawany przez d*u*szy czas.
Aminophenazonum (synonim: Pyramidonum, Amidophen)
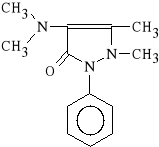
1-fenylo-2,3-dimetylo-4-(dimetyloamino)-3-pirazolin-5-on
Wprowadzenie ugrupowania dimetyloaminowego w pozycj* 4 doprowadzi*o do optymalizacji dzia*ania p/b*lowego i p/gor*czkowego. Jednocze*nie wzros*a toksyczno** leku. Powoduje on m. in. uszkodzenie szpiku, w*troby oraz innych narz*d*w mi**szowych. Lek zwi*ksza ponadto ryzyko wyst*pienia choroby nowotworowej.
Pyramidon wykazuje aktywno** p/b*low* i p/gor*czkow* silniejsz* od fenazonu oraz salicylan*w. Jest inhibitorem cyklooksygenazy - g**wnie w o*rodkowym uk*adzie nerwowym - dlatego te* nie wykazuje (lub prawie nie wykazuje) dzia*ania p/zapalnego.
Pyramidon *atwo wch*ania si* z przewodu pokarmowego, osi*gaj*c maksymalne st**enie w surowicy krwi po około jednej godzinie. W w*trobie ulega biotransformacji, w wyniku kt*rej odszczepieniu ulega grupa dimetyloaminowa:
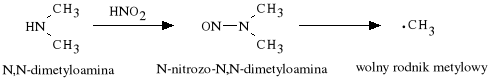
Dimetyloamina ulega nitrozowaniu, w wyniku czego powstaj* nitrozopochodne uwalniaj*ce rodniki metylowe, kt*re z kolei wchodz* w reakcje z zasadami kwas*w nukleinowych - prowadzi to do zaburze* w syntezie bia*ek (kancerogenno**).
Aminophenazon stosowany jest jako lek typowo objawowy przy podwy*szonej temperaturze (grypa, angina). Obecnie jest raczej rzadko stosowany. Wchodzi w sk*ad nast*puj*cych lek*w z*o*onych:
GARDAN - Aminofenazon, s*l sodowa metamizolu;
PABIALGINA - Aminofenazon, Allobarbital;
VERAMID - Aminofenazon, Veronal (Barbital);
VEGANTALGIN - Aminofenazon, Allobarbital, chlorowodorek adyfeniny;
Propyphenazonum (synonim: Arantil P)
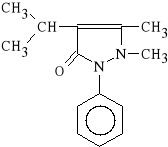
1-fenylo-2,3-dimetylo-4-izopropylo-3-pirazolin-5-on
Propyfenazon dzia*a kilkakrotnie silniej p/b*lowo i p/gor*czkowo od Aminophenazonu. Jest jednocze*nie mniej toksyczny (nie zwi*ksza ryzyka choroby nowotworowej), albowiem ma inny metabolizm niż Aminophenazon. W niekt*rych krajach zast*pi* ca*kowicie Aminophenazon.
GARDAN P - Propyfenazon, s*l sodowa metamizolu;
PABIALGINA P - Propyfenazon, Allobarbital;
Metamizolum natricum (synonim: Pyralginum, Analgin, Dipyron, Novalgina)
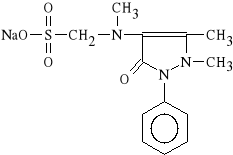
N-(1-fenylo-2,3-dimetylo-5-okso-pirazolin-4-ylo)-N-metylo-
-aminometanosulfonian sodu
Pyralgin jest najsilniej dzia*aj*cym lekiem p/b*lowo z tej grupy. Dzia*a tak*e p/gor*czkowo silniej od salicylan*w. Wykazuje ponadto s*abe w*a*ciwo*ci spazmolityczne oraz s*abe lub bardzo s*abe dzia*anie p/zapalne (Pyralgin hamuje aktywno** COX g**wnie w o*rodkowym uk*adzie nerwowym).
Lek podawany jest doustnie, w injekcji do*ylnej (*atwo rozpuszcza si* w wodzie) lub doodbytniczo. Pyralgin cechuje stosunkowo wysoka toksyczno** - powoduje zaburzenia ze strony przewodu pokarmowego, objawy uczuleniowe oraz uszkodzenie szpiku.
Pyralgin stosowany jest w stanach skurczowych przewodu pokarmowego, dr*g ***ciowych i moczowych, w napadach kolki w*trobowej, nerkowej i jelitowej oraz w nerwob*lach.
Pyralgin cz*sto kojarzony jest z miolitykami i cholinolitykami lub innymi lekami przeciwb*lowymi np.:
TOLARGIN - Pyralgin, chlorowodorek papaweryny, metyloazotan atropiny;
SCOPOLAN - Pyralgin, bromek N-butyloscopolaminy;
GARDAN - Pyralgin, Aminofenazon;
ad. 2. Pochodne pirazolidyn-3,5-dionu:
wykazuj* g**wnie dzia*anie p/zapalne i p/reumatyczne;
zale*no** działania od budowy pochodnych pirazolidyn-3,5-dionu
* utworzenie drugiego ugrupowania karbonylowego (przy C3) w uk*adzie 5-oksopirazoliny daje pochodne pirazolidyn-3,5-dionu;
* dla dzia*ania farmakologicznego najkorzystniejsze jest, gdy podstwniki R s* fenylami;
* korzystnie na w*a*ciwo*ci farmakologiczne pochodnych pirazolidyn-3,5-dionu wp*ywa tak*e podstawienie jednego z atom*w wodor*w przy C4 podstawnikiem alkilowym (np. n-butylowym); podstawienie dw*ch atom*w wodoru jest niewskazane, albowiem uniemo*liwia tworzenie formy enolowej, charakteryzuj*cej się silniejszymi w*a*ciwościami kwasowymi, a wi*c silniejszym dzia*aniem p/zapalnym;
Phenylobutazonum (synonim: Butapirazol, Fenylobutazon)
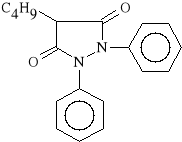
1,2-difenylo-4-n-butylopirazolidyn-3,5-dion
Butapirazol dzia*a silnie p/zapalnie i p/b*lowo, jest inhibitorem cyklooksygenazy prostaglandynowej. Zwi*ksza wydzielanie kwasu moczowego z organizmu. Silniejsze dzia*anie p/zapalne spowodowane jest mo*liwości* wyst*powania Fenylobutazonu w formie enolowej, co wi**e si* ze wzrostem w*a*ciwo*ci kwasowych zwi*zku.
Lek *atwo wch*ania się z przewodu pokarmowego, osi*gaj*c maksymalne st**enie w surowicy krwi po 30 minutach. W ustroju ulega biotransformacji daj*c aktywne farmakologicznie pochodne: oksyfenbutazon i kebuzon:
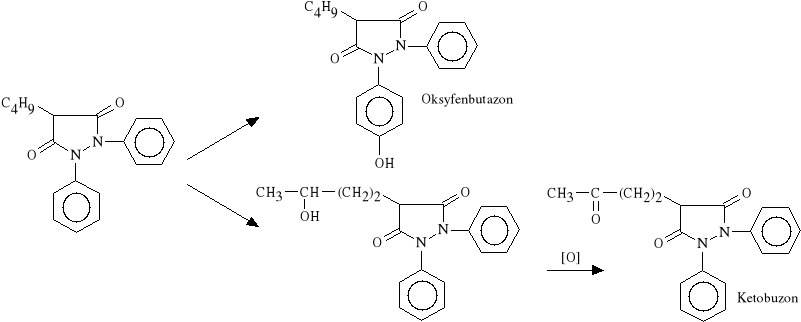
Obydwa metabolity posiadaj* w*a*ciwo*ci p/zapalne i p/reumatyczne. Dzia*aj* s*abiej od Fenylobutazonu, ale jednocze*nie charakteryzuj* si* mniejsz* toksyczno*ci*.
Fenylobutazon nal*y do lek*w bardzo toksycznych (jest na 5 miejscu w*r*d lek*w b*d*cych przyczyn* *mierci). Mo*e powodowa* podra*nienia i owrzodzenia *o**dka oraz jelit, zapalenie w*troby, krwiomocz, uszkodzenie szpiku kostnego (agranulocytoza, ma*op*ytkowo**, niedokrwisto**). Lek ten mo*e by* stosowany tylko przez kr*tki okres czasu tj. maksymalnie przez 7 - 10 dni.
Fenylobutazon stosowany jest w reumatoidalnym zapaleniu staw*w, w zesztywniaj*cym zapaleniu staw*w kr*gos*upa, w chorobie zwyrodnieniowej, w napadach dny moczanowej oraz w zakrzepowym zapaleniu *y*.
Preparaty z*o*one zawieraj*ce fenylobutazon:
RHEUMANOL - Fenylobutazon, chlorowodorek izopiryny; preparat jest stosowany kr*tkotrwale w leczeniu reumatoidalnego zapalenia staw*w, w zesztywniaj*cym zapaleniu kr*gos*upa;
CLOPHEZONUM (PERCLUSONE) - Fenylobutazon, Clofexamid (1:1); preparat ten dzia*a d*u*ej i silniej ni* sam Fenylobutazon; silnie hamuje aktywno** bradykinin, zwi*ksza tak*e wydzielanie kwasu moczowego.
Azapropazonum (synonim: Prolixan)
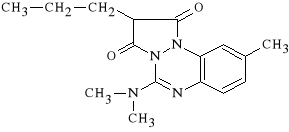
5-(dimetyloamino)-9-metylo-2-propylo-1H-pirazolo [1,2-a] [1,2,4]
benzotiazyno-1,3 -[2H]-dion
Azapropazon charakteryzuje si* mniejsz* toksyczno*ci* ni* pozosta*e leki tej grupy (jak np. Fenylobutazon). Dzia*a p/zapalnie i p/reumatycznie. Jest antagonist* bradykininy. Nie ulega biotransformacji w ustroju i jest wydalany z moczem w postaci niezmienionej. Stosowany jest g**wnie w reumatologii - reumatoidalne zapalenie staw*w, zesztywniaj*ce zapalenie stawów kr*gos*upa, zapalenie *y*, napady dny moczanowej.
POCHODNE PARA-AMINOFENOLU
Pochodne te charakteryzuj* si* silnym dzia*aniem p/gor*czkowym i p/b*lowym. Hamuj* aktywno** cyklooksygenazy tylko w o*rodkowym uk*adzie nerwowym, nie dzia*aj* zaś na obwodzie, w związku z czym nie wykazuj* w*a*ciwo*ci p/zapalnych.
Phenacetinum
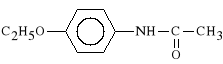
p -etoksyacetanilid
Fenacetyna hamuje syntez* prostanoid*w. Dzia*a p/gor*czkowo i p/b*lowo. Szybko wch*ania si* z przewodu pokarmowego i w 80% jest metabolizowana w w*trobie do p-aminofenolu, a następnie jest wydalana przez nerki w po**czeniu z kwasem glukuronowym. 1% Fenacetyny jest wydalany z moczem w stanie niezmienionym.
Lek ten charakteryzuje si* stosunkowo wysok* toksyczno*ci*. Powoduje m. in. niedokrwisto** hemolityczn*, methemoglobini*, uszkadza nerki i w*trob*, pora*a o*rodek oddechowy.
Fenacetyna jest stosowana g**wnie w b*lach g*owy r**nego pochodzenia, w tym pochodzenia migrenowego.
Paracetamolum (synonim: Acenol, Apap, Panadol, Paracetamol, Acetaminophen)
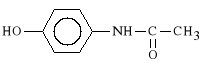
p-hydroksyacetanilid
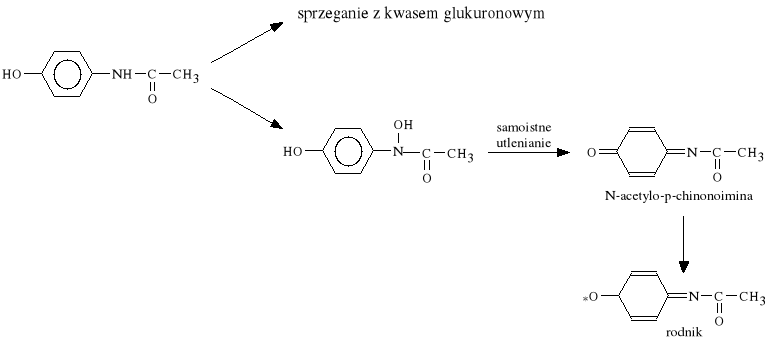
Paracetamol jest metabolitem Fenacetyny, charakteryzuj*cym si* silniejszym od niej dzia*aniem p/gor*czkowym i p/b*lowym oraz mniejsz* toksyczno*ci*.
Paracetamol wydalany jest z moczem g**wnie w postaci sprz**onej z kwasem glukuronowym, a tylko w ma*ym stopniu ulega hydroksylacji przy grupie aminowej, kt*ra nast*pnie ulega spontanicznie utlenieniu do N-acetylo-p-chinonoiminy (związek ten silnie uszkadza w*trob*). Toksyczno** paracetamolu zwi*ksza si* po spożyciu alkoholu, a jego przedawkowanie prowadzi do marsko*ci w*troby.
Paracetamol hamuje aktywno** COX w o*rodkowym uk*adzie nerwowym, dzia*a p/b*lowo poprzez podwy*szenie progu b*lowego i spadek wra*liwo*ci na dzia*anie kinin i serotoniny, natomiast jego dzia*anie p/gor*czkowe spowodowane jest spadkiem st**enia prostaglandyn w podwzg*rzu.
Paracetamol stosowany jest w ostrych i przewleklych b*lach, w migrenowych b*lach g*owy, w b*lach miesi*czkowych oraz w stanach gor*czkowych (zw*aszcza u dzieci). Wchodzi on w sk*ad wielu lek*w z*o*onych:
CEFALGIN (ANALGET, SARIDON) - Paracetamol, Kofeina, Propylofenazon;
COLDREX - Paracetamol, chlorowodorek fenylefryny, Kofeina, kwas askorbowy, wodzian terpinu;
THOMAPIRYN - Paracetamol, Kofeina, Aspiryna;
THOMAPIRYN C - Thomapiryn i kwas askorbowy;
ACENOL CUM COFFEINO - Paracetamol, Kofeina;
Metabolizm Paracetamolu
ZWIĄZKI HETEROCYKLICZNE O CHARAKTERZE ZASADOWYM (STOSOWANE W POSTACI SOLI ADDYCYJNYCH Z KWASAMI)
Benzydamini hydrochloridum (synonim: Benalgin)
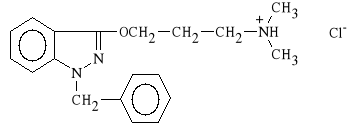
chlorowodorek 1-benzylo-3-(3-dimetyloaminopropoksy)-1H-indazolu
Lek dzia*a p/zapalnie, p/obrz*kowo i spazmolitycznie. Zmniejsza napi*cie mi**ni szkieletowych, wykazuje tak*e w*a*ciwo*ci miejscowo-znieczulaj*ce.
Stosowany jest w stanach zapalnych dr*g oddechowych, obrz*kach r**nego pochodzenia, w tym w obrz*kach pourazowych.
Chinini hydrochloridum
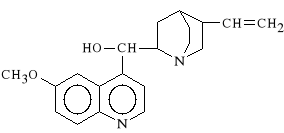
chlorowodorek (5-winylo-2-chinuklidynylo)-(6-metoksy-4-chinolilo)-metanolu
Chinina to lewoskr*tny enancjomer b*d*cy alkaloidem pochodz*cym z kory drzewa chinowego Cinchona succirubra (enancjomer prawoskr*tny - Chinidyna - jest lekiem p/arytmicznym). Chinina dzia*a p/b*lowo, p/gor*czkowo i p/malarycznie, wykazuje s*aby efekt immunosupresyjny - hamuje wytwarzanie przeciwcia* i kom*rek odporno*ciowych, co wykorzystane zosta*o w transplantologii. Hamuje r*wnie* aktywno** czynnika zapalenia odpowiedzialnego za nie*yt g*rnych dr*g oddechowych.
AMIDOCHIN - Chinina, Aminofenazon, Kofeina; preparat ten jest stosowany w pocz*tkowym stadium grypy oraz w ostrych stanach zapalnych g*rnych dr*g oddechowych;
ISOCHIN - Chinina, Salicylamid, Kofeina; lek ten stosowany jest podobnie jak preparat poprzedni.
NIESTEROIDOWE ŚRODKI P/ZAPALNE O DZIAŁANIU SWOISTYM - STOSOWANE JAKO LEKI DRUGIEGO RZUTU
W REUMATOIDALNYM ZAPALENIU STAWÓW
Chloroquini diphosphas (synonim: Arechin, Aralen)
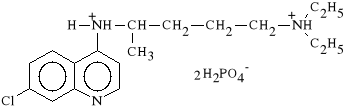
difosforan 4-(4-dietyloamino-1-metylobutyloamino)-7-chlorochinoliny
Lek wykazuje aktywno** p/malaryczn* i p/zapaln*. Ma zdolno** gromadzenia si* w lizosomach. Hamuje aktywno** enzym*w lizosomalnych, zwi*ksza pH w kom*rkach zapalnych, hamuje uwalnianie niekt*rych mediator*w stanu zapalnego (g**wnie histaminy i serotoniny). Poza tym hamuje syntez* DNA i RNA w kom*rkach bior*cych udzia* w powstawaniu odczynu zapalnego. Dzia*a pierwotniakob*jczo i immunosupresyjnie. Lek ten jest stosowany w leczeniu go**ca stawowego (poprawa nast*puje po 2-3 miesi*cach kuracji), liszaja rumieniowatego i w reumatoidalnym zapaleniu staw*w.
Penicillaminum (synonim: Cuprenil)
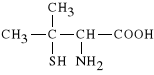
3-merkapto-D-walina
Penicylamina jest produktem rozszczepienia penicyliny, stosowanym w reumatoidalnym zapaleniu staw*w. Lek ten rozk*ada mostki dwusiarczkowe (-S-S-) w kompleksach immunoglobulin, tworz*cych si* u ludzi cierpi*cych na reumatoidalne zapalenie staw*w. Ponadto zmniejsza poziom immunoglobulin i hamuje rozwoj tkanki, czego efektem jest zmniejszenie bolesno*ci, obrz*ku i sztywno*ci staw*w. Wychwytuje tak*e kationy metali ci**kich (g**wnie Hg, Cu, Pb, Fe) tworz*c z nimy rozpuszczalne w wodzie kompleksy, kt*re nast*pnie s* wydalane z moczem.
Penicylamina stosowana jest w reumatoidalnym zapaleniu staw*w, w leczeniu choroby Wilsona, a tak*e w zatruciu metalami ci**kimi.
Arthioglucosum (synonim: Solganyl B)
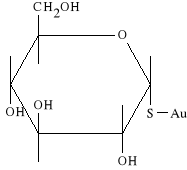
1-aurotio-D-glukopiranoza
Natrii aurothiomalas (synonim: Tauredon)
![]()
aurotiobursztynian sodu
Związki złota stabilizują błony lizosomalne, hamują aktywność enzymów lizosomalnych, hamują syntezę prostaglandyn i histaminy. Blokują grupy sulfhydrylowe białek, uniemożliwiając powstanie połączeń dwusiarczkowych w kompleksach gamma-globulin.
Związki złota charakteryzują się ponadto toksycznością w stosunku do narządów miąższowych. Powodują także wystąpienie uczuleń, białkomoczu i zawrotów głowy. Są to leki stosowane w reumatoidalnym i łuszczycowym zapaleniu stawów.
Salazosulfapyridinum (synonim: Sulfasalazin)
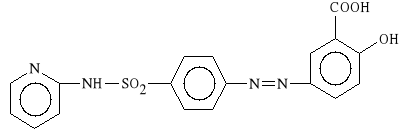
kwas 5-[p-(2-pirydylosulfamoilo)-fenylo-azo]-salicylowy
W ustroju rozpada się dając dwa czynne metabolity: sulfapirydynę (hamuje syntezę prostaglandyn) oraz kwas 5-aminosalicylowy (hamuje reumatoidalne rozszczepienie stawów). Lek łączy więc aktywność salicylanów i sulfonamidów. Stosuje się we wrzodziejącym zapaleniu jelita grubego oraz w zmianach reumatoidalnych.
Wyszukiwarka
Podobne podstrony:
Leki miejscowo znieczulające, ZDROWIE, FARMAKOLOGIA
LEKI UKŁADU NERWOWEGO, ZDROWIE, FARMAKOLOGIA
Leki narkotyczne przeciw bólowe i przeciw gorączkowe, Farmakologia01.10
LEKI PRZECIWWIRUSOWE, ZDROWIE, FARMAKOLOGIA
Leki przeciwkrwotoczne, ZDROWIE, FARMAKOLOGIA
Leki fibrynolityczne, ZDROWIE, FARMAKOLOGIA
Syntetyczne leki chemioterapeutyczne, ZDROWIE, FARMAKOLOGIA
LEKI NEUROLEPTYCZNE, ZDROWIE, FARMAKOLOGIA
LEKI STOSOWANE W OSTREJ I PRZEWLEKŁEJ NIEWYDOLNOŚCI MIĘŚNIA SERCOWEGO, ZDROWIE, FARMAKOLOGIA
Test leki p-bólowe 07-08, Płyta farmacja Poznań, IV rok, FARMAKOLOGIA, pytaniafarmakologia
Leki narkotyczne przeciw bólowe i przeciw gorączkowe, Farmakologia01.10
Leki porażające układ współczulny, Farmakologia
far leki miejscowo znieczulające, Farmacja, Farmakologia(1), Znieczulenie miejscowe
4. Leki przeciwpadaczkowe, Ratownictwo Medyczne, FARMAKOLOGIA, 2 ROK, 4
Leki w ratownictwie, Ratownictwo Medyczne, Farmakologia, Leki
więcej podobnych podstron