3.1
Aminokwasy są związkami organicznymi posiadającymi dwie grupy funkcyjne: karboksylową i aminową oraz różnicującą je resztę aminokwasową (R - łańcuch boczny)
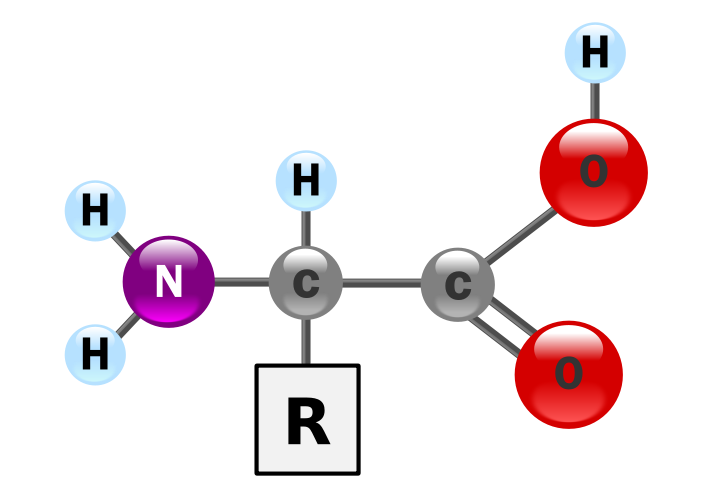
3.2
Alifatyczny - Alanina H2N - CH - COOH
|
CH3
Z grupą hydroksylową (-OH) - Seryna H2N - CH - COOH
|
HO - CH2
Siarkowy - Cysteina H2N - CH - COOH
|
HS - CH2
Aromatyczny - Fenyloalanina H2N - CH - COOH
|
CH2
|
Amidowy - Asparaganina H2N - CH - COOH
|
CH2
|
CONH2
Kwasowy - Kwas Asparaginowy H2N - CH - COOH
|
CH2
|
COOH
Zasadowy - Lizyna H2N - CH - COOH
|
CH2
|
CH2
||
CH2
|
H2N - CH2
3.3
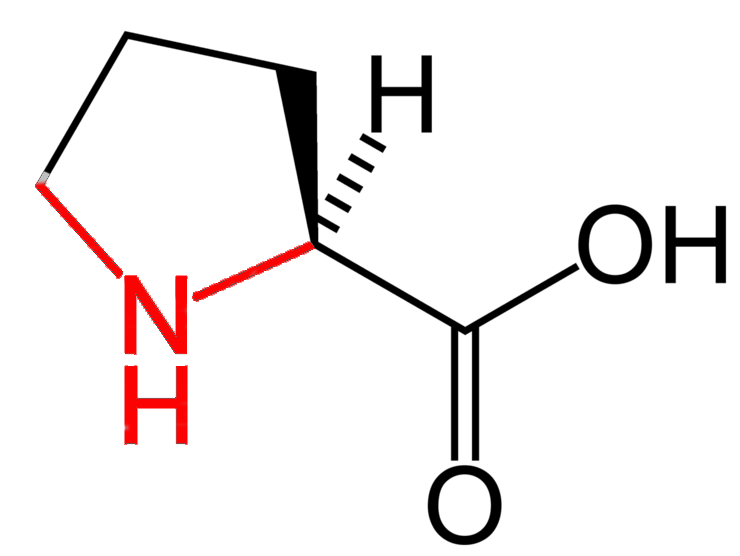
Z wyjątkiem proliny (i jej pochodnych) grupa aminowa aminokwasów jest grupą pierwszorzędową (N wiąże się tylko z 1 atomem C, czyli -NH2), wspomniana prolina jest natomiast aminą drugorzędową.
3.4
L-Walina
L-Leucyna
L-Izoleuzyna
L-Fenyloalanina
L-Cysteina
L-Metionina
L-Tryptofan
L-Lizyna
3.5
W białkach znaleźć można też aminokwasy niekodowane w kodzie genetycznym, powstające najczęściej poprzez modyfikacje aminokwasów kodowanych. Dobrym przykładem jest cystyna będąca dimerem cysteiny połączonej wiązaniem (mostkiem) disiarczkowym, ale też hydroksyprolina, czy selenocysteina (bywa, że jest kodowana kodonem stop UGA).
3.6
W organizmach występuje też wiele aminokwasów nietworzących białek (aminokwasów niebiałkowych).
Jako przykład mogą służyć: lantionina, kwas 2-aminoizomasłowy (betaina alaniny), kwas 2-aminoizopropionowy (betaina glicyny), dehydroalanina, metabolity pośrednie cyklu mocznikowego: ornityna, cytrulina , czy neurotransmiter, kwas g-aminomasłowy (g-aminokwas). Wymienione betainy nie są a-aminokwasami!
Aminokwasy te występują albo jako pojedyncze związki (betaina glicyny jest w dużych ilościach gromadzona w komórkach roślinnych, np. podczas suszy), często będące metabolitami pośrednimi przemian innych aminokwasów, albo wchodzą w skład tzw. peptydów nierybosomalnych.
3.7
Peptydy nierybosomalne (NRP)
W przeciwieństwie do zwykłych białek, te peptydy są syntezowane bez udziału aparatury translacyjnej przez syntetazę peptydowów nierybosomowych (NRPS nonribosomal peptide synthetases) z aminokwasów jako substratów.
NRP budowane są zarówno przez aminokwasy białkowe jak i niebiałkowe: D-aminokwasy, aminokwasy modyfikowane N-metylacją i N-formylacją, czy też glikozylowane, acylowane, hydroksylowane, a nawet halogenizowane. Czasami seryna jest modyfikowana przez dehydratację co skutkuje powstaniem dehydroalaniny.
NRP są często cykliczne, dodatkowo rozgałęzione. Cyklizacja nie zawsze jest efektem zamknięcia łańcucha wiązaniem peptydowym, ale bywa rozwiązana przez reakcję zamknięcia przez atomy tlenu czy siarki, które mogą podlegać dalszemu utlenianiu lub redukcji.
NRP mogą być także dimerami albo trimerami identycznych sekwencji monomerowych, które są zamknięte w pierścień lub rozgałęzione.
Te i szereg innych modyfikacji zapewniają bardzo dużą rozmaitość tej klasy związków i pomimo tego, że zwykle składają się one z mniejszej ilości jednostek monomerowych (aminokwasów) niż przeciętne białko, po uwzględnieniu modyfikacji ich zmienność jest także bardzo wysoka.
W związku z tym, peptydy nierybosomalne są niezwykle różnorodną rodziną związków organicznych o bardzo szerokim przekroju funkcji i aktywności biologicznych, w tym o aktywnościach farmakologicznych. Często są one toksynami (owady, gady), sideroforami (u roślin i mikroorganizmów związki chelatujące jony żelaza) czy barwnikami (zwierzęta). W tej klasie występuje wiele antybiotyków, cytostatyków i substancji immunosupresyjnych, także dostępnych handlowo
3.8
Funkcje białek:
a) Kataliza enzymatyczna
b) Utrzymywanie struktury (cytoszkielet)
c) Transport:
Kontrola przenikalności błon
Wytwarzanie i przekazywanie impulsów nerwowych
d) Magazynowanie
e) Ruch uporządkowany - np. skurcz mięśnia
f) Receptorowa:
Receptory czynników fizycznych
Receptory czynników chemicznych i biologicznych:
- Receptory chemiczne (np. smaku, zapachu)
- Receptory hormonów
- Przeciwciała
g) Sygnałowa: hormony, czynniki wzrostowe
h) Toksyny (zwierzęta, grzyby, rośliny)
3.9
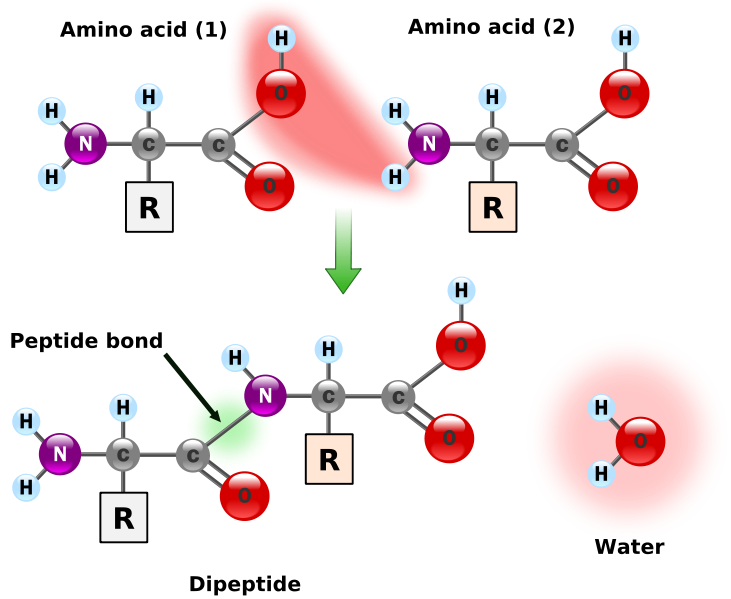
Struktura pierwszorzędowa białka - zwana również strukturą pierwotną - jest określona przez sekwencję (kolejność) aminokwasów w łańcuchu białkowym. Powstaje ona poprzez wytwarzanie wiązań peptydowych pomiędzy aminokwasami.
Wiązania peptydowe są płaskie, tzn. wszystkie tworzące je atomy leżą w jednej płaszczyźnie. Obrót możliwy jest tylko w zaznaczonych miejscach - reszty aminokwasowe kręcą się dookoła łańcuch tworzonego przez wiązanie peptydowe i węgle alfa.
3.11
Struktura drugorzędowa białka - są to lokalne struktury powstające w wyniku tworzenia się wiązań wodorowych pomiędzy tlenem grupy -C=O, a wodorem grupy -NH dwóch niezbyt odległych od siebie w łańcuchu wiązań peptydowych. Maksymalne zagęszczenie takich wiązań (największe obniżenie energii wewnętrznej) osiągnąć można na 2 sposoby. Najbardziej stabilna jest struktura α (następuje największy spadek energii swobodnej, tworzy się więcej wiązań wodorowych i są one silniejsze) jednakże największe łańcuchy boczne nie mogą się zmieścić w niej obok siebie i wtedy tworzą się struktury β - w zależności od przebiegu łańcucha: równoległa bądź antyrównoległa. W cząsteczkach motywy struktur α i β połączone są fragmentami łącznikowymi (tu też preferowane są określone, krótkie motywy).
3.12
Struktura trzeciorzędowa białka - wzajemne położenie elementów struktury drugorzędowej stabilizowane przez oddziaływania reszt aminokwasowych oraz tworzenie mostków dwusiarczkowych -S-S- , powstających pomiędzy dwiema resztami cysteiny
Struktura czwartorzędowa białka - opisuje ilość i wzajemne ułożenie podjednostek cząsteczkowych (pojedynczych łańcuchów) białek wraz z ewentualnymi częściami niebiałkowymi.
3.13
Klasyfikacja strukturalna białek - umożliwia wnioskowanie o ich funkcji, a także właściwościach katalitycznych
1. Białka zawierające jedynie strukturę α - Cytochrom c
2. Białka zawierające jedynie strukturę β - Transferaza glikozylowa
3.Białka zawierające struktury α i β (α/β), głównie struktura β równoległa (β-α-β) - Izomeraza fosforanów trioz (2,3 - 1,3)
4.Białka zawierające struktury α i β (α + β) głównie antyrównoległa struktura β (regiony α i β są rozdzielone)
5. Białka multidomenowe (α i β) zawierają domeny należące do różnych klas - Polimeraza DNA
6.Białka membranowe i powierzchniowe komórek np. białka LHC, białka kanałowe - Bakteriorodopsyna
7. Małe białka. Zwykle zdominowane przez ligandy metali, hem i/albo mostki dwusiarczkowe, np. białka toksyn - Fasciculina
8. Białka o strukturze liniowych zwojów (coiled coil) - GAL4 (czynniki transkrypcyjny)
9. Struktury białkowe o niskiej rozdzielczości - PSI
10. Peptydy - Endotelina
11. Białka sztucznie zaprojektowane - Białko hybrydowe
3.14
Białka złożone poza aminokwasami zwierają one cząsteczki innych związków chemicznych:
1. Fosfoproteiny
2. Glikoproteiny
3. Chromoproteiny
4. Metaloproteiny
5. Nukleoproteiny
6. Lipoproteiny
Wyszukiwarka
Podobne podstrony:
Biochemia - kolokwium[1], Studia, Semestr III, Biochemia, Wykłady
Zagadnienia na 1 kolokwium, Studia, Semestr III, Biochemia, Kolos 1
zagadnienia kol I 2012-2013, Studia, UR OŚ, semestr III, biochemia
biochemia-osr2013-2014 PLAN CW, Studia, UR OŚ, semestr III, biochemia
test z zp v z odpowiedziami, Materiały STUDIA, Semestr III, Zarządzanie projektami, od OLI Zarzadzan
Kwasy nukleinowe nowy skrypt, Studia, UR OŚ, semestr III, biochemia
Enzymy nowy skrypt, Studia, UR OŚ, semestr III, biochemia
zagadnienia kol I 2012-2013, Studia, UR OŚ, semestr III, biochemia
Własności MC, STUDIA, SEMESTR III, Materiały Ceramiczne
2013 WOiAK, Ogrodnictwo, Semestr III, Biochemia, BBBBBIOOO
Bazy Danych, STUDIA, SEMESTR III, Bazy Danych, Wykład
wzorcowy plan kont, Materiały STUDIA, Semestr III, Rachunkowość finansowa, od OLI Rachunkowość finan
materiały 5, Edukacja, studia, Semestr III, Inżynieria Materiałowa, Laboratorium, Materiały 5
ZZL-wyklady, Materiały STUDIA, Semestr III, Zarządzanie zasobami ludzkimi, ZZL
więcej podobnych podstron